完成下列问题
(1)C、N、Mg、Al、Si、Cu 是常见的六种元素,按要求回答下列问题:
①Cu位于元素周期表第_______ 周期第_______ 族。
②基态C原子核外电子排布式为_______ ;基态N原子核外有_______ 种运动状态的电子。
③基态Si原子核外电子占据的最高能级的电子云轮廓图为_______ 形。
④Mg、Al 两种元素中第一电离能较大的是_______ (填元素符号),原因为_______ 。
(2)几种元素的电负性数据如下表:
①AlF3的熔点_______ AlBr3的熔点(填“大于”、“小于”或“等于”),原因是_______ 。
②根据同一主族元素电负性递变规律,预测碘元素的电负性数值范围为_______ 。
③卤族元素之间可以形成化合物,则氯元素与碘元素形成的化合物ICl中,碘元素的化合价为_______ 。
(1)C、N、Mg、Al、Si、Cu 是常见的六种元素,按要求回答下列问题:
①Cu位于元素周期表第
②基态C原子核外电子排布式为
③基态Si原子核外电子占据的最高能级的电子云轮廓图为
④Mg、Al 两种元素中第一电离能较大的是
(2)几种元素的电负性数据如下表:
| O | F | Al | Br | …… |
| 3.5 | 4.0 | 1.5 | 2.8 | …… |
②根据同一主族元素电负性递变规律,预测碘元素的电负性数值范围为
③卤族元素之间可以形成化合物,则氯元素与碘元素形成的化合物ICl中,碘元素的化合价为
更新时间:2022-05-08 22:30:42
|
相似题推荐
【推荐1】(1)基态Ti原子的核外电子排布式为__ 。
(2)H、B、N中,原子半径最大的是__ 。根据对角线规则,B的一些化学性质与元素__ 的相似。
(3)Fe、Co、Ni在周期表中的位置为__ ,基态Fe原子的电子排布式为__ 。
(2)H、B、N中,原子半径最大的是
(3)Fe、Co、Ni在周期表中的位置为
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐2】下表是元素周期表的一部分,表中所列字母分别代表一种元素。试回答下列问题:
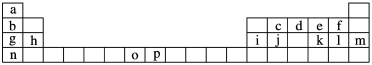
(1)①依据元素周期表的分区,元素c属于___________ 区。
②基态e离子的核外电子排布式是___________ 。
③基态g原子核外能量不同的电子有___________ 种。
④元素1的基态原子的核外电子共占据___________ 个原子轨道。
(2)将c、d、e、f四种元素按电负性由小到大的顺序排列___________ (用元素符号表示)。
(3)元素a和c可以构成多种化合物,苯就是其中的一种。以下有关苯分子中化学键的描述正确的是___________
(4)下列有关分子的空间结构,描述正确的是___________
(5)据报道,大气中存在一种潜在的温室气体 (结构如图),虽然其数量有限,但它是已知气体中吸热最高的。关于
(结构如图),虽然其数量有限,但它是已知气体中吸热最高的。关于 的说法正确的是___________
的说法正确的是___________
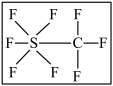
(6)表中所列的某主族元素的电离能情况如图所示,则该元素是___________ (填元素符号)。
(7)判断下列关于相关元素及元素组成的化合物的说法是否正确。(A—正确;B—错误)。
①玻璃纤维是合成纤维的一种,属于高分子材料。___________
②二氧化硫具有氧化性,可用于漂白纸浆。___________
③CaO能与 反应,可作工业废气的脱硫剂。
反应,可作工业废气的脱硫剂。___________
④制 时,用水或NaOH溶液吸收尾气。
时,用水或NaOH溶液吸收尾气。___________
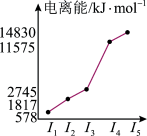
(8)o、p两元素的部分电离能数据列于下表:
比较两元素的 、
、 可知,气态
可知,气态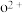 再失去一个电子比气态
再失去一个电子比气态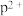 再失去一个电子难,其原因是
再失去一个电子难,其原因是___________

(1)①依据元素周期表的分区,元素c属于
②基态e离子的核外电子排布式是
③基态g原子核外能量不同的电子有
④元素1的基态原子的核外电子共占据
(2)将c、d、e、f四种元素按电负性由小到大的顺序排列
(3)元素a和c可以构成多种化合物,苯就是其中的一种。以下有关苯分子中化学键的描述正确的是___________
A.每个碳原子的一个 杂化轨道参与形成大π键 杂化轨道参与形成大π键 |
| B.每个碳原子的未参加杂化的2p轨道形成大π键 |
C.碳原子的3个 杂化轨道与其他碳原子形成2个σ键和1个π键 杂化轨道与其他碳原子形成2个σ键和1个π键 |
| D.碳原子的未参加杂化的2p轨道与其他碳原子的2p轨道成键 |
(4)下列有关分子的空间结构,描述正确的是___________
A. 分子中N原子处在3个H原子所组成的三角形的中心 分子中N原子处在3个H原子所组成的三角形的中心 |
B. 分子中C原子处在4个Cl原子所组成的四面体的中心 分子中C原子处在4个Cl原子所组成的四面体的中心 |
C. 分子中O原子处在2个H原子所连成的直线的中央 分子中O原子处在2个H原子所连成的直线的中央 |
D. 分子中P原子处在3个Cl原子所组成的三角形的中心 分子中P原子处在3个Cl原子所组成的三角形的中心 |
(5)据报道,大气中存在一种潜在的温室气体
 (结构如图),虽然其数量有限,但它是已知气体中吸热最高的。关于
(结构如图),虽然其数量有限,但它是已知气体中吸热最高的。关于 的说法正确的是___________
的说法正确的是___________
| A.分子中有σ键也有π键 |
B. 是s-pσ键 是s-pσ键 |
| C.分子中不是所有原子都满足8电子稳定结构 |
D.0.1mol 分子中电子数为8mol 分子中电子数为8mol |
(6)表中所列的某主族元素的电离能情况如图所示,则该元素是

(7)判断下列关于相关元素及元素组成的化合物的说法是否正确。(A—正确;B—错误)。
①玻璃纤维是合成纤维的一种,属于高分子材料。
②二氧化硫具有氧化性,可用于漂白纸浆。
③CaO能与
 反应,可作工业废气的脱硫剂。
反应,可作工业废气的脱硫剂。④制
 时,用水或NaOH溶液吸收尾气。
时,用水或NaOH溶液吸收尾气。(8)o、p两元素的部分电离能数据列于下表:
| 元素 | o | p |
 | 717 | 759 |
 | 1509 | 1561 |
 | 3248 | 2957 |
 、
、 可知,气态
可知,气态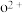 再失去一个电子比气态
再失去一个电子比气态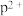 再失去一个电子难,其原因是
再失去一个电子难,其原因是
您最近一年使用:0次
【推荐3】根据所学知识,回答下列问题。
(1)第四周期元素的基态原子中,4p轨道半充满的是__________ ,3d轨道半充满的是__________ ,4s轨道半充满的是____________ 。
(2)元素X的原子最外层电子排布式为nsnnpn+1,原子中能量最高的是___________ 轨道上的电子,其电子云在空间有______________________ 伸展方向;元素X的氢化物的电子式是_____________ 。元素Y的原子最外层电子排布式为nsn-1npn+1,元素Y的氢化物的结构式_______________ ,Y的电负性比X_______ (填“大”或“小”)。在X的单质分子中,X的原子之间存在着______ 个σ键和______ 个π键。X分子中X与X形成键的键长比白磷(P4)分子中磷磷键的键长________ (填“长”或“短”);X分子中的键能比白磷(P4)分子中的键能________ (填“大”或“小”)。
(3)氯化溴(BrCl)的化学性质类似于卤素单质,氯化溴的电子式是_________ ,它是由________ 键(填“σ”或“π”)形成的。氯化溴和水反应生成了一种三原子分子,该分子的电子式为___________ 。氯化溴中溴显______ 价,原因是____________ 。
(1)第四周期元素的基态原子中,4p轨道半充满的是
(2)元素X的原子最外层电子排布式为nsnnpn+1,原子中能量最高的是
(3)氯化溴(BrCl)的化学性质类似于卤素单质,氯化溴的电子式是
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐1】很多含巯基(-SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物Ⅰ可与氧化汞生成化合物Ⅱ。
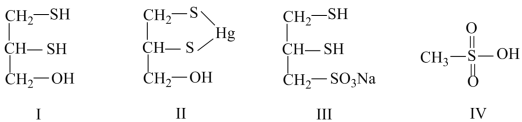
(1)1mol化合物Ⅰ含有_______ mol σ键。
(2)基态硫原子价层电子排布式为_______ 。
(3)H2S、CH4、H2O的沸点由高到低顺序为_______ 。
(4)汞的原子序数为80,位于元素周期表第_______ 周期第ⅡB族。
(5)化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有_______ 。
A.在Ⅰ中S原子采取sp3杂化
B.在Ⅱ中S元素的电负性最大
C.在Ⅲ中C-C-C键角是180°
D.在Ⅲ中存在离子键与共价键
E.在Ⅳ中硫氧键的键能均相等

(1)1mol化合物Ⅰ含有
(2)基态硫原子价层电子排布式为
(3)H2S、CH4、H2O的沸点由高到低顺序为
(4)汞的原子序数为80,位于元素周期表第
(5)化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有
A.在Ⅰ中S原子采取sp3杂化
B.在Ⅱ中S元素的电负性最大
C.在Ⅲ中C-C-C键角是180°
D.在Ⅲ中存在离子键与共价键
E.在Ⅳ中硫氧键的键能均相等
您最近一年使用:0次
【推荐2】用符号“>”或“<”表示下列各项关系。
(1)第一电离能:Na__________ Mg,Mg _______ Ca。
(2)电负性:O________ F,F ________ Cl。
(3)能量高低:ns________ (n+1)s,ns ________ np。
(1)第一电离能:Na
(2)电负性:O
(3)能量高低:ns
您最近一年使用:0次

 中电负性最大的是
中电负性最大的是

