(1)对于基态Cr原子,下列叙述正确的是
A.价层原子轨道处于半充满时体系总能量低,核外电子排布应为

B.4s是电子能量较高,一定是在比3d电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
(2)三价铬离子能形成多种配位化合物。
 中提供电子对形成配位键的原子分别是
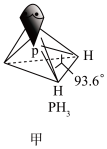
中提供电子对形成配位键的原子分别是(3)PH3的空间结构和相应的键角如图甲所示。
(4)在金属材料中添加
 颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。
颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。 具有体心四方结构,如图乙所示,其中处于顶角位置的是
具有体心四方结构,如图乙所示,其中处于顶角位置的是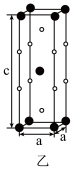
相似题推荐
(1)N、O、Mg元素的前3级电离能如下表所示:X、Y、Z中为Mg元素的是
| 元素 | I1/kJ/mol | I2/kJ/mol | I3/kJ/mol |
| X | 737.7 | 1450.7 | 7732.7 |
| Y | 1313.9 | 3388.3 | 5300.5 |
| Z | 1402.3 | 2856.0 | 4578.1 |
(2)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度来看,Fe2+易被氧化成Fe3+的原因是
(3)CO和N2分子中根据电子云重叠的方式不同,都包含的共价键类型有
| 物质 | 化学键 | ||
| 单键 | 双键 | 三键 | |
| CO | 351 | 745 | 1071.9 |
| N2 | 193 | 418 | 946 |
(4)某有机物的结构式如图所示,则分子中有

(5)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。肼可用作火箭燃料,燃烧时发生反应的热化学方程式为N2O4(1)+2N2H4(1)=3N2(g)+4H2O(g) △H=-1038.7kJ/mol。若该反应中有4mol N-H键断裂,则形成的π键有
(1)P 原子最外层共有
(2) PH3分子的空间构型为
(3) AlP遇水蒸气会发生水解反应放出 PH3气体,该反应的另一种产物的电离方程式为
(4) PH3具有强还原性,能与 CuSO4溶液反应,配平该反应的化学方程式:
工业制备 PH3 的流程如图所示。

(5)次磷酸和足量烧碱溶液反应的化学方程式为
(6)若开始时有 1mol P4参加反应,则整个工业流程中共生成
(1)铁能与CO形成配合物Fe(CO)5,其熔点为-20.50C,沸点为1020C,易溶于CCl4,据此判断Fe(CO)5晶体属于
(2)铁在元素周期表中位置是
(3)南海海底蕴藏着大量的天然气水化合物,俗称“可燃冰”。可燃冰是一种晶体,晶体中平均每46个H2O分子通过氢键构成8个笼,每个笼内可容纳1个CH4分子或1个游离的H2O分子。若晶体中每8个笼有6个容纳了CH4分子,另外2个笼被游离的H2O分子填充。可燃冰的平均组成可表示为
(4)亚磷酸(H3PO3与过量NaOH反应充分反应生成亚磷酸氢二钠(Na2HPO3),则亚磷酸氢二钠属于
(5)金刚石晶胞结构模型如右图,立方BN结构与金刚石相似,硬度与金刚石相当。在立方BN晶体中,B原子与N原子之间共价键与配位键的数目比为

(1)Ti(BH4)3 是一种储氢材料,可由 TiCl4和 LiBH4反应制得。
①基态Ti3+的电子排布式为
②LiBH4由 Li+和 BH
 构成,BH
构成,BH 的立体结构是
的立体结构是(2)金属氢化物是具有良好发展前景的储氢材料。LiH 中,离子半径:Li+
(3)氨硼烷(NH3BH3)含氢量高、热稳定性好,也是一种具有潜力的固体储氢材料。在 NH3BH3分子中,N—B化学键称为
 +9H2, B3O
+9H2, B3O 的结构如图所示:
的结构如图所示: ;在该反应中,B 原子的杂化轨道类型由
;在该反应中,B 原子的杂化轨道类型由Ⅱ.Cu2O 广泛应用于太阳能电池领域。以 CuSO4、NaOH和抗坏血酸为原料,可制备 Cu2O。
(1)Cu2+与 OH−反应能生成[Cu(OH)4]2−,[Cu(OH)4]2−中的配位原子为
(2)抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为

(1)元素E位于
(2)写出B的基态原子价层电子的轨道表示式
(3)A、B形成的AB-常作为配位化合物中的配体,其A原子的杂化方式为
(4)E、F均能与AB-形成配离子,已知E2+与AB-形成的配离子时,配位数为4;F+与AB-形成的配离子时,配位数为2。工业上常用F+与AB—形成的配离子与E单质反应,生成E2+与AB-形成的配离子和F单质来提取F,写出E置换F的离子方程式
(1) Co基态原子价电子排布式为
(2)Na[B(OH)4]可用于织物漂白。Na[B(OH)4]的化学键除了σ键外,还存在
(3)硝酸锰是工业制备中常用的催化剂,Mn(NO3)2的NO
 空间构型为
空间构型为 互为等电子体的微粒的化学式:
互为等电子体的微粒的化学式:(4)下图表示偏硼酸根的一种无限长的链式结构,其化学式可表示为

下图表示的是一种五硼酸根离子, 其中B原子的杂化方式为

(5)立方BN和立方AlN均为原子晶体,结构相似,BN的熔点高于AlN的原因为
(6)一种新型轻质储氢材料的晶胞结构如下图所示,设阿伏加德罗常数的值为NA,该晶体的密度为

 基态硼原子的价电子轨道表达式是
基态硼原子的价电子轨道表达式是 晶体硼单质的基本结构单元为正二十面体,其能自发地呈现多面体外形,这种性质称为晶体的
晶体硼单质的基本结构单元为正二十面体,其能自发地呈现多面体外形,这种性质称为晶体的 的简单氢化物
的简单氢化物 不能游离存在,常倾向于形成较稳定的
不能游离存在,常倾向于形成较稳定的 或与其他分子结合。
或与其他分子结合。 分子结构如图,则B原子的杂化方式为
分子结构如图,则B原子的杂化方式为
 氨硼烷
氨硼烷 被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的成键原子是
被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的成键原子是 填化学式
填化学式 。
。 以硼酸
以硼酸 为原料可制得硼氢化钠
为原料可制得硼氢化钠 ,它是有机合成中的重要还原剂。
,它是有机合成中的重要还原剂。 的立体构型为
的立体构型为(1)
 与
与 形成的配合物
形成的配合物 为无色液体,易溶于
为无色液体,易溶于 等有机溶剂。
等有机溶剂。 为
为 键与
键与 键个数之比为
键个数之比为(2)《诗经》言“缟衣茹藘(茜草)”,茜草中的茜素与矾土中的
 生成的红色配合物X是最早的媒染染料。
生成的红色配合物X是最早的媒染染料。
基态
 的核外电子的运动状态有
的核外电子的运动状态有 的配体除
的配体除 外还有
外还有(3)向
 溶液中滴加
溶液中滴加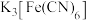 溶液后,经提纯、结晶可得到
溶液后,经提纯、结晶可得到 蓝色晶体。实验表明,
蓝色晶体。实验表明, 通过配位键构成了晶体的骨架。其局部结构如图1,记为I型立方结构。将I型立方结构平移、旋转、并置,可得到晶体的复晶胞(如图2,记为Ⅱ型立方结构,下层左后的小立方体g未标出)。
通过配位键构成了晶体的骨架。其局部结构如图1,记为I型立方结构。将I型立方结构平移、旋转、并置,可得到晶体的复晶胞(如图2,记为Ⅱ型立方结构,下层左后的小立方体g未标出)。
①通过
a、核磁共振 b、红外光谱 c、X射线衍射 d、质谱
②若
 位于Ⅱ型立方结构的棱心和体心上,则
位于Ⅱ型立方结构的棱心和体心上,则 位于Ⅱ型立方结构的
位于Ⅱ型立方结构的 ;若
;若 的摩尔质量为
的摩尔质量为 ,该蓝色晶体密度为
,该蓝色晶体密度为 ,Ⅱ型立方结构的边长为
,Ⅱ型立方结构的边长为 ,则阿伏加德罗常数的值可表示为
,则阿伏加德罗常数的值可表示为【推荐3】《旧唐书·舆服志》中关于白铜的记载:“自馀一品乘白铜饰犊车”,古时云南所产的镍白铜(铜镍合金)最为有名,称为“云白铜”,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)基态Cu原子的核外电子排布式为[Ar]
(2)向CuSO4溶液中逐滴加入氨水,首先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色透明溶液。
①在[Cu(NH3)4]2+中 Cu2+和NH3之间形成的化学键为
②[Cu(NH3)4]SO4中含有的四种非金属元素中电负性最大的是 、SO2、SO3三种微粒中,中心原子价层电子对数不同于其他微粒的是
、SO2、SO3三种微粒中,中心原子价层电子对数不同于其他微粒的是
③在[Cu(NH3)4]SO4中,NH3的中心原子的杂化轨道类型为
(3)某镍白铜合金的立方晶胞结构如图所示。

①在镍白铜合金中金属原子的堆积方式为
②若合金晶胞密度为 d g·cm-3,阿伏加德罗常数为NA,则晶胞边长为
(1)34号元素Se在周期表中的位置为
(2)基态Mg原子中,核外电子占据的原子轨道总数为
(3)
 三种元素的电负性由大到小的顺序为
三种元素的电负性由大到小的顺序为(4)
 的几何构型为
的几何构型为
(5)已知Na和O形成的一种离子化合物的晶胞结构如下图所示,则该晶胞中O的配位数为

 ,阿伏伽德罗常数的值为
,阿伏伽德罗常数的值为 ,则Na与O之间的最短距离为
,则Na与O之间的最短距离为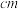 (用含
(用含 、
、 的代数式表示)。
的代数式表示)。

回答下列问题:
(1)基态N原子的核外电子排布式是
(2)g-C3N4中,C原子的杂化轨道类型为
(3)g-C3N4晶体中存在的微粒间作用力有
a.离子键 b.金属键 c.π键 d.范德华力 e.σ键
(4)由图可知NH3的键角小于CH4的键角,原因是

(5)NH3沸点比CH4的高,可作制冷剂,原因是
(6)硫酸铜溶液星天蓝色是因为[Cu(H2O)4]2+的颜色,向硫酸铜溶液中加入过量氨水,得到深蓝色透明溶液,写出生成深蓝色透明溶液的离子反应方程式
(7)由下表推测金刚石、碳化硅、晶体硅中熔点最高的是
| 金刚石(C) | 碳化硅(SiC) | 晶体硅(Si) | |
| 晶胞 |  |  |  |
| 键长/pm | 154 | 189 | 235 |
| 键能/kJ·mol-1 | 348 | 318 | 226 |
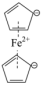 )分子式为
)分子式为 ,是具有导电性的有机配合物,其衍生物一直是科学研究的前沿。
,是具有导电性的有机配合物,其衍生物一直是科学研究的前沿。(1)Fe在周期表中的
(2)铁系元素能与CO形成Fe(CO)5、Ni(CO)5等金属羰基化合物,已知室温下Fe(CO)5为浅黄色液体,沸点为103℃,则Fe(CO)5中含有的化学键类型包括
A.离子键B.极性共价键C.配位键D.金属键
(3)二茂铁的衍生物可和H3O+等微粒产生静电作用,H、O和C的电负性由大到小的顺序为
(4)
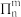 表示处于同一平面上的n个原子共用m个电子形成的大Π键,当
表示处于同一平面上的n个原子共用m个电子形成的大Π键,当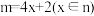 时,
时,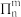 较稳定(又叫4x+2规则)。已知C5H5Θ中所有碳原子均共平面,写出C5H5Θ(
较稳定(又叫4x+2规则)。已知C5H5Θ中所有碳原子均共平面,写出C5H5Θ( )的大Π键:
)的大Π键:(5)T-碳是碳的一种同素异形体,其晶体结构可以看成是金刚石晶体(如图甲)中每个碳原子被一个由四个碳原子组成的正四面体结构单元(
 )所取代(如图乙)。
)所取代(如图乙)。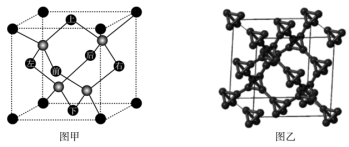
一个T-碳晶胞中含有



