以废旧锂离子电池的正极材料[活性物质为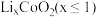 、附着物为炭黑、聚乙烯醇粘合剂、淀粉等]为原料,制备纳米钴粉和
、附着物为炭黑、聚乙烯醇粘合剂、淀粉等]为原料,制备纳米钴粉和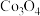 。
。
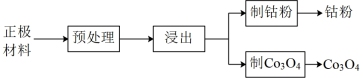
(1)预处理。将正极材料研磨成粉末后进行高温煅烧,高温煅烧的目的是_______ 。
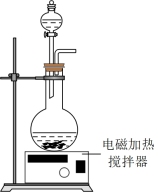
(2)浸出,将煅烧后的粉末(含 和少量难溶杂质)与硫酸混合,得到悬浊液,加入如图所示的烧瓶中。控制温度为75℃,边搅拌边通过分液漏斗滴加双氧水,充分反应后,滤去少量固体残渣。得到
和少量难溶杂质)与硫酸混合,得到悬浊液,加入如图所示的烧瓶中。控制温度为75℃,边搅拌边通过分液漏斗滴加双氧水,充分反应后,滤去少量固体残渣。得到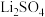 、
、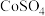 和硫酸的混合溶液。浸出实验中当观察到
和硫酸的混合溶液。浸出实验中当观察到_______ ,可以判断反应结束,不再滴加双氧水。
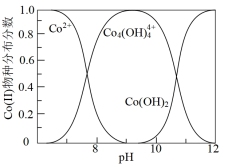
(3)制钴粉。向浸出后的溶液中加入NaOH调节pH,接着加入 可以制取单质钴粉,同时有
可以制取单质钴粉,同时有 生成。已知不同pH时Co(II)的物种分布图如图所示。Co2+可以和柠檬酸根离子(
生成。已知不同pH时Co(II)的物种分布图如图所示。Co2+可以和柠檬酸根离子( )生成配合物
)生成配合物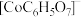 。
。
①写出pH=9时制钴粉的离子方程式:_______ 。
②pH>10后所制钴粉中由于含有Co(OH)2而导致纯度降低。若向pH>10的溶液中加入柠檬酸钠( ),可以提高钴粉的纯度,原因是
),可以提高钴粉的纯度,原因是_______ 。
(4)请补充完整由浸取后滤液先制备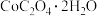 ,并进一步制取
,并进一步制取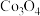 的实验方案:取浸取后滤液,
的实验方案:取浸取后滤液,_______ ,得到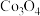 。[已知:
。[已知: 易溶于水,
易溶于水,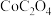 难溶于水,
难溶于水,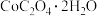 在空气中加热时的固体残留率(
在空气中加热时的固体残留率(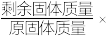 100%)与随温度的变化如图所示。实验中需使用的试剂有:2
100%)与随温度的变化如图所示。实验中需使用的试剂有:2
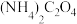 溶液、0.1
溶液、0.1 BaCl2溶液)]
BaCl2溶液)]

(5)用下列实验可以测定 的组成:
的组成:
实验1:准确你取一定质量的 样品,加入盐酸,加热至圆体完全溶解(溶液中的金属离子只存在
样品,加入盐酸,加热至圆体完全溶解(溶液中的金属离子只存在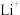 和
和 ),冷却后转移到容量瓶中并定容至100mL。
),冷却后转移到容量瓶中并定容至100mL。
实验2:移取25.00mL实验1容量瓶中溶液,加入指示剂,用0.01000 EDTA(
EDTA(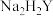 )溶液滴定至终点(滴定反应为
)溶液滴定至终点(滴定反应为 ),平行滴定3次,平均消耗EDTA溶液25.00ml。
),平行滴定3次,平均消耗EDTA溶液25.00ml。
实验3:准确称取与实验1中等质量的 样品,加入一定量的硝酸和
样品,加入一定量的硝酸和 溶液,加热至固体完全溶解。冷却后转移到容量瓶并定容至100mL。移取10.00mL溶液,通过火焰原子吸收光谱法测定其中
溶液,加热至固体完全溶解。冷却后转移到容量瓶并定容至100mL。移取10.00mL溶液,通过火焰原子吸收光谱法测定其中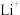 浓度为
浓度为
 。
。
计算 样品的化学式,并写出计算过程
样品的化学式,并写出计算过程_______ 。
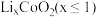 、附着物为炭黑、聚乙烯醇粘合剂、淀粉等]为原料,制备纳米钴粉和
、附着物为炭黑、聚乙烯醇粘合剂、淀粉等]为原料,制备纳米钴粉和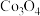 。
。
(1)预处理。将正极材料研磨成粉末后进行高温煅烧,高温煅烧的目的是
(2)浸出,将煅烧后的粉末(含
 和少量难溶杂质)与硫酸混合,得到悬浊液,加入如图所示的烧瓶中。控制温度为75℃,边搅拌边通过分液漏斗滴加双氧水,充分反应后,滤去少量固体残渣。得到
和少量难溶杂质)与硫酸混合,得到悬浊液,加入如图所示的烧瓶中。控制温度为75℃,边搅拌边通过分液漏斗滴加双氧水,充分反应后,滤去少量固体残渣。得到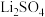 、
、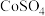 和硫酸的混合溶液。浸出实验中当观察到
和硫酸的混合溶液。浸出实验中当观察到
(3)制钴粉。向浸出后的溶液中加入NaOH调节pH,接着加入
 可以制取单质钴粉,同时有
可以制取单质钴粉,同时有 生成。已知不同pH时Co(II)的物种分布图如图所示。Co2+可以和柠檬酸根离子(
生成。已知不同pH时Co(II)的物种分布图如图所示。Co2+可以和柠檬酸根离子( )生成配合物
)生成配合物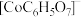 。
。
①写出pH=9时制钴粉的离子方程式:
②pH>10后所制钴粉中由于含有Co(OH)2而导致纯度降低。若向pH>10的溶液中加入柠檬酸钠(
 ),可以提高钴粉的纯度,原因是
),可以提高钴粉的纯度,原因是(4)请补充完整由浸取后滤液先制备
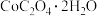 ,并进一步制取
,并进一步制取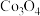 的实验方案:取浸取后滤液,
的实验方案:取浸取后滤液,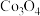 。[已知:
。[已知: 易溶于水,
易溶于水,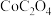 难溶于水,
难溶于水,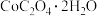 在空气中加热时的固体残留率(
在空气中加热时的固体残留率(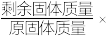 100%)与随温度的变化如图所示。实验中需使用的试剂有:2
100%)与随温度的变化如图所示。实验中需使用的试剂有:2
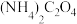 溶液、0.1
溶液、0.1 BaCl2溶液)]
BaCl2溶液)]
(5)用下列实验可以测定
 的组成:
的组成:实验1:准确你取一定质量的
 样品,加入盐酸,加热至圆体完全溶解(溶液中的金属离子只存在
样品,加入盐酸,加热至圆体完全溶解(溶液中的金属离子只存在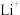 和
和 ),冷却后转移到容量瓶中并定容至100mL。
),冷却后转移到容量瓶中并定容至100mL。实验2:移取25.00mL实验1容量瓶中溶液,加入指示剂,用0.01000
 EDTA(
EDTA(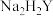 )溶液滴定至终点(滴定反应为
)溶液滴定至终点(滴定反应为 ),平行滴定3次,平均消耗EDTA溶液25.00ml。
),平行滴定3次,平均消耗EDTA溶液25.00ml。实验3:准确称取与实验1中等质量的
 样品,加入一定量的硝酸和
样品,加入一定量的硝酸和 溶液,加热至固体完全溶解。冷却后转移到容量瓶并定容至100mL。移取10.00mL溶液,通过火焰原子吸收光谱法测定其中
溶液,加热至固体完全溶解。冷却后转移到容量瓶并定容至100mL。移取10.00mL溶液,通过火焰原子吸收光谱法测定其中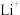 浓度为
浓度为
 。
。计算
 样品的化学式,并写出计算过程
样品的化学式,并写出计算过程
更新时间:2022-05-26 19:45:09
|
相似题推荐
解答题-实验探究题
|
困难
(0.15)
【推荐1】从宏观现象探究微观本质是重要的化学学科素养。
I. 以亚硫酸钠(Na2SO3)为实验对象,探究其性质。实验如下:
【资料1】亚硫酸(H2SO3)易分解生成SO2和H2O。
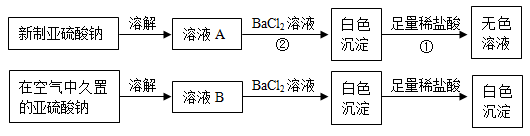
(1)写出上述实验中①、②的离子方程式_________________ ,_________________ 。
(2)通过上述实验可知,在空气中久置的亚硫酸钠固体中会混有_____________ (填化学式),亚硫酸钠在空气中变质体现了亚硫酸钠的_________________ 性。
II. 以FeCl3溶液为实验对象,探究其与碱性物质之间反应的复杂多样性。实验如下:
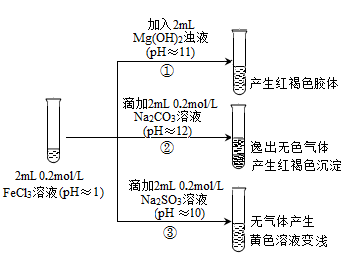
【资料2】含Fe3+的溶液中加入KSCN溶液,溶液由黄色变为红色;
含Fe2+的溶液中加入K3Fe(CN)6溶液,生成蓝色沉淀。
(1)①中反应的离子方程式是_____________________________ 。
(2)②中逸出的无色气体是_______________________________ 。
(3)对于③中的实验现象,同学们有诸多猜测,继续进行实验:
甲组:取③中反应后溶液少许,滴入稀盐酸酸化,再滴加BaCl2溶液,产生白色沉淀。得出结论:FeCl3与Na2SO3发生了氧化还原反应,离子方程式是_______________ 。
乙组:认为甲组的实验不严谨,重新设计并进行实验,证实了甲组的结论是正确的。其实验方案是_________ 。
(4)由上述实验可知,下列说法正确的是________ (填字母)。
a. 盐与碱反应时,盐和碱都必须可溶于水
b. 盐溶液可能呈中性、碱性、酸性
c. 盐与盐反应时,不一定生成两种新盐
d. 盐与盐反应时,发生的不一定是复分解反应
I. 以亚硫酸钠(Na2SO3)为实验对象,探究其性质。实验如下:
【资料1】亚硫酸(H2SO3)易分解生成SO2和H2O。

(1)写出上述实验中①、②的离子方程式
(2)通过上述实验可知,在空气中久置的亚硫酸钠固体中会混有
II. 以FeCl3溶液为实验对象,探究其与碱性物质之间反应的复杂多样性。实验如下:

【资料2】含Fe3+的溶液中加入KSCN溶液,溶液由黄色变为红色;
含Fe2+的溶液中加入K3Fe(CN)6溶液,生成蓝色沉淀。
(1)①中反应的离子方程式是
(2)②中逸出的无色气体是
(3)对于③中的实验现象,同学们有诸多猜测,继续进行实验:
甲组:取③中反应后溶液少许,滴入稀盐酸酸化,再滴加BaCl2溶液,产生白色沉淀。得出结论:FeCl3与Na2SO3发生了氧化还原反应,离子方程式是
乙组:认为甲组的实验不严谨,重新设计并进行实验,证实了甲组的结论是正确的。其实验方案是
(4)由上述实验可知,下列说法正确的是
a. 盐与碱反应时,盐和碱都必须可溶于水
b. 盐溶液可能呈中性、碱性、酸性
c. 盐与盐反应时,不一定生成两种新盐
d. 盐与盐反应时,发生的不一定是复分解反应
您最近一年使用:0次
【推荐2】(Ⅰ)二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下:
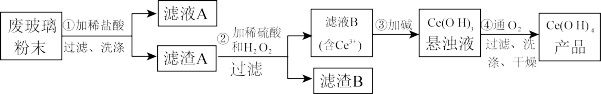
(1)洗涤的目的主要是为了除去Cl-和___________ (填离子符号),检验该滤渣A洗净的方法是___________ 。
(2)第②步反应的离子方程式是___________ 。
(3)取上述流程中得到的Ce(OH)4产品0.536 g,加硫酸溶解后,用0.1000mol· L-1FeSO4标准溶液滴定终点时(铈被还原为Ce3+),消耗25.00mL标准溶液,该产品中Ce(OH)4的质量分数为___________ 。
(Ⅱ)氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
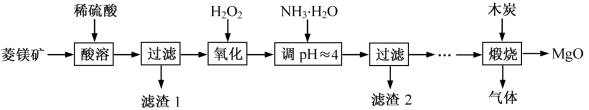
(4)加入H2O2氧化时,发生反应的化学方程式为___________ 。
(5)滤渣2的成分是___________ (填化学式)。
煅烧过程存在以下反应:2MgSO4+C=2MgO+2SO2↑+CO2↑
MgSO4+C=MgO+SO2↑+CO↑
MgSO4+3C=MgO+S↑+3CO↑
利用如图装置对煅烧产生的气体进行分步吸收或收集。
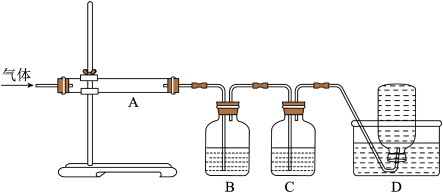
(6)①D中收集的气体可以是___________ (填化学式)。
②B中盛放的溶液可以是___________ (填字母)。
A.NaOH溶液 B.Ca(OH)2溶液 C.稀硝酸 D.KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:___________ 。
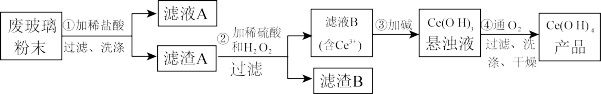
(1)洗涤的目的主要是为了除去Cl-和
(2)第②步反应的离子方程式是
(3)取上述流程中得到的Ce(OH)4产品0.536 g,加硫酸溶解后,用0.1000mol· L-1FeSO4标准溶液滴定终点时(铈被还原为Ce3+),消耗25.00mL标准溶液,该产品中Ce(OH)4的质量分数为
(Ⅱ)氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:

(4)加入H2O2氧化时,发生反应的化学方程式为
(5)滤渣2的成分是
煅烧过程存在以下反应:2MgSO4+C=2MgO+2SO2↑+CO2↑
MgSO4+C=MgO+SO2↑+CO↑
MgSO4+3C=MgO+S↑+3CO↑
利用如图装置对煅烧产生的气体进行分步吸收或收集。

(6)①D中收集的气体可以是
②B中盛放的溶液可以是
A.NaOH溶液 B.Ca(OH)2溶液 C.稀硝酸 D.KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
名校
解题方法
【推荐3】用化学方法降解水中有机物已成为污水处理领域的重要研究方向。
(1)酸性条件下,铁炭混合物处理污水中硝基苯时的物质转化示意图如图1所示。
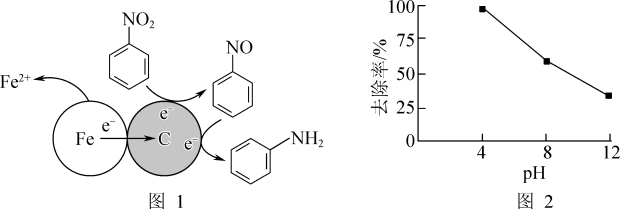
①该物质转化示意图可以描述为_______ 。
②其他条件一定,反应相同时间,硝基苯的去除率与pH的关系如图2所示。pH越大,硝基苯的去除率越低的原因是_______ 。
(2)向含Fe2+和苯胺(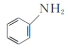 )的酸性溶液中加入双氧水,会发生如下反应:Fe2++H++H2O2=Fe3++HO·+H2O
)的酸性溶液中加入双氧水,会发生如下反应:Fe2++H++H2O2=Fe3++HO·+H2O
①HO·(羟基自由基)具有强氧化性,能将溶液中的苯胺氧化成CO2和N2。写出该反应的离子方程式:_______ 。
②H2O2也具有氧化性,设计验证苯胺是被HO·氧化而不是被H2O2氧化的实验方案:_______ 。
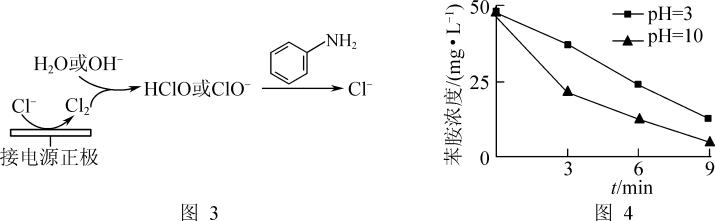
(3)利用电化学装置通过间接氧化法能氧化含苯胺的污水,其原理如图3所示。其他条件一定,测得不同初始pH条件下,溶液中苯胺的浓度与时间的关系如图4所示。反应相同时间,初始溶液pH=3时苯胺浓度大于pH=10时的原因是_______ 。[已知氧化性:HClO(H+)>ClO-(OH-)]
(1)酸性条件下,铁炭混合物处理污水中硝基苯时的物质转化示意图如图1所示。

①该物质转化示意图可以描述为
②其他条件一定,反应相同时间,硝基苯的去除率与pH的关系如图2所示。pH越大,硝基苯的去除率越低的原因是
(2)向含Fe2+和苯胺(
 )的酸性溶液中加入双氧水,会发生如下反应:Fe2++H++H2O2=Fe3++HO·+H2O
)的酸性溶液中加入双氧水,会发生如下反应:Fe2++H++H2O2=Fe3++HO·+H2O①HO·(羟基自由基)具有强氧化性,能将溶液中的苯胺氧化成CO2和N2。写出该反应的离子方程式:
②H2O2也具有氧化性,设计验证苯胺是被HO·氧化而不是被H2O2氧化的实验方案:
(3)利用电化学装置通过间接氧化法能氧化含苯胺的污水,其原理如图3所示。其他条件一定,测得不同初始pH条件下,溶液中苯胺的浓度与时间的关系如图4所示。反应相同时间,初始溶液pH=3时苯胺浓度大于pH=10时的原因是

您最近一年使用:0次
解答题-无机推断题
|
困难
(0.15)
名校
解题方法
【推荐1】X、Y、Z、M为短周期元素,原子序数依次增大。A~J均由该四种元素构成的单质或化合物,其转化关系如图所示,部分生成物省略。
已知:①A、B、C、G都是由两种元素构成的化合物,其中A、G分子所含的电子数为10e-,B、C分子所含的电子数为18e-;D为空气的主要成分之一、
②另取16.8gJ在真空条件下,控制温度350~400oC加热至完全分解,得到F和8.96L(已折算成标准状况)A两种物质。

请回答下列问题:
(1)写出C的化学式是___________ ;D的电子式是___________ 。
(2)请写出金属单质E在生产生活中的一种作用___________ 。
(3)写出次氯酸钠与过量气体A反应生成B的化学方程式是___________ ;B在制备过程中,气体A需要过量的理由是___________ 。
(4)写出F和G反应生成H和A的化学方程式是___________ 。
(5)B在加热条件下与CuO反应可生成气体D和金属单质,请设计实验方案,验证B与CuO反应后固体的成分(不考虑其他反应)___________ 。
(6)写出J在已知②条件下受热分解的化学方程式是___________ 。
已知:①A、B、C、G都是由两种元素构成的化合物,其中A、G分子所含的电子数为10e-,B、C分子所含的电子数为18e-;D为空气的主要成分之一、
②另取16.8gJ在真空条件下,控制温度350~400oC加热至完全分解,得到F和8.96L(已折算成标准状况)A两种物质。

请回答下列问题:
(1)写出C的化学式是
(2)请写出金属单质E在生产生活中的一种作用
(3)写出次氯酸钠与过量气体A反应生成B的化学方程式是
(4)写出F和G反应生成H和A的化学方程式是
(5)B在加热条件下与CuO反应可生成气体D和金属单质,请设计实验方案,验证B与CuO反应后固体的成分(不考虑其他反应)
(6)写出J在已知②条件下受热分解的化学方程式是
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
名校
【推荐2】化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可以减少该有害物质向环境排放。例如:
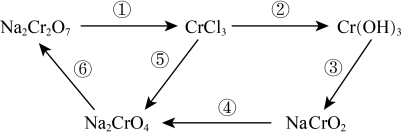
(1)Na2Cr2O7属于______ (填序号)。
①酸 ②碱 ③盐 ④氧化物
(2)在上述转化中,Cr元素化合价不变的步骤是_____ (填序号)。
(3)反应①为:Na2Cr2O7+HCl=NaCl+CrCl3+Cl2↑+H2O (未配平)。其中还原产物为_____ ,Na2Cr2O7与Cl2的反应系数比为_____ 。
(4)完成反应④的配平,并用单线桥 标出电子转移的方向和数目_____ 。(系数为1也请写出)
______ClO +______CrO
+______CrO +______
+______ =______Cl-+______CrO
=______Cl-+______CrO +______H2O
+______H2O

(1)Na2Cr2O7属于
①酸 ②碱 ③盐 ④氧化物
(2)在上述转化中,Cr元素化合价不变的步骤是
(3)反应①为:Na2Cr2O7+HCl=NaCl+CrCl3+Cl2↑+H2O (未配平)。其中还原产物为
(4)完成反应④的配平,并用
______ClO
 +______CrO
+______CrO +______
+______ =______Cl-+______CrO
=______Cl-+______CrO +______H2O
+______H2O
您最近一年使用:0次
解答题-工业流程题
|
困难
(0.15)
【推荐3】从含钴余液(含 、
、 、
、 、
、 等杂质)中提取氧化钴的流程如下:
等杂质)中提取氧化钴的流程如下:
(1)在去除钙、镁时,选择适当加热条件的理由是___________ ;该步骤控制pH是影响除钙镁效果的重要因素,下图是不同pH条件下硫化钴含量和钴收率图,根据图中信息选择最适宜的pH为___________ ;___________ ;
(3)已知P507萃取剂 和
和 发生如下反应:
发生如下反应:
萃取时适当增加溶液的pH,能增大 的萃取率,原因是
的萃取率,原因是___________ ;
(4)反萃取时加入的试剂a应为___________(填代号);
(5)沉钴的离子方程式为___________ ;
(6)系列操作中如何检验 是否洗涤干净
是否洗涤干净___________ ;
(7)空气中煅烧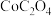 生成钴的某种氧化物和
生成钴的某种氧化物和 ,测得充分煅烧后剩余固体质量为24.1 g,同时获得标准状况下
,测得充分煅烧后剩余固体质量为24.1 g,同时获得标准状况下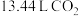 ,则钴的氧化物的化学式为
,则钴的氧化物的化学式为___________ 。
 、
、 、
、 、
、 等杂质)中提取氧化钴的流程如下:
等杂质)中提取氧化钴的流程如下: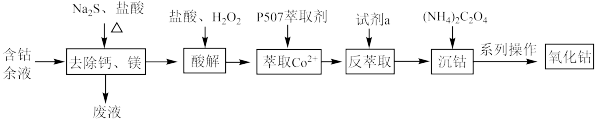
(1)在去除钙、镁时,选择适当加热条件的理由是

(3)已知P507萃取剂
 和
和 发生如下反应:
发生如下反应:
萃取时适当增加溶液的pH,能增大
 的萃取率,原因是
的萃取率,原因是(4)反萃取时加入的试剂a应为___________(填代号);
A. | B.HCl | C.NaOH | D. |
(5)沉钴的离子方程式为
(6)系列操作中如何检验
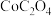 是否洗涤干净
是否洗涤干净(7)空气中煅烧
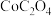 生成钴的某种氧化物和
生成钴的某种氧化物和 ,测得充分煅烧后剩余固体质量为24.1 g,同时获得标准状况下
,测得充分煅烧后剩余固体质量为24.1 g,同时获得标准状况下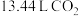 ,则钴的氧化物的化学式为
,则钴的氧化物的化学式为
您最近一年使用:0次
【推荐1】一种白色结晶状粉末化合物X由4种短周期元素构成,为探究其性质。完成了以下实验;

回答下列问题:
(1)X的组成元素是____________ ,X的化学式是____________ 。
(2)溶液Y在酸性条件下能使淀粉、KI溶液变蓝色,写出离子方程式:__________________ 。
(3)固体X的水溶液能使酸性高锰酸钾溶液褪色,写出化学方程式:__________________ 。
(4)请设计一个实验方案检验红棕色混合气体的组成。_______________ 。

回答下列问题:
(1)X的组成元素是
(2)溶液Y在酸性条件下能使淀粉、KI溶液变蓝色,写出离子方程式:
(3)固体X的水溶液能使酸性高锰酸钾溶液褪色,写出化学方程式:
(4)请设计一个实验方案检验红棕色混合气体的组成。
您最近一年使用:0次
解答题-工业流程题
|
困难
(0.15)
解题方法
【推荐2】(一)下图是氮循环示意图,请回答下列问题。
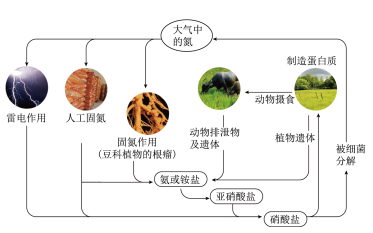
(1)①自然界中的固氮和人工固氮的共同点是将氮元素由游离态转化为__________ 。
②雷电固氮反应的化学方程式是__________ ,其中氮元素被__________ (填“氧化”或“还原”)。
③根据循环图判断下列说法不正确的是__________ 。
a.氮元素均被氧化
b.工业合成氨属于人工固氮
c.含氮无机物和含氮有机物可相互转化
d.碳、氢、氧三种元素也参与了氮循环
(二)现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:
低温
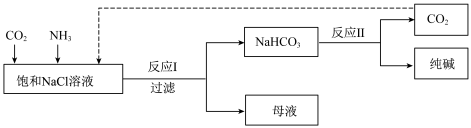
已知反应I为:NaCl+CO2+NH3+H2O NaHCO3↓+NH4Cl
NaHCO3↓+NH4Cl
(2)工业生产中,制备NH3的化学方程式是___________ .
(3)海水中含有大量的NaCl,以及少量的Ca2+、Mg2+、SO 等离子.
等离子.
①为得到纯净的饱和NaCl溶液,进行了如下操作.请补全操作步骤:
a.向浓缩后的海水中加入过量的氢氧化钠溶液后,过滤;
b.向滤液中___________ ,过滤;
c.向滤液中___________ ,过滤;
d.向滤液中加入足量的稀盐酸;
e.加热煮沸一段时间,得到饱和NaCl溶液.
②步骤c中反应的离子方程式是___________ .
(4)碳酸氢钠加热生成碳酸钠、水和二氧化碳,化学方程式是___________ .
(5)制得的纯碱中含有少量NaCl.取5.5g纯碱样品加入足量稀硫酸,得到标准状况下1120mL CO2.则样品中纯碱的质量分数是___________ %(保留1位小数).

(1)①自然界中的固氮和人工固氮的共同点是将氮元素由游离态转化为
②雷电固氮反应的化学方程式是
③根据循环图判断下列说法不正确的是
a.氮元素均被氧化
b.工业合成氨属于人工固氮
c.含氮无机物和含氮有机物可相互转化
d.碳、氢、氧三种元素也参与了氮循环
(二)现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:
低温

已知反应I为:NaCl+CO2+NH3+H2O
 NaHCO3↓+NH4Cl
NaHCO3↓+NH4Cl(2)工业生产中,制备NH3的化学方程式是
(3)海水中含有大量的NaCl,以及少量的Ca2+、Mg2+、SO
 等离子.
等离子.①为得到纯净的饱和NaCl溶液,进行了如下操作.请补全操作步骤:
a.向浓缩后的海水中加入过量的氢氧化钠溶液后,过滤;
b.向滤液中
c.向滤液中
d.向滤液中加入足量的稀盐酸;
e.加热煮沸一段时间,得到饱和NaCl溶液.
②步骤c中反应的离子方程式是
(4)碳酸氢钠加热生成碳酸钠、水和二氧化碳,化学方程式是
(5)制得的纯碱中含有少量NaCl.取5.5g纯碱样品加入足量稀硫酸,得到标准状况下1120mL CO2.则样品中纯碱的质量分数是
您最近一年使用:0次
解答题-实验探究题
|
困难
(0.15)
名校
解题方法
【推荐1】实验室常用NaOH溶液吸收NO2尾气,探究其适宜条件原理。20℃时,将4mL不同浓度NaOH溶液一次性推入中40mLNO2,观察现象。
(1)NaOH溶液吸收NO2时生成两种钠盐,分别为NaNO2和_____ 。
(2)检验甲中剩余气体的方法:排出大注射器中的溶液,拔下导管,吸入少量空气,气体变为红棕色。用化学方程式表示检验的反应原理是_____ 。
(3)某同学推测甲中产生无色气体的原因:局部OH-浓度过低,导致部分NO2与水反应。通过实验证明其成立:用与甲相同的装置、试剂和条件,将NO2缓慢推入NaOH溶液中,_____ (补全实验现象)。
(4)进一步探究NO2与水或碱反应时还原产物价态不同的原理。
【查阅资料】
i.NO2遇水时发生反应:a.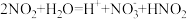
b.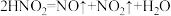 ;
;
ii.酸性条件下,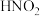 或
或 可与对氨基苯磺酸发生
可与对氨基苯磺酸发生不可逆 反应,所得产物遇萘乙二胺变红,且原溶液中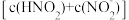 越大,红色越深。
越大,红色越深。
【实验】将2mLNO2推入5mL下列试剂中,随即取出0.1mL溶液,滴加到等量对氨基苯磺酸溶液(盐酸酸化)中,再加入等量萘乙二胺溶液,加水定容到相同体积,对比溶液颜色。
①通过实验_____ (填编号)对比,说明NO2遇水时发生了反应a和b。
②从化学反应速率的角度分析,NO2与水或碱反应时还原产物价态不同的原因是_____ 。
(5)若用0℃的NaOH溶液重复实验甲,最终剩余约3mL(20℃)无色气体。
综上,用NaOH溶液吸收NO2尾气,适宜的条件是______ (写出两点即可)。
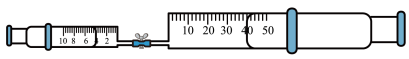
| 编号 | c(NaOH) | 现象 |
| 甲 | 2mol•L-1 | 活塞自动内移,最终剩余约7mL无色气体 |
| 乙 | 6mol•L-1 | 活塞自动内移,最终气体全部被吸收 |
(2)检验甲中剩余气体的方法:排出大注射器中的溶液,拔下导管,吸入少量空气,气体变为红棕色。用化学方程式表示检验的反应原理是
(3)某同学推测甲中产生无色气体的原因:局部OH-浓度过低,导致部分NO2与水反应。通过实验证明其成立:用与甲相同的装置、试剂和条件,将NO2缓慢推入NaOH溶液中,
(4)进一步探究NO2与水或碱反应时还原产物价态不同的原理。
【查阅资料】
i.NO2遇水时发生反应:a.
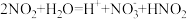
b.
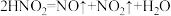 ;
;ii.酸性条件下,
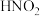 或
或 可与对氨基苯磺酸发生
可与对氨基苯磺酸发生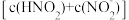 越大,红色越深。
越大,红色越深。【实验】将2mLNO2推入5mL下列试剂中,随即取出0.1mL溶液,滴加到等量对氨基苯磺酸溶液(盐酸酸化)中,再加入等量萘乙二胺溶液,加水定容到相同体积,对比溶液颜色。
| 编号 | 试剂 | 溶液颜色 |
| 丙 | 水 | 溶液均呈红色,丁与戊颜色几乎相同,丙的颜色更浅 |
| 丁 | 6mol•L-1NaOH溶液 | |
| 戊 | 酸性对氨基苯磺酸溶液 |
②从化学反应速率的角度分析,NO2与水或碱反应时还原产物价态不同的原因是
(5)若用0℃的NaOH溶液重复实验甲,最终剩余约3mL(20℃)无色气体。
综上,用NaOH溶液吸收NO2尾气,适宜的条件是
您最近一年使用:0次
解答题-工业流程题
|
困难
(0.15)
【推荐2】 可用于制取催化剂,可以由含钻废料(主要成分为
可用于制取催化剂,可以由含钻废料(主要成分为 ,还含有少量
,还含有少量 、
、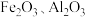 和
和 )经过如下过程进行制取:
)经过如下过程进行制取:
含钴废料
 浸取液
浸取液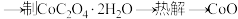
(1)含钴废料用硫酸和 溶液浸出后,溶液中含有的阳离子是
溶液浸出后,溶液中含有的阳离子是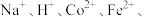
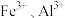 和
和 。
。
①写出“浸取”时 所发生反应的离子方程式:
所发生反应的离子方程式:________ 。
②“浸取”时含钴废料、硫酸和 溶液混合的方式为
溶液混合的方式为________ 。
(2)已知:①氧化性 ;
;
② ;
;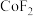 可溶于水;
可溶于水;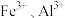 与
与 可生成配合物难以沉淀;
可生成配合物难以沉淀;
③实验条件下金属离子转化为氢氧化物时开始沉淀及沉淀完全的 如下表所示:
如下表所示:
补充完整由“浸取液”制取 的实验方案:取一定量的浸取液,
的实验方案:取一定量的浸取液,________ ,过滤,向滤液中滴加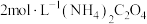 溶液,……,得到
溶液,……,得到 晶体,(实验中可选用的试剂是
晶体,(实验中可选用的试剂是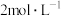 的氨水、
的氨水、 的
的 溶液、
溶液、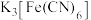 溶液、
溶液、 的
的 溶液)。
溶液)。
(3)已知: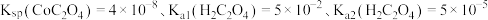 。
。
①反应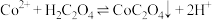 的平衡常数为
的平衡常数为________ 。
②制取 时使用
时使用 溶液而不是
溶液而不是 溶液的原因是
溶液的原因是________ 。
(4)为测定草酸钴样品的纯度,进行如下实验:
①取草酸钴样品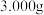 ,加入
,加入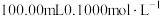 酸性
酸性 溶液,加热充分反应至不再有
溶液,加热充分反应至不再有 气体产生(该条件下
气体产生(该条件下 不被氧化,杂质不参与反应)。
不被氧化,杂质不参与反应)。
②将溶液冷却,加水稀释定容至 。
。
③取 溶液,用
溶液,用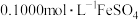 溶液滴定过量的
溶液滴定过量的 ,恰好完全反应时消耗
,恰好完全反应时消耗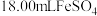 溶液。样品中
溶液。样品中 的质量分数为
的质量分数为____ 。
 可用于制取催化剂,可以由含钻废料(主要成分为
可用于制取催化剂,可以由含钻废料(主要成分为 ,还含有少量
,还含有少量 、
、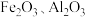 和
和 )经过如下过程进行制取:
)经过如下过程进行制取:含钴废料

 浸取液
浸取液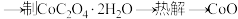
(1)含钴废料用硫酸和
 溶液浸出后,溶液中含有的阳离子是
溶液浸出后,溶液中含有的阳离子是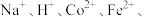
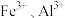 和
和 。
。①写出“浸取”时
 所发生反应的离子方程式:
所发生反应的离子方程式:②“浸取”时含钴废料、硫酸和
 溶液混合的方式为
溶液混合的方式为(2)已知:①氧化性
 ;
;②
 ;
;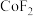 可溶于水;
可溶于水;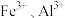 与
与 可生成配合物难以沉淀;
可生成配合物难以沉淀;③实验条件下金属离子转化为氢氧化物时开始沉淀及沉淀完全的
 如下表所示:
如下表所示:
|
|
|
|
| |
开始沉淀 | 1.9 | 3.4 | 6.9 | 6.6 | 9.1 |
沉淀完全 | 3.2 | 4.7 | 8.9 | 9.2 | 11.1 |
 的实验方案:取一定量的浸取液,
的实验方案:取一定量的浸取液,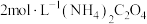 溶液,……,得到
溶液,……,得到 晶体,(实验中可选用的试剂是
晶体,(实验中可选用的试剂是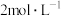 的氨水、
的氨水、 的
的 溶液、
溶液、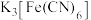 溶液、
溶液、 的
的 溶液)。
溶液)。(3)已知:
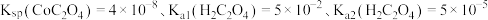 。
。①反应
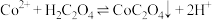 的平衡常数为
的平衡常数为②制取
 时使用
时使用 溶液而不是
溶液而不是 溶液的原因是
溶液的原因是(4)为测定草酸钴样品的纯度,进行如下实验:
①取草酸钴样品
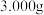 ,加入
,加入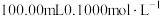 酸性
酸性 溶液,加热充分反应至不再有
溶液,加热充分反应至不再有 气体产生(该条件下
气体产生(该条件下 不被氧化,杂质不参与反应)。
不被氧化,杂质不参与反应)。②将溶液冷却,加水稀释定容至
 。
。③取
 溶液,用
溶液,用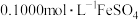 溶液滴定过量的
溶液滴定过量的 ,恰好完全反应时消耗
,恰好完全反应时消耗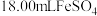 溶液。样品中
溶液。样品中 的质量分数为
的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
困难
(0.15)
解题方法
【推荐3】1,2-二氯乙烷( )是重要的有机化工原料,不溶于水,易溶于有机溶剂,沸点83.6℃;在光照下逐渐分解。实验室采用“乙烯液相直接氯化法”制备1,2-二氯乙烷,相关反应原理和实验装置如下:
)是重要的有机化工原料,不溶于水,易溶于有机溶剂,沸点83.6℃;在光照下逐渐分解。实验室采用“乙烯液相直接氯化法”制备1,2-二氯乙烷,相关反应原理和实验装置如下:

已知:①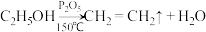
②

回答下列问题:
(1)仪器C的名称是________ ,装置甲中橡皮管的作用是________ 。
(2)装置甲中发生反应的离子方程式为________ 。
(3)制取1,2-二氯乙烷的装置接口顺序为(箭头为气流方向,部分装置可重复使用):________ 。
a→________→________→________→________→h-i←b←c←f←g←j
(4)装置丁中水的作用是________ 。
(5)相比酒精灯加热,己中采用甘油浴加热的优点是________ 。
(6)相比浓硫酸,用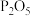 脱水制乙烯的优点是
脱水制乙烯的优点是________ 。
(7)产品纯度的测定:量取5.5mL逐出 和乙烯后的产品,产品密度为1.2g/mL,加足量稀NaOH溶液,加热充分反应:
和乙烯后的产品,产品密度为1.2g/mL,加足量稀NaOH溶液,加热充分反应: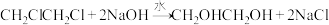 所得溶液先用稀硝酸中和至酸性,然后加入
所得溶液先用稀硝酸中和至酸性,然后加入 的
的 标准溶液至不再产生沉淀,沉降后过滤、洗涤、低温干燥、称量,得到14.35g白色固体,则产品中1,2-二氯乙烷的质量分数为
标准溶液至不再产生沉淀,沉降后过滤、洗涤、低温干燥、称量,得到14.35g白色固体,则产品中1,2-二氯乙烷的质量分数为________ 。
 )是重要的有机化工原料,不溶于水,易溶于有机溶剂,沸点83.6℃;在光照下逐渐分解。实验室采用“乙烯液相直接氯化法”制备1,2-二氯乙烷,相关反应原理和实验装置如下:
)是重要的有机化工原料,不溶于水,易溶于有机溶剂,沸点83.6℃;在光照下逐渐分解。实验室采用“乙烯液相直接氯化法”制备1,2-二氯乙烷,相关反应原理和实验装置如下:
已知:①
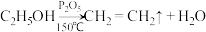
②


回答下列问题:
(1)仪器C的名称是
(2)装置甲中发生反应的离子方程式为
(3)制取1,2-二氯乙烷的装置接口顺序为(箭头为气流方向,部分装置可重复使用):
a→________→________→________→________→h-i←b←c←f←g←j
(4)装置丁中水的作用是
(5)相比酒精灯加热,己中采用甘油浴加热的优点是
(6)相比浓硫酸,用
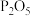 脱水制乙烯的优点是
脱水制乙烯的优点是(7)产品纯度的测定:量取5.5mL逐出
 和乙烯后的产品,产品密度为1.2g/mL,加足量稀NaOH溶液,加热充分反应:
和乙烯后的产品,产品密度为1.2g/mL,加足量稀NaOH溶液,加热充分反应: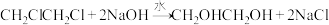 所得溶液先用稀硝酸中和至酸性,然后加入
所得溶液先用稀硝酸中和至酸性,然后加入 的
的 标准溶液至不再产生沉淀,沉降后过滤、洗涤、低温干燥、称量,得到14.35g白色固体,则产品中1,2-二氯乙烷的质量分数为
标准溶液至不再产生沉淀,沉降后过滤、洗涤、低温干燥、称量,得到14.35g白色固体,则产品中1,2-二氯乙烷的质量分数为
您最近一年使用:0次

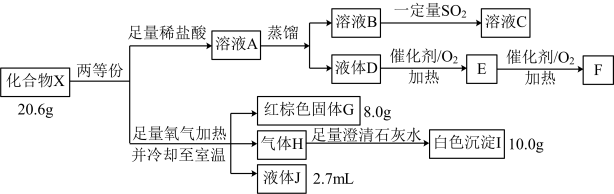
 的化学方程式
的化学方程式




