铁及其化合物在生活、生产中有着重要作用。请按要求回答下列问题。
(1)基态Fe原子的简化电子排布式为____ 。
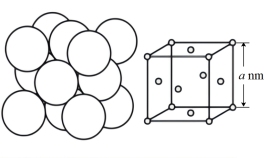
(2)因生产金属铁的工艺和温度等因素不同,产生的铁单质的晶体结构、密度和性质均不同。
①用____ 实验测定铁晶体,测得A、B两种晶胞,其晶胞结构如图:
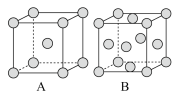
②A、B两种晶胞中含有的铁原子个数比为____ 。
③在A晶胞中,每个铁原子周围与它最近且相等距离的铁原子有____ 个。
(3)常温下,铁不易和水反应,而当撕开暖贴(内有透气的无纺布袋,袋内装有铁粉、活性炭、无机盐、水、吸水性树脂等)的密封外包装时,即可快速均匀发热。利用所学知识解释暖贴发热的原因:___ 。
(4)工业盐酸因含有[FeCl4]—而呈亮黄色,在高浓度Cl—的条件下[FeCl4]—才是稳定存在的。
①[FeCl4]—的中心离子是____ ,配体是____ ;其中的化学键称为____ 。
②取4mL工业盐酸于试管中,逐滴滴加AgNO3饱和溶液,至过量,预计观察到的现象有____ ,由此可知在高浓度Cl—的条件下[FeCl4]—才是稳定存在的。
(1)基态Fe原子的简化电子排布式为
(2)因生产金属铁的工艺和温度等因素不同,产生的铁单质的晶体结构、密度和性质均不同。
①用

②A、B两种晶胞中含有的铁原子个数比为
③在A晶胞中,每个铁原子周围与它最近且相等距离的铁原子有
(3)常温下,铁不易和水反应,而当撕开暖贴(内有透气的无纺布袋,袋内装有铁粉、活性炭、无机盐、水、吸水性树脂等)的密封外包装时,即可快速均匀发热。利用所学知识解释暖贴发热的原因:
(4)工业盐酸因含有[FeCl4]—而呈亮黄色,在高浓度Cl—的条件下[FeCl4]—才是稳定存在的。
①[FeCl4]—的中心离子是
②取4mL工业盐酸于试管中,逐滴滴加AgNO3饱和溶液,至过量,预计观察到的现象有
2022·天津河西·三模 查看更多[3]
更新时间:2022-06-01 15:26:18
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐1】Ⅰ.(1)研究钢铁的防腐蚀措施意义重大。利用如图所示装置可以模拟铁的电化学防护,其中Y为NaCl。
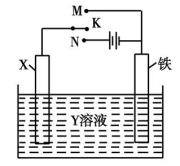
为减缓铁的腐蚀:
①若X为碳棒,开关K应置于____ (填字母)处,此时X极发生的电极反应式为__________________ 。
②若X为锌,开关K置于M处,则此时铁极发生的电极反应式为__________________ 。
(2)在城市中地下常埋有纵横交错的管道和输电线路,地上还铺有铁轨,当有电流泄漏入潮湿的土壤中,并与金属管道形成回路时,就会引起后者的腐蚀。为表示其原理,某班级的学生绘制了下列装置图(假设电极材料均为铁,电解质溶液均为NaCl溶液)。
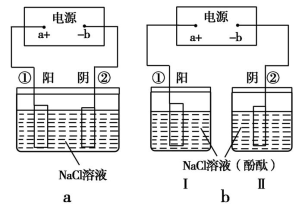

你认为其中能合理模拟金属管道的腐蚀原理的是______ ;c(Ⅱ)的总反应方程式是_______ ;若图d 中接通电源,则平放的铁丝左侧附近产生的现象是________ ;请你为防止地下金属管道腐蚀提供一种策略_______________ 。
Ⅱ.1 L某溶液中含有的离子如下表:
用惰性电极电解该溶液。当电路中有5 mol 电子通过时,溶液的pH=____ (忽略电解时溶液体积的变化及电极产物可能存在的溶解现象)。

为减缓铁的腐蚀:
①若X为碳棒,开关K应置于
②若X为锌,开关K置于M处,则此时铁极发生的电极反应式为
(2)在城市中地下常埋有纵横交错的管道和输电线路,地上还铺有铁轨,当有电流泄漏入潮湿的土壤中,并与金属管道形成回路时,就会引起后者的腐蚀。为表示其原理,某班级的学生绘制了下列装置图(假设电极材料均为铁,电解质溶液均为NaCl溶液)。


你认为其中能合理模拟金属管道的腐蚀原理的是
Ⅱ.1 L某溶液中含有的离子如下表:
| 离子 | Cu2+ | Al3+ |  | Cl- |
| 物质的量浓度/(mol/L) | 2 | 1 | 4 | x |
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐2】以NaCl为主要成分的融雪剂会腐蚀桥梁、铁轨等钢铁设备。某研究小组探究NaCl溶液对钢铁腐蚀的影响。
(1)将滤纸用3.5%的NaCl溶液润湿,涂上铁粉、碳粉的混合物,贴在表面皿上。在滤纸上加几滴检验试剂,再缓慢加入NaCl溶液至没过滤纸,操作如下所示:

①实验ⅰ的现象说明,得电子的物质是_______________________________ 。
②碳粉的作用是___________________________________________________ 。
③为了说明NaCl的作用,需要补充的对照实验是_____________________ 。
(2)向如图示装置的烧杯a、b中各加入30mL 3.5%的NaCl溶液,闭合K,指针未发生偏转。加热烧杯a,指针向右偏转。

①取a、b中溶液少量,滴加K3[Fe(CN)6]溶液,a中出现蓝色沉淀,b中无变化,b中铁片作________ 极。
②加热后,指针发生偏转的原因可能是_____________________ 。
(3)用(2)中图示装置探究不同浓度NaCl溶液对钢铁腐蚀的影响,向烧杯a、b中各加入30mL不同质量分数的NaCl溶液,实验记录如下表所示。
①Ⅱ中,b中电极发生的电极反应式是_______________________________ 。
②Ⅲ中,铁在饱和NaCl溶液中不易被腐蚀。查阅资料可知:在饱和NaCl溶液中O2浓度较低,钢铁不易被腐蚀。设计实验证明:_______________________________ 。
(4)根据上述实验,对钢铁腐蚀有影响的因素是_______________________________ 。
(1)将滤纸用3.5%的NaCl溶液润湿,涂上铁粉、碳粉的混合物,贴在表面皿上。在滤纸上加几滴检验试剂,再缓慢加入NaCl溶液至没过滤纸,操作如下所示:

①实验ⅰ的现象说明,得电子的物质是
②碳粉的作用是
③为了说明NaCl的作用,需要补充的对照实验是
(2)向如图示装置的烧杯a、b中各加入30mL 3.5%的NaCl溶液,闭合K,指针未发生偏转。加热烧杯a,指针向右偏转。

①取a、b中溶液少量,滴加K3[Fe(CN)6]溶液,a中出现蓝色沉淀,b中无变化,b中铁片作
②加热后,指针发生偏转的原因可能是
(3)用(2)中图示装置探究不同浓度NaCl溶液对钢铁腐蚀的影响,向烧杯a、b中各加入30mL不同质量分数的NaCl溶液,实验记录如下表所示。
| 实验 | a | b | 指针偏转方向 |
| I | 0.1% | 0.01% | 向右 |
| Ⅱ | 0.1% | 3.5% | 向左 |
| Ⅲ | 3.5% | 饱和溶液 | 向右 |
②Ⅲ中,铁在饱和NaCl溶液中不易被腐蚀。查阅资料可知:在饱和NaCl溶液中O2浓度较低,钢铁不易被腐蚀。设计实验证明:
(4)根据上述实验,对钢铁腐蚀有影响的因素是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】锡及其化合物在生产、生活中有着重要的用途。已知:Sn的熔点为231℃;Sn2+易水解、易被氧化;SnCl4极易水解、熔点为-33℃、沸点为114℃。
2H++SnO22- Sn(OH)2
Sn(OH)2 Sn2++2OH-
Sn2++2OH-
请按要求回答下列相关问题:
(1)元素锡比同主族碳的周期数大3,锡的原子序数为_______ 。
(2)用于微电子器件生产的锡粉纯度测定:
① 取1.19g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;
② 加入过量的Fe2(SO4)3;③ 用0.1000 mol/LK2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00 mL。
步骤② 中加入Fe2(SO4)3的作用是_______ ;此锡粉样品中锡的质量分数________ 。
(3)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如图所示:
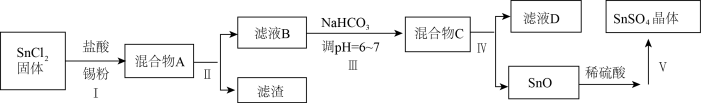
① 步骤I加入Sn粉的作用:___________ 及调节溶液pH。
② 步骤Ⅲ生成SnO的离子方程式:____________________ 。
③ 以锡单质为阳极,铁片为阴极,SnSO4溶液为电解质溶液,在铁片上镀锡,阴极反应式是____________ ,镀锡铁破损后在潮湿的环境中容易发生腐蚀的原因是_________ ,若是在较弱的酸性环境中发生腐蚀,正极反应式是____________ 。
(4)SnCl4蒸气遇水汽呈浓烟状,因而叮制作烟幕弹, 其反应的化学方程式为___________ 。
(5)锡的+2价化合物应具有较强的还原性,已知Sn2+的还原性比 Fe2+的还原性强,PbO2的氧化性比Cl2的氧化性强。试写出下列反应的化学方程式:
① 将SnCl4溶液蒸干灼烧得到的固体物质是________ ;
② 若用SnCl2溶液与过量的碱溶液反应制Sn(OH)2,该碱溶液可选用________ 。
2H++SnO22-
 Sn(OH)2
Sn(OH)2 Sn2++2OH-
Sn2++2OH-请按要求回答下列相关问题:
(1)元素锡比同主族碳的周期数大3,锡的原子序数为
(2)用于微电子器件生产的锡粉纯度测定:
① 取1.19g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;
② 加入过量的Fe2(SO4)3;③ 用0.1000 mol/LK2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00 mL。
步骤② 中加入Fe2(SO4)3的作用是
(3)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如图所示:

① 步骤I加入Sn粉的作用:
② 步骤Ⅲ生成SnO的离子方程式:
③ 以锡单质为阳极,铁片为阴极,SnSO4溶液为电解质溶液,在铁片上镀锡,阴极反应式是
(4)SnCl4蒸气遇水汽呈浓烟状,因而叮制作烟幕弹, 其反应的化学方程式为
(5)锡的+2价化合物应具有较强的还原性,已知Sn2+的还原性比 Fe2+的还原性强,PbO2的氧化性比Cl2的氧化性强。试写出下列反应的化学方程式:
① 将SnCl4溶液蒸干灼烧得到的固体物质是
② 若用SnCl2溶液与过量的碱溶液反应制Sn(OH)2,该碱溶液可选用
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐1】锂电池由于能量密度大逐渐取代锌电池。常用锂电池的正极材料为磷酸亚铁锂(LiFe-PO4),可采用FeCl3、NH4H2PO4、LiCl和苯胺等原料制备。回答下列问题:
(1)Fe基态原子核外电子排布式为___ 。
(2)已知Li2O是离子晶体,其晶格能的Born-Haber循环如图所示。

如图可知,Li原子的第一电离能为___ kJ·mol-1,O=O键键能为___ kJ·mol-1,Li2O晶格能为__ kJ·moL-1。
(3)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为___ ,其中Fe的配位数为___ 。
(4)NH4H2PO4中,P的杂化轨道类型为___ 。
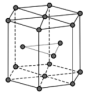
(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为___ 。六棱柱底边边长为a cm,高为ccm,阿伏加 德罗常数的值为NA,Zn的密度为___ g·cm-3(列出计算式即可)。
(1)Fe基态原子核外电子排布式为
(2)已知Li2O是离子晶体,其晶格能的Born-Haber循环如图所示。

如图可知,Li原子的第一电离能为
(3)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为
(4)NH4H2PO4中,P的杂化轨道类型为
(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】上海有机化学研究所施世良课题组以Ni(cod)2为催化剂实现了叔醇的手性合成。
(1)Ni在元素周期表中的位置是___________ ,写出其基态原子的价电子排布式:___________ 。
(2)Ni(cod)2是指双-(1,5-环辛二烯)镍,其结构如图所示。
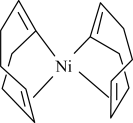
①与碳元素同周期且电负性大于碳的元素有___________ 种。
②Ni(cod)2分子内存在的作用力有___________ (填序号)。
a.配位键 b.金属键 c.极性键 d.非极性键 e.氢键
③Ni(cod)2分子中碳原子的杂化方式为___________ 。
(3)葡萄糖( )分子中,手性碳原子个数为
)分子中,手性碳原子个数为___________ 。
(4)红银矿NiAs晶体结构如图所示:
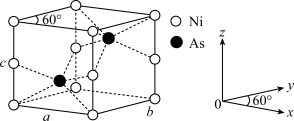
①As原子的配位数为___________ 。
②两个As原子的原子分数坐标依次为( ,
, ,
, )和
)和___________ 。
③已知晶体密度为ρ g·cm-3,X射线光谱测算出的晶胞参数为a=b=m pm、c=n pm,则阿伏加德罗常数NA可表示为___________ mol-1(用含m、n和p的代数式表示)。
(1)Ni在元素周期表中的位置是
(2)Ni(cod)2是指双-(1,5-环辛二烯)镍,其结构如图所示。

①与碳元素同周期且电负性大于碳的元素有
②Ni(cod)2分子内存在的作用力有
a.配位键 b.金属键 c.极性键 d.非极性键 e.氢键
③Ni(cod)2分子中碳原子的杂化方式为
(3)葡萄糖(
 )分子中,手性碳原子个数为
)分子中,手性碳原子个数为(4)红银矿NiAs晶体结构如图所示:

①As原子的配位数为
②两个As原子的原子分数坐标依次为(
 ,
, ,
, )和
)和③已知晶体密度为ρ g·cm-3,X射线光谱测算出的晶胞参数为a=b=m pm、c=n pm,则阿伏加德罗常数NA可表示为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】第四、五周期过渡元素单质及其化合物在生活、生产中有广泛应用。回答下列问题:
(1)Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co3+的配位数是___________ ,配位体NH3的空间构型为___________ 。
(2)NiO的晶体结构如图所示,其中离子坐标参数A为(0,0,0),B为(1,1,0),则C原子的坐标参数为___________ 。

(3)钴盐与NO 形成的配离子[Co(NO2)6]3-可用于检验K+的存在。K3[Co(NO2)6]中存在的作用力有
形成的配离子[Co(NO2)6]3-可用于检验K+的存在。K3[Co(NO2)6]中存在的作用力有___________ (填标号)。
a.σ键b.π键c.离子键d.范德华力e.配位键
(4)已知Zn2+等过渡元素离子形成的水合离子的颜色如下表所示。
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因:___________ 。
(5)①从磷钇矿中可提取稀土元素钇(Y),某磷钇矿的晶胞如图所示,该磷钇矿的化学式为___________ 。
②已知晶胞参数为anm和cnm,阿伏加德罗常数的值为NA,则该磷钇矿的ρ为___________ g·cm-3(列出计算式,用含a、c的代数式表示)。

(1)Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co3+的配位数是
(2)NiO的晶体结构如图所示,其中离子坐标参数A为(0,0,0),B为(1,1,0),则C原子的坐标参数为

(3)钴盐与NO
 形成的配离子[Co(NO2)6]3-可用于检验K+的存在。K3[Co(NO2)6]中存在的作用力有
形成的配离子[Co(NO2)6]3-可用于检验K+的存在。K3[Co(NO2)6]中存在的作用力有a.σ键b.π键c.离子键d.范德华力e.配位键
(4)已知Zn2+等过渡元素离子形成的水合离子的颜色如下表所示。
| 离子 | Sc3+ | Cr3+ | Fe2+ | Zn2+ |
| 水合离子的颜色 | 无色 | 绿色 | 浅绿色 | 无色 |
(5)①从磷钇矿中可提取稀土元素钇(Y),某磷钇矿的晶胞如图所示,该磷钇矿的化学式为
②已知晶胞参数为anm和cnm,阿伏加德罗常数的值为NA,则该磷钇矿的ρ为

您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐1】硫酸四氨合铜晶体( )常用作杀虫剂、媒染剂。已知:常温下
)常用作杀虫剂、媒染剂。已知:常温下 受热易分解,在空气中会水解生成铜的碱式盐;在溶液中存在以下电离过程:
受热易分解,在空气中会水解生成铜的碱式盐;在溶液中存在以下电离过程: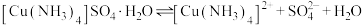 。现以废铜屑(表面沾有油污)为原料制备
。现以废铜屑(表面沾有油污)为原料制备 的实验步骤如下:
的实验步骤如下: 的制备
的制备
(1)步骤①中采取“碱煮水洗”,“碱”是指一种钠盐,其化学式是_____ 。
(2)步骤②在常温下进行,需要加入的试剂有稀 和另一种液态试剂,发生的化学反应方程式为
和另一种液态试剂,发生的化学反应方程式为_____ 。
Ⅱ.晶体的制备
将上述制备的 溶液加入装置A中,滴加
溶液加入装置A中,滴加 氨水时,有浅蓝色沉淀
氨水时,有浅蓝色沉淀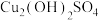 生成;继续滴加氨水,沉淀消失,得到深蓝色
生成;继续滴加氨水,沉淀消失,得到深蓝色 溶液。将A中溶液转移至B中,析出
溶液。将A中溶液转移至B中,析出 晶体;将B中混合物转移至装置C中抽滤(减压过滤),用乙醇洗涤晶体2~3次;取出晶体,冷风吹干。
晶体;将B中混合物转移至装置C中抽滤(减压过滤),用乙醇洗涤晶体2~3次;取出晶体,冷风吹干。_____ 。
(4)抽滤时,抽气泵处于工作状态,活塞需_____ (填“打开”或“关闭”),作用是_____ 。
(5)使用下列试剂可代替乙醇来促进 晶体析出的有
晶体析出的有_____ 。(填标号)
a. b.稀氨水 c.
b.稀氨水 c. d.
d. 溶液
溶液
(6)晶体采用冷风吹干而不用加热烘干的原因是_____ 。
Ⅲ.废液回收
减压过滤后的废液中含有 、乙醇和氨水,向废液中加入硫酸,回收乙醇并获得
、乙醇和氨水,向废液中加入硫酸,回收乙醇并获得 和的混合溶液。
和的混合溶液。
(7) 溶液受热易分解,则回收乙醇的实验方法为
溶液受热易分解,则回收乙醇的实验方法为_____ 。
 )常用作杀虫剂、媒染剂。已知:常温下
)常用作杀虫剂、媒染剂。已知:常温下 受热易分解,在空气中会水解生成铜的碱式盐;在溶液中存在以下电离过程:
受热易分解,在空气中会水解生成铜的碱式盐;在溶液中存在以下电离过程: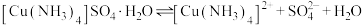 。现以废铜屑(表面沾有油污)为原料制备
。现以废铜屑(表面沾有油污)为原料制备 的实验步骤如下:
的实验步骤如下: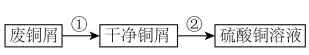
 的制备
的制备(1)步骤①中采取“碱煮水洗”,“碱”是指一种钠盐,其化学式是
(2)步骤②在常温下进行,需要加入的试剂有稀
 和另一种液态试剂,发生的化学反应方程式为
和另一种液态试剂,发生的化学反应方程式为Ⅱ.晶体的制备
将上述制备的
 溶液加入装置A中,滴加
溶液加入装置A中,滴加 氨水时,有浅蓝色沉淀
氨水时,有浅蓝色沉淀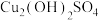 生成;继续滴加氨水,沉淀消失,得到深蓝色
生成;继续滴加氨水,沉淀消失,得到深蓝色 溶液。将A中溶液转移至B中,析出
溶液。将A中溶液转移至B中,析出 晶体;将B中混合物转移至装置C中抽滤(减压过滤),用乙醇洗涤晶体2~3次;取出晶体,冷风吹干。
晶体;将B中混合物转移至装置C中抽滤(减压过滤),用乙醇洗涤晶体2~3次;取出晶体,冷风吹干。
(4)抽滤时,抽气泵处于工作状态,活塞需
(5)使用下列试剂可代替乙醇来促进
 晶体析出的有
晶体析出的有a.
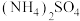 b.稀氨水 c.
b.稀氨水 c. d.
d. 溶液
溶液(6)晶体采用冷风吹干而不用加热烘干的原因是
Ⅲ.废液回收
减压过滤后的废液中含有
 、乙醇和氨水,向废液中加入硫酸,回收乙醇并获得
、乙醇和氨水,向废液中加入硫酸,回收乙醇并获得 和的混合溶液。
和的混合溶液。(7)
 溶液受热易分解,则回收乙醇的实验方法为
溶液受热易分解,则回收乙醇的实验方法为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐2】钴及其化合物在工业生产中有着广阔的应用前景。以 溶液为原料可制备三氯化六氮合钴(
溶液为原料可制备三氯化六氮合钴( 价)晶体等。
价)晶体等。
已知:① 不易被氧化,
不易被氧化, 具有强氧化性:
具有强氧化性: 具有较强还原性,
具有较强还原性, 性质稳定;
性质稳定;
制备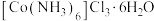 实验步骤如下:
实验步骤如下:
I.称取研细的 和
和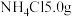 于烧杯中溶解,将溶液转入三颈烧瓶,加入
于烧杯中溶解,将溶液转入三颈烧瓶,加入 浓氨水和适量活性炭粉末,逐滴加入
浓氨水和适量活性炭粉末,逐滴加入 的
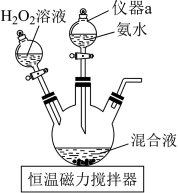
的 溶液。实验装置如图所示。
溶液。实验装置如图所示。
II.控制反应温度为 ,反应一段时间后,得
,反应一段时间后,得 溶液。
溶液。
III.在一定条件下,经过一系列的操作制得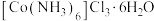 。
。
(1)仪器 的名称为
的名称为___________ 。
(2)将仪器 中的液体加入到三颈烧瓶中的操作是:
中的液体加入到三颈烧瓶中的操作是:___________ 。
(3)步骤I将 转化
转化 过程中,先加浓氨水再加
过程中,先加浓氨水再加 溶液目的是
溶液目的是___________ 。
(4)步骤II中控制反应温度为 的原因是
的原因是___________ 。
(5)步骤III制得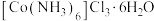 晶体的一系列的过程:加热浓缩、
晶体的一系列的过程:加热浓缩、___________ 、过滤、洗涤并干燥。
(6)晶体中, 离子中的
离子中的 的键角为
的键角为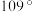 左右,而
左右,而 分子独立存在时
分子独立存在时 的键角为
的键角为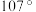 ,请解释配合物中
,请解释配合物中 的键角比
的键角比 分子大的原因
分子大的原因___________ 。
 溶液为原料可制备三氯化六氮合钴(
溶液为原料可制备三氯化六氮合钴( 价)晶体等。
价)晶体等。已知:①
 不易被氧化,
不易被氧化, 具有强氧化性:
具有强氧化性: 具有较强还原性,
具有较强还原性, 性质稳定;
性质稳定;制备
 实验步骤如下:
实验步骤如下:I.称取研细的
 和
和 于烧杯中溶解,将溶液转入三颈烧瓶,加入
于烧杯中溶解,将溶液转入三颈烧瓶,加入 浓氨水和适量活性炭粉末,逐滴加入
浓氨水和适量活性炭粉末,逐滴加入 的
的 溶液。实验装置如图所示。
溶液。实验装置如图所示。
II.控制反应温度为
 ,反应一段时间后,得
,反应一段时间后,得 溶液。
溶液。III.在一定条件下,经过一系列的操作制得
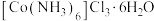 。
。(1)仪器
 的名称为
的名称为(2)将仪器
 中的液体加入到三颈烧瓶中的操作是:
中的液体加入到三颈烧瓶中的操作是:(3)步骤I将
 转化
转化 过程中,先加浓氨水再加
过程中,先加浓氨水再加 溶液目的是
溶液目的是(4)步骤II中控制反应温度为
 的原因是
的原因是(5)步骤III制得
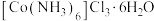 晶体的一系列的过程:加热浓缩、
晶体的一系列的过程:加热浓缩、(6)晶体中,
 离子中的
离子中的 的键角为
的键角为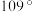 左右,而
左右,而 分子独立存在时
分子独立存在时 的键角为
的键角为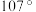 ,请解释配合物中
,请解释配合物中 的键角比
的键角比 分子大的原因
分子大的原因
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期。自然界存在多种A的化合物,B原子核外电子由6种不同的运动状态,B与C可形成正四面体形分子,D的M能层没有空轨道且只有2个未成对电子。请回答下列问题:
(1)A与B元素形成的B2A2种含有的σ键、π键数目之比为________ 。
(2)B元素的一种单质晶体结构如图1所示,理论上12g该晶体中有________ 个六元环;图2位在元素周期表中与B相邻的元素位置关系,B、G形成的晶胞结构如图3所示(其中“●”为B元素原子,“〇”为G元素原子),图中“●”点构成的堆积方式与图4中_____ (填序号)所表示的堆积方式相同;图3的结构中,设晶胞边长为a cm,B原子直径为bcm,G原子直径为c cm,则该晶胞的空间利用率为_______ (用含a、b、c的式子表示)。

(3)请说出E的氟化物(EF3)和F的氢化物(FH3)能发生反应的原因,并写出反应的化学方程式_____ (用化学式表示)。
(4)元素C的含氧酸中,酸性最强的是_________ (写化学式),该酸根离子的立体构型为________ 。
(5)基态D原子的核外电子排布式为[Ar]_______ ;D形成的配合物D(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=______ ;由D一铝合金为原料可制得一种历史悠久、应用广泛的催化剂,其催化的i实例为: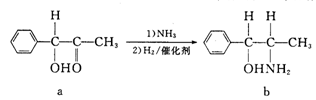 化合物b中进行sp3杂化的原子有
化合物b中进行sp3杂化的原子有__________ (填元素符号)。
(1)A与B元素形成的B2A2种含有的σ键、π键数目之比为
(2)B元素的一种单质晶体结构如图1所示,理论上12g该晶体中有

(3)请说出E的氟化物(EF3)和F的氢化物(FH3)能发生反应的原因,并写出反应的化学方程式
(4)元素C的含氧酸中,酸性最强的是
(5)基态D原子的核外电子排布式为[Ar]
 化合物b中进行sp3杂化的原子有
化合物b中进行sp3杂化的原子有
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】研究表明,新冠病毒在铜表面存活时间最短,仅为4小时,铜被称为细菌病毒的“杀手”;某些铜的合金具有很好的储氢功能。回答下列问题:
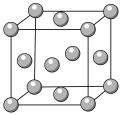
(1)铜的晶胞结构如图所示,铜原子的配位数为___________ ,基态铜原子的电子排布式为___________ 。
(2)白铜(铜镍合金)的立方晶胞结构如下图所示。
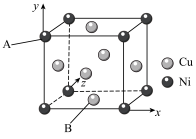
①基态镍原子的价层电子轨道表示式为___________ _
②若原子A的坐标参数为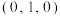 ,原子B的坐标参数为
,原子B的坐标参数为___________ 。
③若该晶体密度为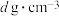 ,则铜镍原子间最短距离为
,则铜镍原子间最短距离为___________ cm。( 表示阿伏伽德罗常数)
表示阿伏伽德罗常数)
(1)铜的晶胞结构如图所示,铜原子的配位数为

(2)白铜(铜镍合金)的立方晶胞结构如下图所示。

①基态镍原子的价层电子轨道表示式为
②若原子A的坐标参数为
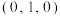 ,原子B的坐标参数为
,原子B的坐标参数为③若该晶体密度为
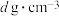 ,则铜镍原子间最短距离为
,则铜镍原子间最短距离为 表示阿伏伽德罗常数)
表示阿伏伽德罗常数)
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐2】金属铜在电力工业和科研领域中的应用广泛,科学家对于铜元素的研究不断深入。请回答下列问题:
(1)基态Cu原子的价电子排布式为_______ 。
(2)已知:高温下Cu2O比CuO稳定。从核外电子排布角度解释高温下Cu2O更稳定的原因为_______ 。
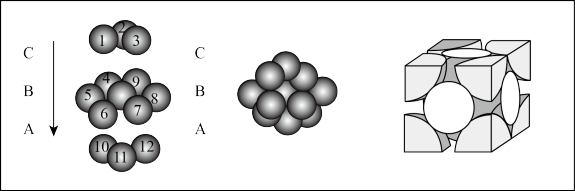
(3)铜晶体中铜原子的堆积方式如图所示,则晶体铜原子的堆积方式为_______ 。
(4)当黄铜受到氨腐蚀时,会生成四氨合铜络合物,出现“龟裂”现象。
①[Cu(NH3)4]2+中各元素电负性由大到小的顺序为_____ ,其中N原子的杂化轨道类型为_____ 。
②[Cu(NH3)4]2+中NH3的键角比独立存在的NH3分子结构中的键角_______ (填“大”或“小”)。
③1mol[Cu(NH3)4]2+中存在_______ 个σ键(用阿伏加德罗常数的数值用NA表示)。
(5)M原子的价电子排布式为3s23p5,铜与M形成化合物的晶胞如图所示(白球代表铜原子)。
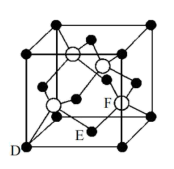
①该晶体的化学式为_______ 。
②已知该晶体的密度为ρg/cm3,阿伏加德罗常数的值为NA,则该晶体中Cu原子和M原子之间的最短距离为_______ pm(写出计算式)。
(1)基态Cu原子的价电子排布式为
(2)已知:高温下Cu2O比CuO稳定。从核外电子排布角度解释高温下Cu2O更稳定的原因为
(3)铜晶体中铜原子的堆积方式如图所示,则晶体铜原子的堆积方式为

(4)当黄铜受到氨腐蚀时,会生成四氨合铜络合物,出现“龟裂”现象。
①[Cu(NH3)4]2+中各元素电负性由大到小的顺序为
②[Cu(NH3)4]2+中NH3的键角比独立存在的NH3分子结构中的键角
③1mol[Cu(NH3)4]2+中存在
(5)M原子的价电子排布式为3s23p5,铜与M形成化合物的晶胞如图所示(白球代表铜原子)。

①该晶体的化学式为
②已知该晶体的密度为ρg/cm3,阿伏加德罗常数的值为NA,则该晶体中Cu原子和M原子之间的最短距离为
您最近一年使用:0次
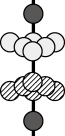
【推荐3】Co、Ni元素及其化合物有着很多优良的性能和特性,回答下列问题:
(1)基态Ni原子的价电子排布图为_______ ;金属镍的原子堆积方式如图所示,则金属镍的晶胞俯视图为_______ ( 填字母)。
a. b.
b.  c.
c.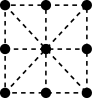 d.
d.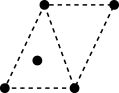
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液,[Ni(NH3)6]SO4晶体 中不存在的化学键类型包括_______ (填序号)。
A.极性共价键 B.离子键 C.配位键 D.金属键 E.非极性共价键 F.氢键
(3)Co3+通常易形成六配位的配合物,已知CoCl3·6H2O有多种结构,若取1molCoCl3·6H2O溶解于水后滴加足量的硝酸银溶液,能够形成2mol沉淀,则CoCl3·6H2O中配离子的结构示意图为(不考虑空间结构)_______ 。
(4)Co3O4晶体中O作面心立方最密堆积(如图),Co随机填充在晶胞中O构成的8个四面体空隙和4个八面体空隙中,则Co的配位数分别为_______ 、_______ ,Co总的空隙填充率为_______ ,如果晶胞边长为anm,Co3O4的摩尔质量为Mg/mol,NA为阿伏加德罗常数的值,则Co3O4的晶体密度为_______ g/cm3(列出计算式)。
(1)基态Ni原子的价电子排布图为

a.
 b.
b.  c.
c. d.
d.
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液,[Ni(NH3)6]SO4晶体 中不存在的化学键类型包括
A.极性共价键 B.离子键 C.配位键 D.金属键 E.非极性共价键 F.氢键
(3)Co3+通常易形成六配位的配合物,已知CoCl3·6H2O有多种结构,若取1molCoCl3·6H2O溶解于水后滴加足量的硝酸银溶液,能够形成2mol沉淀,则CoCl3·6H2O中配离子的结构示意图为(不考虑空间结构)
(4)Co3O4晶体中O作面心立方最密堆积(如图),Co随机填充在晶胞中O构成的8个四面体空隙和4个八面体空隙中,则Co的配位数分别为

您最近一年使用:0次



