某废钒渣(主要成分为 ,含有少量
,含有少量 、CaO)为原料生产
、CaO)为原料生产 的工艺流程如图:
的工艺流程如图:
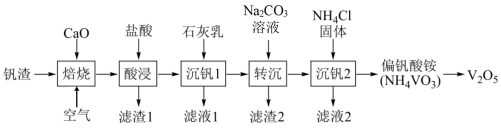
已知: 难溶于水,可溶于盐酸;
难溶于水,可溶于盐酸; 难溶于水;+5价钒在溶液中的主要存在形式与溶液pH的关系如下表。
难溶于水;+5价钒在溶液中的主要存在形式与溶液pH的关系如下表。
(1)①“酸浸”时与HCl反应的物质除了 、CaO外,还有
、CaO外,还有_______ 。
②“酸浸”后溶液pH约为4,加石灰乳后pH略大于12,则“沉钒1”时沉钒化学方程式为:_______ 。
(2)①“沉钒2”的沉钒率随温度的变化如图所示,温度高于80℃沉钒率下降的原因是_______ 。
②“沉钒2”得到偏钒酸铵( ),若“转沉”后过滤得滤液调节pH后体积为2L,
),若“转沉”后过滤得滤液调节pH后体积为2L,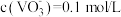 ,为使钒元素的沉降率达到98%,至少应加入
,为使钒元素的沉降率达到98%,至少应加入
_______ mol。(加入 前后溶液体积不变;
前后溶液体积不变;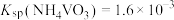 )
)

(3)400℃时,在空气中偏钒酸铵加热分解制备五氧化二钒,分解一段时间后,气体中先检测到 ,随后固体中检测到了
,随后固体中检测到了 杂质,不断搅拌充分反应后,最终无该杂质。该反应过程可描述为
杂质,不断搅拌充分反应后,最终无该杂质。该反应过程可描述为_______ 。
 ,含有少量
,含有少量 、CaO)为原料生产
、CaO)为原料生产 的工艺流程如图:
的工艺流程如图:
已知:
 难溶于水,可溶于盐酸;
难溶于水,可溶于盐酸; 难溶于水;+5价钒在溶液中的主要存在形式与溶液pH的关系如下表。
难溶于水;+5价钒在溶液中的主要存在形式与溶液pH的关系如下表。| pH | 4~6 | 6~8 | 8~10 | 10~12 |
| 主要离子 |  |  |  |  |
 、CaO外,还有
、CaO外,还有②“酸浸”后溶液pH约为4,加石灰乳后pH略大于12,则“沉钒1”时沉钒化学方程式为:
(2)①“沉钒2”的沉钒率随温度的变化如图所示,温度高于80℃沉钒率下降的原因是
②“沉钒2”得到偏钒酸铵(
 ),若“转沉”后过滤得滤液调节pH后体积为2L,
),若“转沉”后过滤得滤液调节pH后体积为2L,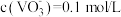 ,为使钒元素的沉降率达到98%,至少应加入
,为使钒元素的沉降率达到98%,至少应加入
 前后溶液体积不变;
前后溶液体积不变;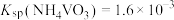 )
)
(3)400℃时,在空气中偏钒酸铵加热分解制备五氧化二钒,分解一段时间后,气体中先检测到
 ,随后固体中检测到了
,随后固体中检测到了 杂质,不断搅拌充分反应后,最终无该杂质。该反应过程可描述为
杂质,不断搅拌充分反应后,最终无该杂质。该反应过程可描述为
更新时间:2022-06-07 07:17:38
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
【推荐1】以铜钴矿[主要成分为 ,另含少量
,另含少量 及含砷化合物]制备锂电池正极原料
及含砷化合物]制备锂电池正极原料 ,生产流程如图甲所示。
,生产流程如图甲所示。 ;
;
②萃取除铜的过程可表示为 ;
;
③ 。
。
(1)一种钴的氧化物的晶胞结构如图乙所示,该氧化物中钴离子的价电子排布式为___________ ,该氧化物中钴离子的配位数是___________ 。 形式存在,生成
形式存在,生成 的化学方程式为
的化学方程式为___________ 。酸浸过程中可适当升温以加快反应速率,但温度过高,单位时间内钴的浸出率明显降低。原因是___________ 。
(3)实验室模拟萃取除铜,加入萃取剂后充分振荡静置,如图丙所示,则分离出含铜有机溶剂的具体实验操作为___________ 。 转化为
转化为 沉淀,该反应的离子方程式为
沉淀,该反应的离子方程式为___________ 。常温条件下,若除铁结束后溶液 ,则
,则 是否完全沉淀(离子浓度低于
是否完全沉淀(离子浓度低于 时,可认为该离子完全沉淀)?通过计算说明:
时,可认为该离子完全沉淀)?通过计算说明:___________ 。
 ,另含少量
,另含少量 及含砷化合物]制备锂电池正极原料
及含砷化合物]制备锂电池正极原料 ,生产流程如图甲所示。
,生产流程如图甲所示。
 ;
;②萃取除铜的过程可表示为
 ;
;③
 。
。(1)一种钴的氧化物的晶胞结构如图乙所示,该氧化物中钴离子的价电子排布式为
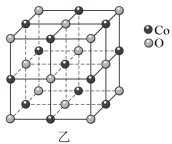
 形式存在,生成
形式存在,生成 的化学方程式为
的化学方程式为(3)实验室模拟萃取除铜,加入萃取剂后充分振荡静置,如图丙所示,则分离出含铜有机溶剂的具体实验操作为

 转化为
转化为 沉淀,该反应的离子方程式为
沉淀,该反应的离子方程式为 ,则
,则 是否完全沉淀(离子浓度低于
是否完全沉淀(离子浓度低于 时,可认为该离子完全沉淀)?通过计算说明:
时,可认为该离子完全沉淀)?通过计算说明:
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐2】磷酸锌常用作氯化橡胶合成高分子材料的阻燃剂。工业上利用烧渣灰(主要含ZnO,还含少量FeO、Al2O3、CuO及SiO2)为原料制取磷酸锌的工艺流程如图所示:
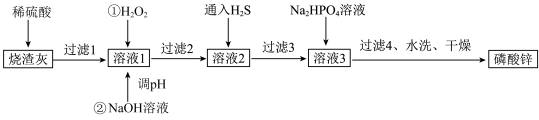
已知:①[Zn3(PO4)2]在水中几乎不溶,其在水中的溶解度随温度的升高而降低;
②“溶1”中几种金属离子开始沉淀与沉淀完全的pH如下表所示:
(1)写出通入H2S所发生的离子反应方程式___________
(2)用硫酸浸烧渣灰,为提高酸浸时锌的浸出率,可以采取的措施是___________ (填一条)。
(3)加入H2O2的作用___________ 。
(4)经过滤2得到滤渣的主要成分是Fe(OH)3和Al(OH)3,则用NaOH溶液调节pH的范围是___________ 。
(5)加入Na2HPO4溶液发生反应的离子方程式为___________ 。
(6)洗涤磷酸锌沉淀时应选用___________ (填“冷水”或“热水”)。
(7)通入H2S是为了除铜离子,25℃时,当通入H2S达到饱和时测得溶液的pH=1,c(H2S)=0.1mol·L-1,此时溶液中c(Cu2+)= 6.3×10-15mol·L-1,则CuS的溶度积Ksp=___________ (已知: 25℃时,H2S的电离平衡常数Ka1=1×10-7,Ka2=1×10-15)。

已知:①[Zn3(PO4)2]在水中几乎不溶,其在水中的溶解度随温度的升高而降低;
②“溶1”中几种金属离子开始沉淀与沉淀完全的pH如下表所示:
| 金属离子 | Al3+ | Fe3+ | Cu2+ | Zn2+ |
| 开始沉淀的pH | 3.0 | 2.2 | 5.4 | 6.5 |
| 沉淀完全的pH | 5.0 | 3.6 | 6.7 | 8.5 |
(2)用硫酸浸烧渣灰,为提高酸浸时锌的浸出率,可以采取的措施是
(3)加入H2O2的作用
(4)经过滤2得到滤渣的主要成分是Fe(OH)3和Al(OH)3,则用NaOH溶液调节pH的范围是
(5)加入Na2HPO4溶液发生反应的离子方程式为
(6)洗涤磷酸锌沉淀时应选用
(7)通入H2S是为了除铜离子,25℃时,当通入H2S达到饱和时测得溶液的pH=1,c(H2S)=0.1mol·L-1,此时溶液中c(Cu2+)= 6.3×10-15mol·L-1,则CuS的溶度积Ksp=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小。在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙,发生反应
Ⅰ: (aq) + Ca(OH)2(s)
(aq) + Ca(OH)2(s)  CaWO4(s) + 2OH-(aq)。
CaWO4(s) + 2OH-(aq)。
(1)下图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线。

①计算T1时KSP(CaWO4)=________ 。
②T1________ T2(填“>”“=”或“<”)。
(2)反应Ⅰ的平衡常数K理论值如下表:
①该反应平衡常数K的表达式为________ 。
②该反应的△H________ 0(填“>”“=”或“<”)。
③由于溶液中离子间的相互作用,实验测得的平衡常数与理论值相距甚远。50℃时,向一定体积的钨酸钠碱性溶液[c(Na2WO4) = c(NaOH)=0.5 mol·L-1]中,加入过量Ca(OH)2,反应达到平衡后 的沉淀率为60%,计算实验测得的平衡常数
的沉淀率为60%,计算实验测得的平衡常数______________ 。
(3)制取钨酸钙时,适时向反应混合液中添加适量盐酸,分析其作用:________ 。
Ⅰ:
 (aq) + Ca(OH)2(s)
(aq) + Ca(OH)2(s)  CaWO4(s) + 2OH-(aq)。
CaWO4(s) + 2OH-(aq)。(1)下图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线。

①计算T1时KSP(CaWO4)=
②T1
(2)反应Ⅰ的平衡常数K理论值如下表:
| 温度/℃ | 25 | 50 | 90 | 100 |
| K | 79.96 | 208.06 | 222.88 | 258.05 |
②该反应的△H
③由于溶液中离子间的相互作用,实验测得的平衡常数与理论值相距甚远。50℃时,向一定体积的钨酸钠碱性溶液[c(Na2WO4) = c(NaOH)=0.5 mol·L-1]中,加入过量Ca(OH)2,反应达到平衡后
 的沉淀率为60%,计算实验测得的平衡常数
的沉淀率为60%,计算实验测得的平衡常数(3)制取钨酸钙时,适时向反应混合液中添加适量盐酸,分析其作用:
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】工业上,从铜镍矿(主要成分为铜氧化物、镍氧化物,含有 、
、 、
、 等杂质)中提取镍和铜的一种工艺流程如下:
等杂质)中提取镍和铜的一种工艺流程如下:
②当溶液中某离子浓度c≤10-5mol/L时,可认为该离子沉淀完全。
③
(1)基态 原子的价电子排布图为
原子的价电子排布图为___________ 。
(2)浸出过程中通入 的目的是
的目的是___________ 。
(3)萃取时发生反应: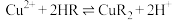 (HR、CuR2在有机层,
(HR、CuR2在有机层, 在水层)。
在水层)。___________ 。
(4)写出用惰性电极电解 溶液发生反应的化学方程式:
溶液发生反应的化学方程式:___________ 。
(5)黄钠铁矾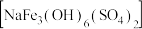 比
比 更易形成沉淀,则生成黄钠铁矾的离子方程式是
更易形成沉淀,则生成黄钠铁矾的离子方程式是___________ 。
(6)第二次使用 调节溶液
调节溶液 ,使
,使 沉淀完全,应将
沉淀完全,应将 调节至
调节至___________ (保留2位小数)。
 、
、 、
、 等杂质)中提取镍和铜的一种工艺流程如下:
等杂质)中提取镍和铜的一种工艺流程如下: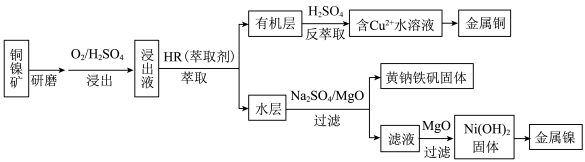
| 物质 |  |  |  |  |
 |  |  |  | 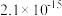 |
③

(1)基态
 原子的价电子排布图为
原子的价电子排布图为(2)浸出过程中通入
 的目的是
的目的是(3)萃取时发生反应:
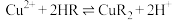 (HR、CuR2在有机层,
(HR、CuR2在有机层, 在水层)。
在水层)。①某种 的结构简式为
的结构简式为 ,该分子中可能与
,该分子中可能与 形成配位键的原子有
形成配位键的原子有
(4)写出用惰性电极电解
 溶液发生反应的化学方程式:
溶液发生反应的化学方程式:(5)黄钠铁矾
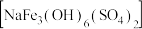 比
比 更易形成沉淀,则生成黄钠铁矾的离子方程式是
更易形成沉淀,则生成黄钠铁矾的离子方程式是(6)第二次使用
 调节溶液
调节溶液 ,使
,使 沉淀完全,应将
沉淀完全,应将 调节至
调节至
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】以废铁屑、低品位软锰矿[主要成分有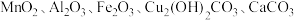 、
、 等]为原料,制备硫酸锰,进一步电解制备金属锰,工艺流程如图所示:
等]为原料,制备硫酸锰,进一步电解制备金属锰,工艺流程如图所示:
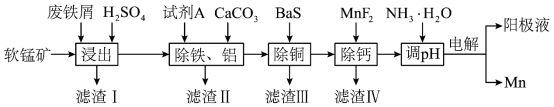
已知:I.部分金属阳离子以氢氧化物沉淀时的 如表:
如表:
Ⅱ.几种化合物的溶解性或溶度积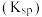 如表:
如表:
(1)基态 的价层电子排布式为
的价层电子排布式为__________ 。
(2)为去除废铁屑表面的油污可采用的方法为__________ ;“浸出”后浸出液中的 价金属阳离子有
价金属阳离子有 、
、__________ 。
(3)锰的浸出率结果如图所示。

由图可知,影响锰浸出率的因素有__________ 。
(4)“除铁、铝”过程中,浸出液需要先用试剂 处理,然后加入
处理,然后加入 ,反应后溶液的
,反应后溶液的 。试剂
。试剂 的作用是
的作用是__________ 。
(5)“除铜”过程中,当铜离子恰好完全沉淀(当离子浓度小于或等于 时视为完全沉淀)时,溶液中
时视为完全沉淀)时,溶液中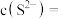
__________  。
。
(6)用惰性电极电解中性 溶液可以制得金属
溶液可以制得金属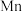 。装置如图所示。
。装置如图所示。
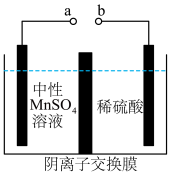
若生成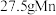 ,右室溶液中最终
,右室溶液中最终 的变化为
的变化为__________ (填“增加”或“减少”) 。
。
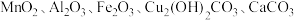 、
、 等]为原料,制备硫酸锰,进一步电解制备金属锰,工艺流程如图所示:
等]为原料,制备硫酸锰,进一步电解制备金属锰,工艺流程如图所示:
已知:I.部分金属阳离子以氢氧化物沉淀时的
 如表:
如表:| 金属阳离子 |  |  |  |  |  |
开始沉淀的 | 6.8 | 1.8 | 3.7 | 8.6 | 5.2 |
沉淀完全的 | 8.3 | 2.8 | 4.7 | 10.1 | 6.7 |
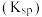 如表:
如表:| 化合物 |  |  |  |  |  |
溶解性或溶度积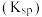 | 溶于水 | 溶于水 | 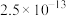 |  |  |
(1)基态
 的价层电子排布式为
的价层电子排布式为(2)为去除废铁屑表面的油污可采用的方法为
 价金属阳离子有
价金属阳离子有 、
、(3)锰的浸出率结果如图所示。

由图可知,影响锰浸出率的因素有
(4)“除铁、铝”过程中,浸出液需要先用试剂
 处理,然后加入
处理,然后加入 ,反应后溶液的
,反应后溶液的 。试剂
。试剂 的作用是
的作用是(5)“除铜”过程中,当铜离子恰好完全沉淀(当离子浓度小于或等于
 时视为完全沉淀)时,溶液中
时视为完全沉淀)时,溶液中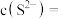
 。
。(6)用惰性电极电解中性
 溶液可以制得金属
溶液可以制得金属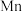 。装置如图所示。
。装置如图所示。
若生成
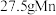 ,右室溶液中最终
,右室溶液中最终 的变化为
的变化为 。
。
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐3】工业上常用水钴矿(主要成分为Co2O3,还含少量Fe2O3、Al2O3、MgO、CaO等杂质)制备钴的氧化物,其制备工艺流程如图:
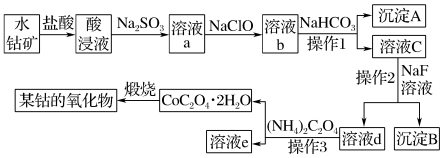
回答下列问题:
(1)在加入盐酸进行“酸浸”时,能提高“酸浸”速率的方法有_______ (任写一种)。
(2)“酸浸”后加入Na2SO3,钴的存在形式为Co2+,写出产生Co2+反应的离子方程式_______ 。
(3)溶液a中加入NaClO的作用为_______ 。
(4)沉淀A的成分为_______ ,操作2的名称是_______ 。
(5)已知:Ksp(CaF2)=5.3×10-9,Ksp(MgF2)=5.2×10-12,若向溶液C中加入NaF溶液,当Mg2+恰好沉淀完全即溶液中c(Mg2+)=1.0×10-5 mol·L-1,此时溶液中c(Ca2+)最大等于_______ mol·L-1。
(6)在空气中煅烧CoC2O4生成钴的某种氧化物(Co3O4)和一种温室气体,写出该反应的化学方程式_______ 。

回答下列问题:
(1)在加入盐酸进行“酸浸”时,能提高“酸浸”速率的方法有
(2)“酸浸”后加入Na2SO3,钴的存在形式为Co2+,写出产生Co2+反应的离子方程式
(3)溶液a中加入NaClO的作用为
(4)沉淀A的成分为
(5)已知:Ksp(CaF2)=5.3×10-9,Ksp(MgF2)=5.2×10-12,若向溶液C中加入NaF溶液,当Mg2+恰好沉淀完全即溶液中c(Mg2+)=1.0×10-5 mol·L-1,此时溶液中c(Ca2+)最大等于
(6)在空气中煅烧CoC2O4生成钴的某种氧化物(Co3O4)和一种温室气体,写出该反应的化学方程式
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】工业以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为原料冶炼铬及获得化工原料红矾钠(Na2Cr2O7·2H2O),工艺流程如图:

已知:常温下NaBiO3不溶于水,有强氧化性,在碱性条件下能将Cr3+转化为 。
。
(1)反应之前先将矿石粉碎的目的是________ ,固体D的主要成分为________ 。
(2)写出反应④的离子方程式________ 。
(3)步骤⑤中不能用盐酸代替硫酸的原因是________ ;将Na2Cr2O7溶液经过________ ,过滤,洗涤,干燥即得红矾钠粗晶体。
(4)工业上常用电解铬酐(CrO3,遇水生成H2Cr2O7和H2CrO4)水溶液的方法镀铬,电镀液中需加入适量的催化剂和添加剂,并通过加入H2O2提高或降低电镀液中Cr(Ⅲ)的含量,发生的部分反应有:
a.2H++2e-=H2
b.2H2O−4e-=O2+4H+
c.2 +2H+⇌
+2H+⇌ +H2O
+H2O
d. +14H++6e−=2Cr3++7H2O
+14H++6e−=2Cr3++7H2O
e.2Cr3++7H2O−6e-= +14H+
+14H+
①镀件上发生的反应有________ (填上述序号)
②电极上 放电生成铬的电极反应式为
放电生成铬的电极反应式为________ 。
③镀铬过程中H2O2体现的化学性质________ 。
A.仅氧化性 B.仅还原性 C.氧化性和还原性

已知:常温下NaBiO3不溶于水,有强氧化性,在碱性条件下能将Cr3+转化为
 。
。(1)反应之前先将矿石粉碎的目的是
(2)写出反应④的离子方程式
(3)步骤⑤中不能用盐酸代替硫酸的原因是
(4)工业上常用电解铬酐(CrO3,遇水生成H2Cr2O7和H2CrO4)水溶液的方法镀铬,电镀液中需加入适量的催化剂和添加剂,并通过加入H2O2提高或降低电镀液中Cr(Ⅲ)的含量,发生的部分反应有:
a.2H++2e-=H2
b.2H2O−4e-=O2+4H+
c.2
 +2H+⇌
+2H+⇌ +H2O
+H2Od.
 +14H++6e−=2Cr3++7H2O
+14H++6e−=2Cr3++7H2Oe.2Cr3++7H2O−6e-=
 +14H+
+14H+①镀件上发生的反应有
②电极上
 放电生成铬的电极反应式为
放电生成铬的电极反应式为③镀铬过程中H2O2体现的化学性质
A.仅氧化性 B.仅还原性 C.氧化性和还原性
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下,回答下列问题:
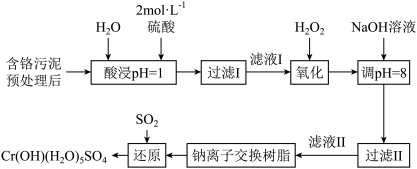
(1)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O ,写出此反应的离子方程式:
,写出此反应的离子方程式:___________
(2)加入NaOH溶液使溶液呈碱性,既可以除去某些杂质离子,同时又可以将Cr2O 转化为CrO
转化为CrO ,写出该反应的离子方程式
,写出该反应的离子方程式___________
(3)写出上述流程中用SO2进行还原时发生反应的离子方程式___________

(1)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O
 ,写出此反应的离子方程式:
,写出此反应的离子方程式:(2)加入NaOH溶液使溶液呈碱性,既可以除去某些杂质离子,同时又可以将Cr2O
 转化为CrO
转化为CrO ,写出该反应的离子方程式
,写出该反应的离子方程式(3)写出上述流程中用SO2进行还原时发生反应的离子方程式
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐3】黏土钒矿中,钒以+3、+4、+5价的化合物存在,还包括钾、镁的铝硅酸盐,以及SiO2、Fe3O4.黏土钒矿采用以下工艺流程可制备偏钒酸铵(NH4VO3)。
②钒元素的存在形态较多,部分四价钒和五价钒物种的分布分数δ与pH的关系如图所示,
(1)NH4+的VSEPR模型是___________ 形。
(2)“酸浸氧化”时,VO+、VO2+被氧化为VO2+,增大“酸浸氧化”速率的措施是___________ (任写一种)。
(3)“中和沉淀”时,滤饼②含有的沉淀有V2O5·xH2O以及___________ 。
(4)“沉淀转溶”时,V2O5·xH2O转化为钒酸盐溶解。滤液③中含有的阴离子有OH−以及___________ 。
(5)①“沉钒”时pH最好约为7且NH4Cl应过量,原因为___________ 。
②温度高于80℃时,沉钒率下降的原因是___________ (任写一种)。
(6)加热偏钒酸铵制备V2O5的化学方程式为___________ 。

| 金属离子 | Fe3+ | Al3+ | Mn2+ | Mg2+ |
| 开始沉淀pH | 1.9 | 3.0 | 8.1 | 8.9 |
| 完全沉淀pH | 3.0 | 4.7 | 10.1 | 10.9 |

(1)NH4+的VSEPR模型是
(2)“酸浸氧化”时,VO+、VO2+被氧化为VO2+,增大“酸浸氧化”速率的措施是
(3)“中和沉淀”时,滤饼②含有的沉淀有V2O5·xH2O以及
(4)“沉淀转溶”时,V2O5·xH2O转化为钒酸盐溶解。滤液③中含有的阴离子有OH−以及
(5)①“沉钒”时pH最好约为7且NH4Cl应过量,原因为
②温度高于80℃时,沉钒率下降的原因是
(6)加热偏钒酸铵制备V2O5的化学方程式为
您最近一年使用:0次



