用0.100mol·L-1的NaOH溶液分别滴定体积均为10.00mL、浓度均为0.100mol·L-1的HCl和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率(电导率越大表示溶液导电性越强)变化如图所示。下列说法正确的是


| A.曲线①代表向HCl中滴加NaOH | B.A点溶液的pH小于C点溶液的pH |
| C.A、B两点水的电离程度:A>B | D.C→D发生了反应:H++OH-=H2O |
2022·北京房山·二模 查看更多[10]
北京市房山区2022届高三第二次模拟测试化学试题北京市一零一中学2022届高三三模化学试题(已下线)2022年浙江1月高考真题变式题(11-20)北京市第一七一中学2022届高三下学期三模化学试题湖南省株洲市九方中学2021-2022学年高二下学期期末考试化学试题(已下线)第23讲 弱电解质的电离平衡(讲)-2023年高考化学一轮复习讲练测(全国通用)(已下线)易错点24 水的电离平衡-备战2023年高考化学考试易错题黑龙江省哈尔滨师范大学附属中学2022-2023学年高二上学期期中考试化学试题北京市顺义一中2023届高三下学期保温练习模拟考试化学试题(已下线)考点2 水的电离与溶液的pH (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
更新时间:2022-07-23 14:24:26
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】水的电离平衡曲线如图所示,下列说法不正确的是


| A.图中五点KW间的关系:B>C>A=D=E |
| B.若从A点到D点,可采用:温度不变在水中加入少量的酸 |
| C.若处在B点时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性 |
| D.若从A点到C点,可采用:温度不变在水中加入适量的NH4Cl 固体的变化 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】向 20mL 0.5mol·L-1的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示。下列关于混合溶液的说法错误的是


| A.醋酸的电离平衡常数:b 点>a 点 |
| B.由水电离出的 c(OH-):b 点>a 点 |
| C.从a点到b点,混合溶液中可能存在:c(Na+)=c(CH3COO-) |
| D.b 点到c点,混合溶液中一直存在:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】下列说法正确的是
| A.强电解质一定是离子化合物,弱电解质一定是共价化合物 |
| B.已知25℃时H2CO3的Ka1=4.30×10-7,CH3COOH的Ka=1.75×10-5,则等体积、等浓度的两种酸的溶液中,由水电离出来的c(H+):H2CO3 >CH3COOH |
| C.用广泛pH试纸测得0.1mol/L次氯酸溶液的pH=3.5 |
| D.常温下,将稀醋酸溶液加水稀释,醋酸电离程度增大,溶液导电能力增强 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】氨基酸分子中含有—NH2和COOH两种官能团,氨基酸分子表面不带电荷时的pH称为等电点,等电点时甘氨酸( H3NCH2COO- )记作HA.已知H2A
H3NCH2COO- )记作HA.已知H2A
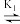 HA
HA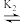 A- ,pK= -1g K。25℃时用NaOH溶液滴定。pH=0的甘氨酸,甘氨酸被滴定的百分数[被滴定的百分数=
A- ,pK= -1g K。25℃时用NaOH溶液滴定。pH=0的甘氨酸,甘氨酸被滴定的百分数[被滴定的百分数=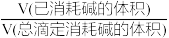 ×100%]与溶液pH的关系如图所示,下列说法错误的是
×100%]与溶液pH的关系如图所示,下列说法错误的是

 H3NCH2COO- )记作HA.已知H2A
H3NCH2COO- )记作HA.已知H2A
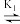 HA
HA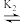 A- ,pK= -1g K。25℃时用NaOH溶液滴定。pH=0的甘氨酸,甘氨酸被滴定的百分数[被滴定的百分数=
A- ,pK= -1g K。25℃时用NaOH溶液滴定。pH=0的甘氨酸,甘氨酸被滴定的百分数[被滴定的百分数=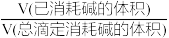 ×100%]与溶液pH的关系如图所示,下列说法错误的是
×100%]与溶液pH的关系如图所示,下列说法错误的是
| A.X点时,c(HA) =c(A- ) |
| B.Y点的pH=(pK1+ pK2)/2 |
| C.从Y点到Z点的过程中发生的反应为HA +OH-= A- +H2O |
| D.—COO- 结合H+的能力比—NH2的弱 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】常温下,向
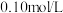
 溶液和
溶液和
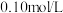
 溶液中滴加
溶液中滴加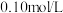
 溶液的过程中,pH和导电能力的变化如下图所示,下列说法
溶液的过程中,pH和导电能力的变化如下图所示,下列说法不正确 的是


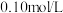
 溶液和
溶液和
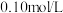
 溶液中滴加
溶液中滴加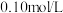
 溶液的过程中,pH和导电能力的变化如下图所示,下列说法
溶液的过程中,pH和导电能力的变化如下图所示,下列说法
A. | B. |
C.导电能力图是向盐酸中滴加 | D. 和 和 对应的溶液中水的电离能力相同 对应的溶液中水的电离能力相同 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】室温下,将0.1 mol/L NaOH溶液滴入20.00 mL 0.1 mol/L HA溶液,溶液pH随加入NaOH溶液体积的变化曲线如图所示。

其中不正确的是

其中不正确的是
| A.①点:由水电离出的c(H+)=1×10-3mol/L |
| B.②点:c(A-)>c(Na+)>c(H+)>c(OH-) |
| C.③点:c(Na+)=c(A-)>c(H+)=c(OH-) |
| D.③点加入NaOH溶液的体积小于20.00mL |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】用AG表示溶液酸度: 。在室温下,用 0.1mol•L-1的NaOH溶液滴定20.00mL 0.1mol•L-1的CH3 COOH溶液,滴定结果如图所示。下列分析正确的是
。在室温下,用 0.1mol•L-1的NaOH溶液滴定20.00mL 0.1mol•L-1的CH3 COOH溶液,滴定结果如图所示。下列分析正确的是

 。在室温下,用 0.1mol•L-1的NaOH溶液滴定20.00mL 0.1mol•L-1的CH3 COOH溶液,滴定结果如图所示。下列分析正确的是
。在室温下,用 0.1mol•L-1的NaOH溶液滴定20.00mL 0.1mol•L-1的CH3 COOH溶液,滴定结果如图所示。下列分析正确的是
| A.0.1mol•L-1的CH3 COOH溶液的pH=3.4 |
| B.A点加入的NaOH溶液的体积为20.00mL |
| C.滴定过程中,c(CH3COO-)/c(H+)逐渐减小 |
| D.B点溶液中可能存在c(Na+)>c(CH3COO-)> c(OH-)>c(H+) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐3】常温下,用0.1mol·L-1NaOH溶液滴定40mL0.1mol·L-1H2SO3溶液,所得滴定曲线如图所示(忽略混合时溶液体积的变化)。下列叙述错误的是


| A.可求出Ka1(H2SO3)、Ka2(H2SO3)的值 |
| B.滴定中两次反应终点可依次用甲基橙、酚酞作指示剂 |
C.图中Y点对应的溶液中3c(SO )=c(Na+)+c(H+)-c(OH-) )=c(Na+)+c(H+)-c(OH-) |
D.图中Z点对应的溶液中:c(Na+)>c(SO )>c(HSO )>c(HSO )>c(OH-) )>c(OH-) |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】已知25℃时HA和BOH的电离常数相等,实验测得10mLamol•L-1NaA溶液、10mLamol•L-1BCl溶液的pH分别随温度与稀释加水量的变化如图所示。下列说法不正确 的是


| A.加水稀释初期两种盐的水解率变化程度比稀释后期大 |
| B.图中虚线D表示BCl的pH随温度的变化,实线B表示NaA的pH随加水量的变化 |
| C.将BCl溶液加水稀释至浓度a/xmol・L-1溶液pH变化值大于lgx |
| D.将稀释相同倍数的NaA与BCl溶液混合,混合液中c(A-)=c(B+) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】某温度下,等体积、c(H+)相同的盐酸和醋酸溶液分别加水稀释,溶液中的c(H+)随溶液体积变化的曲线如图所示。据图判断下列说法正确的是


| A.曲线Ⅱ表示的是盐酸的变化曲线 |
| B.b点溶液的导电性比c点溶液的导电性强 |
| C.取等体积的a点、b点对应的溶液,消耗的NaOH的量相同 |
| D.b点酸的总浓度大于a点酸的总浓度 |
您最近一年使用:0次


 溶液的pH,会使测得结果偏大
溶液的pH,会使测得结果偏大 减小
减小

