NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于在细胞和细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控。
(1)实验室用金属铜和稀硝酸制取NO的离子方程式为___________
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。
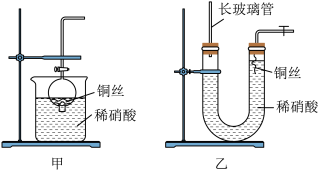
打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的原因是(写化学方程式)_____ 。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始时,可以在U形管右端观察到无色的NO气体。长玻璃管的作用是___________ 。
(4)假设实验中12.8 g Cu全部溶解,需要通入标准状况下___________ L O2才能使NO全部溶于水。
(5)用金属铜制取硝酸铜,从节约原料和防止环境污染的角度考虑,下列4种方法中最好的是____ (填“甲”“乙”“丙”或“丁”),理由是______ 。
甲:铜 硝酸铜 乙:铜
硝酸铜 乙:铜 硝酸铜
硝酸铜
丙:铜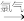 氯化铜
氯化铜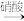 硝酸铜
硝酸铜
丁:铜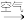 氧化铜
氧化铜 硝酸铜
硝酸铜
(1)实验室用金属铜和稀硝酸制取NO的离子方程式为
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。

打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的原因是(写化学方程式)
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始时,可以在U形管右端观察到无色的NO气体。长玻璃管的作用是
(4)假设实验中12.8 g Cu全部溶解,需要通入标准状况下
(5)用金属铜制取硝酸铜,从节约原料和防止环境污染的角度考虑,下列4种方法中最好的是
甲:铜
 硝酸铜 乙:铜
硝酸铜 乙:铜 硝酸铜
硝酸铜丙:铜
 氯化铜
氯化铜 硝酸铜
硝酸铜丁:铜
 氧化铜
氧化铜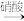 硝酸铜
硝酸铜
更新时间:2022-08-29 14:58:26
|
相似题推荐
【推荐1】下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是既能与强酸反应生成氢气又能与强碱反应生成氢气的金属,K是一种红棕色气体,D的俗名叫铁红,A是形成酸雨的主要气体。
请填写下列空白:
(1)推导出下列物质的化学式:C:___________ E:___________
(2)在反应②、③、⑥、⑨中,既属于化合反应又属于非氧化还原反应的是___________ (填写序号)。
(3)在反应⑨中氧化剂与还原剂的物质的量之比为___________ 。
(4)反应⑦的化学方程式是:___________
(5)反应④的离子方程式是:___________

请填写下列空白:
(1)推导出下列物质的化学式:C:
(2)在反应②、③、⑥、⑨中,既属于化合反应又属于非氧化还原反应的是
(3)在反应⑨中氧化剂与还原剂的物质的量之比为
(4)反应⑦的化学方程式是:
(5)反应④的离子方程式是:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】工业制硫酸的过程中利用反应2SO2(g)+O2(g) 2SO3(g);△H<0,将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
2SO3(g);△H<0,将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
(1)一定条件下,向一带活塞的密闭容器中充入2mol SO2和1mol O2发生反应,则下列说法正确的是___________
A.若反应速率v(SO2)﹦v(SO3),则可以说明该可逆反应已达到平衡状态
B.保持温度和容器体积不变,充入2mol N2,化学反应速率加快
C.平衡后仅增大反应物浓度,则平衡一定右移,各反应物的转化率一定都增大
D.平衡后移动活塞压缩气体,平衡时SO2、O2的百分含量减小,SO3的百分含量增大
E.保持温度和容器体积不变,平衡后再充入2mol SO3,再次平衡时SO2的百分含量比原平衡时SO2的百分含量小
F.平衡后升高温度,平衡常数K增大
(2)将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
①实验1从开始到反应达到化学平衡时,v(SO2)表示的反应速率为___________ ;
②T1___________ T2,(选填“>”、“<”或“=”),实验2中达平衡时 O2的转化率为___________ ;
(3)尾气SO2用NaOH溶液吸收后会生成Na2SO3.现有常温下0.1mol/L Na2SO3溶液,实验测定其pH约为8,完成下列问题:
①用离子方程式表示该溶液呈碱性的原因:___________ ;
②该溶液中c(OH-)=c(Na+)+___________ (用溶液中所含微粒的浓度表示)。
(4)如果用含等物质的量溶质的下列各溶液分别来吸收SO2,则理论吸收量由多到少的顺序是___________
 2SO3(g);△H<0,将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
2SO3(g);△H<0,将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:(1)一定条件下,向一带活塞的密闭容器中充入2mol SO2和1mol O2发生反应,则下列说法正确的是
A.若反应速率v(SO2)﹦v(SO3),则可以说明该可逆反应已达到平衡状态
B.保持温度和容器体积不变,充入2mol N2,化学反应速率加快
C.平衡后仅增大反应物浓度,则平衡一定右移,各反应物的转化率一定都增大
D.平衡后移动活塞压缩气体,平衡时SO2、O2的百分含量减小,SO3的百分含量增大
E.保持温度和容器体积不变,平衡后再充入2mol SO3,再次平衡时SO2的百分含量比原平衡时SO2的百分含量小
F.平衡后升高温度,平衡常数K增大
(2)将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| SO2 | O2 | SO2 | O2 | |||
| 1 | T1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | 4 | 2 | 0.4 | y | 9 |
①实验1从开始到反应达到化学平衡时,v(SO2)表示的反应速率为
②T1
(3)尾气SO2用NaOH溶液吸收后会生成Na2SO3.现有常温下0.1mol/L Na2SO3溶液,实验测定其pH约为8,完成下列问题:
①用离子方程式表示该溶液呈碱性的原因:
②该溶液中c(OH-)=c(Na+)+
(4)如果用含等物质的量溶质的下列各溶液分别来吸收SO2,则理论吸收量由多到少的顺序是___________
| A.Na2CO3 | B.Ba(NO3)2 | C.Na2S | D.酸性KMnO4 |
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】 是一种光催化材料。工业利用某废催化剂(主要含
是一种光催化材料。工业利用某废催化剂(主要含 、
、 、NiO及少量
、NiO及少量 、
、 )制备
)制备 的工艺流程如下:
的工艺流程如下: 、NiO都是不溶于水的碱性氧化物
、NiO都是不溶于水的碱性氧化物
Ⅱ.0.1
 溶液的pH=1.0
溶液的pH=1.0
Ⅲ.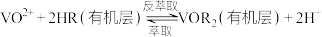
回答下列问题:
(1)滤渣的主要成分是___________ ;酸化时, 完全转化为
完全转化为 的最大pH为
的最大pH为___________ 。(已知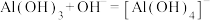
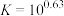 ;离子浓度≤10-5mol/L时沉淀完全)
;离子浓度≤10-5mol/L时沉淀完全)
(2)“酸化”后的溶液中存在 ,则“还原”时发生反应的离子方程式为
,则“还原”时发生反应的离子方程式为___________ 。
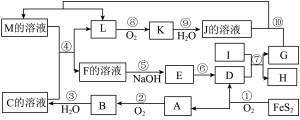
(3)反萃取剂应选用___________ (填“酸性”、“中性”或“碱性”)溶液;若“萃取”、“反萃取”的过程中钒的总回收率为90%,则“还原”时加入的 和“氧化”时加入的
和“氧化”时加入的 的物质的量之比为
的物质的量之比为___________ 。
(4)生成 的化学方程式为
的化学方程式为___________ ,实验测得溶液pH、温度和 溶液浓度对生成
溶液浓度对生成 的粒径影响图像如下:
的粒径影响图像如下: 晶体的最佳条件是
晶体的最佳条件是___________ ;制备过程中需加入NaOH维持最佳pH,若 过量,需要增加NaOH的用量,原因是
过量,需要增加NaOH的用量,原因是___________ 。
 是一种光催化材料。工业利用某废催化剂(主要含
是一种光催化材料。工业利用某废催化剂(主要含 、
、 、NiO及少量
、NiO及少量 、
、 )制备
)制备 的工艺流程如下:
的工艺流程如下: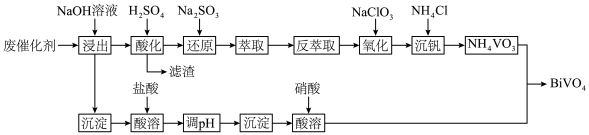
 、NiO都是不溶于水的碱性氧化物
、NiO都是不溶于水的碱性氧化物Ⅱ.0.1

 溶液的pH=1.0
溶液的pH=1.0Ⅲ.
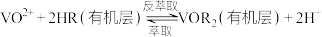
回答下列问题:
(1)滤渣的主要成分是
 完全转化为
完全转化为 的最大pH为
的最大pH为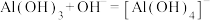
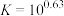 ;离子浓度≤10-5mol/L时沉淀完全)
;离子浓度≤10-5mol/L时沉淀完全)(2)“酸化”后的溶液中存在
 ,则“还原”时发生反应的离子方程式为
,则“还原”时发生反应的离子方程式为(3)反萃取剂应选用
 和“氧化”时加入的
和“氧化”时加入的 的物质的量之比为
的物质的量之比为(4)生成
 的化学方程式为
的化学方程式为 溶液浓度对生成
溶液浓度对生成 的粒径影响图像如下:
的粒径影响图像如下: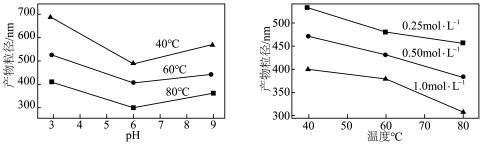
 晶体的最佳条件是
晶体的最佳条件是 过量,需要增加NaOH的用量,原因是
过量,需要增加NaOH的用量,原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】烟气脱硝(将NOx转化成无害物质)是工业废气处理中的重要工艺。相对传统的处理工艺,活性炭吸附脱硝法具有工艺过程无二次污染、氮资源和脱硝剂可循环利用等优点。回答下列问题。
(1)活性炭吸附脱硝法的工艺流程如图所示。
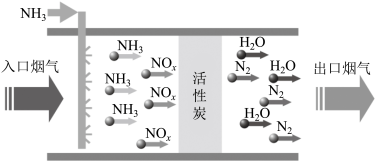
活性炭的作用是_______ ,若入口烟气中NOx以NO形式参加反应,则相应的化学方程式为_______ 。
(2)某同学选择如图装置(省略夹持仪器)对该方法进行模拟实验:
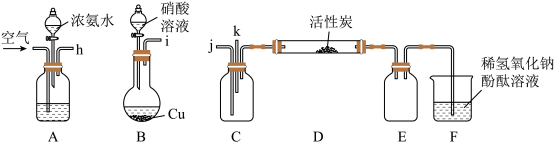
①实验前,A、B产生的气体导入C装置,则应h→_______ ,i→_______ 的顺序连接仪器,原因是_______ 。
②先通入空气,再打开A、B中分液漏斗的活塞,观察到B中出现红棕色气体,此时,所获得的氮氧化物中一定含有_______ 气体。
③装置F除了能用于判断气体流速和脱硝效果外,还可用于_______ 。
④常温常压下,以一定流速和比例混合NO、NH3、空气等气体进行模拟实验,现测得NO入口体积分数为3×10-4,出口体积分数为6×10-5,则脱硝百分率为_______ %(可忽略脱硝前后气体总体积的变化,计算结果保留小数点后1位)。
(1)活性炭吸附脱硝法的工艺流程如图所示。

活性炭的作用是
(2)某同学选择如图装置(省略夹持仪器)对该方法进行模拟实验:

①实验前,A、B产生的气体导入C装置,则应h→
②先通入空气,再打开A、B中分液漏斗的活塞,观察到B中出现红棕色气体,此时,所获得的氮氧化物中一定含有
③装置F除了能用于判断气体流速和脱硝效果外,还可用于
④常温常压下,以一定流速和比例混合NO、NH3、空气等气体进行模拟实验,现测得NO入口体积分数为3×10-4,出口体积分数为6×10-5,则脱硝百分率为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】用下列仪器、药品验证由铜和适量硝酸反应产生的气体中含NO(仪器可选择使用,N2和O2的用量可自由控制)。

已知:①
② 气体液化温度:NO2 21℃, NO -152℃
试回答:
(1)写出装置A中发生反应的化学方程式_________________________ 。
(2)仪器的连接顺序(按左→右连接,填各接口的编号)为_________________ 。在填加药品前应先进行的操作是___________________ 。
(3)反应前先通入N2,目的是_______________________ ;
(4)确认气体中含NO的现象是__________________________ 。
(5)装置B的作用是______________________ ;F的作用是_________________ 。
(6)若从A出来的混合气体中NO2、NO的体积分别为V1mL、V2mL(V1<V2),若最终氮的氧化物完全被溶液吸收,装置中至少需要充入氧气的体积为:_____ (相同状态下)。

已知:①

② 气体液化温度:NO2 21℃, NO -152℃
试回答:
(1)写出装置A中发生反应的化学方程式
(2)仪器的连接顺序(按左→右连接,填各接口的编号)为
(3)反应前先通入N2,目的是
(4)确认气体中含NO的现象是
(5)装置B的作用是
(6)若从A出来的混合气体中NO2、NO的体积分别为V1mL、V2mL(V1<V2),若最终氮的氧化物完全被溶液吸收,装置中至少需要充入氧气的体积为:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】某小组同学利用下面的实验装置(气密性已检验,试管内预先充满氮气)验证硝酸的性质。
试填空:
(1)步骤i中,红棕色气体是___________ 。
(2)步骤ii中,浓硝酸被稀释成稀硝酸,能说明稀硝酸具有氧化性的现象是___________ 。
(3)步骤iii中,注射器中无色气体变为红棕色,发生反应的化学方程式为___________ 。
(4)上述实验能否证明铜与稀硝酸反应生成NO,并说明理由___________ 。
| 实验装置 | 实验步骤 | 实验现象 |
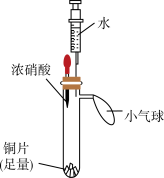 | i.挤压胶头,使浓硝酸滴入试管 | 产生红棕色气体,溶液变为绿色 |
| ii.一段时间后,推动注射器活塞,使水全部进入试管 | 铜片表面产生气泡,溶液变蓝,试管内气体逐渐变为无色 | |
| iii. 试管内气体变为无色后,拉动注射器活塞,吸取少量无色气体;拔下注射器,再拉动活塞吸入少量空气 | 注射器中无色气体变为红棕色 |
(1)步骤i中,红棕色气体是
(2)步骤ii中,浓硝酸被稀释成稀硝酸,能说明稀硝酸具有氧化性的现象是
(3)步骤iii中,注射器中无色气体变为红棕色,发生反应的化学方程式为
(4)上述实验能否证明铜与稀硝酸反应生成NO,并说明理由
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】某化学兴趣小组利用NaI溶液中通入少量Cl2得到含碘废液,再利用含碘废液获取NaI固体,实验流程如图:

已知反应②:2I-+2Cu2++SO +H2O=2CuI↓+SO
+H2O=2CuI↓+SO +2H+
+2H+
回答下列问题:
(1)过滤实验所需要的玻璃仪器有普通漏斗、烧杯、_______ ,所缺玻璃仪器的作用是_______ 。
(2)反应③中CuI被氧化,还原产物只有NO2,该反应的化学方程式为_______ 。
(3)化合物B中含两种元素,铁元素原子与另一种元素原子的物质的量之比为3:8,则化合物B的化学式为_______ 。
(4)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,则反应⑤的化学方程式为_______ 。
(5)将足量的Cl2通入含12g NaI的溶液中,一段时间后把溶液蒸干、灼烧,得到的固体是_______ ,其质量为_______ g。

已知反应②:2I-+2Cu2++SO
 +H2O=2CuI↓+SO
+H2O=2CuI↓+SO +2H+
+2H+回答下列问题:
(1)过滤实验所需要的玻璃仪器有普通漏斗、烧杯、
(2)反应③中CuI被氧化,还原产物只有NO2,该反应的化学方程式为
(3)化合物B中含两种元素,铁元素原子与另一种元素原子的物质的量之比为3:8,则化合物B的化学式为
(4)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,则反应⑤的化学方程式为
(5)将足量的Cl2通入含12g NaI的溶液中,一段时间后把溶液蒸干、灼烧,得到的固体是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】下图是各种不同密度的硝酸与铁反应(相同温度)时主要还原产物的分布图。请认真读图分析,回答有关问题。
(1)下列叙述中正确的是(填序号)_______________ 。
A.图中横坐标是硝酸的密度,硝酸的密度越大,其浓度越小。
B.当还原剂和温度相同时,不同浓度的硝酸被还原的产物不是单一的,只是在某浓度时,以某种产物为主而已。
C.硝酸的浓度越大,还原产物中N元素低化合价产物越少
D.当硝酸密度大于1.3g·cm-3时,还原产物主要为NO、NO2
(2)从下图中选择仪器、药品验证由铁和过量1.36 g·cm-3硝酸反应产生的气体中含有NO(N2和O2的用量可自由控制,加热装置和固定装置省略)
已知:Ⅰ.NO+NO2+2OH-=2NO2-+H2O
Ⅱ.常温下,NO2与N2O4混合存在,在0℃时几乎只有无色的N2O4液体或晶体存在。
①仪器的连接顺序(按左→右连接,填各接口的编号)为______________ 。
②反应前先通入N2,目的是___________________ 。
③确认气体中含的现象是__________________ 。
④装置F的作用是________________ 。
⑤若从A出来的混合气体中NO2、NO的体积分别为V1mL、V2mL(V1、V2均不为0),且本套装置最终能将氮的氧化物完全吸收,则装置中至少需要冲入氧气的体积为:________ mL(相同状态下)。
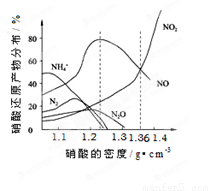
(1)下列叙述中正确的是(填序号)
A.图中横坐标是硝酸的密度,硝酸的密度越大,其浓度越小。
B.当还原剂和温度相同时,不同浓度的硝酸被还原的产物不是单一的,只是在某浓度时,以某种产物为主而已。
C.硝酸的浓度越大,还原产物中N元素低化合价产物越少
D.当硝酸密度大于1.3g·cm-3时,还原产物主要为NO、NO2
(2)从下图中选择仪器、药品验证由铁和过量1.36 g·cm-3硝酸反应产生的气体中含有NO(N2和O2的用量可自由控制,加热装置和固定装置省略)
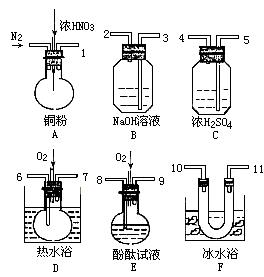
已知:Ⅰ.NO+NO2+2OH-=2NO2-+H2O
Ⅱ.常温下,NO2与N2O4混合存在,在0℃时几乎只有无色的N2O4液体或晶体存在。
①仪器的连接顺序(按左→右连接,填各接口的编号)为
②反应前先通入N2,目的是
③确认气体中含的现象是
④装置F的作用是
⑤若从A出来的混合气体中NO2、NO的体积分别为V1mL、V2mL(V1、V2均不为0),且本套装置最终能将氮的氧化物完全吸收,则装置中至少需要冲入氧气的体积为:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】锌锰废电池中的黑色粉末包含碳粉、Fe、Cu、Ag和MnO2等物质,从中回收、精制MnO2的工艺流程如图。
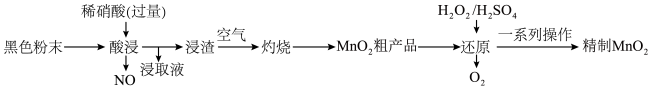
(1)“灼烧”的目的是除去______ 。
(2)“浸取液”中含有的金属阳离子有______ (填离子符号)。
(3)“还原”过程中,MnO2溶解生成Mn2+,写出发生反应的离子方程式:______ ,溶解一定量的MnO2,H2O2的实际消耗量比理论值高的原因是______ 。
(4)若将收集到的NO和O2混合,可观察到的现象为______ 。若此混合气体恰好能被水完全吸收,则收集到的NO和O2的物质的量之比为______ 。

(1)“灼烧”的目的是除去
(2)“浸取液”中含有的金属阳离子有
(3)“还原”过程中,MnO2溶解生成Mn2+,写出发生反应的离子方程式:
(4)若将收集到的NO和O2混合,可观察到的现象为
您最近一年使用:0次



