下列说法正确的是
| A.向10mL0.1mol·L-1AgNO3溶液中滴加几滴等浓度NaCl溶液产生白色沉淀,再滴加等浓度NaI溶液,产生黄色沉淀,则证明Ksp(AgCl)>Ksp(AgI) |
| B.常温下,将1mLpH=5盐酸稀释至1000mL,所得溶液的pH=8 |
| C.常温下,pH=2的盐酸和醋酸,c(H+)前者大于后者 |
| D.常温下,当水电离出的c(H+)为1×10-13mol·L-1时,此溶液的pH可能为1或13 |
更新时间:2022-09-07 08:31:41
|
相似题推荐
【推荐1】由实验操作和现象,可得出相应结论的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 常温下,分别测得饱和NaA溶液和饱和NaB溶液的pH | 溶液的pH:NaA>NaB | 溶解度:NaA>NaB |
| B | 向某溶液中先滴加 有白色沉淀生成,再加稀盐酸 有白色沉淀生成,再加稀盐酸 | 白色沉淀不溶解 | 原溶液中有 |
| C | 常温下, 溶液中滴加酚酞 溶液中滴加酚酞 | 溶液变浅红色 |  的水解程度强于电离程度 的水解程度强于电离程度 |
| D | 向 的NaOH溶液中滴加2滴 的NaOH溶液中滴加2滴 的 的 溶液,再滴加2滴 溶液,再滴加2滴 的 的 溶液 溶液 | 有红褐色沉淀生成 |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】氢硫酸是H2S的水溶液,是一种二元弱酸。Na2S是染料工业中用于生产硫化青和硫化蓝的原料,现对常温时Na2S溶液的性质进行探究,则下列结论正确的是
| A.0.1mol•L-1 Na2S溶液中存在:c(H+)+c(Na+)=c(OH-)+c(HS-)+c(S2-) |
B.已知酸性:H2CO3>H2S,向Na2S溶液中通入过量CO2,反应的离子方程式为CO2+S2-+H2O=H2S+ |
| C.0.1mol•L-1的Na2S溶液存在:c(OH-)=c(H+)+c(HS-)+2c(H2S) |
| D.在5mL 0.01mol•L-1的Na2S溶液中先滴入几滴0.01mol•L-1 ZnCl2溶液有白色沉淀生成,再滴入0.01mol•L-1 CuCl2溶液,出现黑色沉淀,证明Ksp(CuS)<Ksp(ZnS) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】25°C时,向10mL0.05mol·L-1的MgCl2溶液中通入氨气,测得溶液中的p(OH-)与p(Mg2+)之间的变化曲线如图所示,[已知:Kb(NH3·H2O)=1.8×10-5,p(X)=-lgc(X),忽略反应过程中溶液体积的变化]。下列说法正确为是
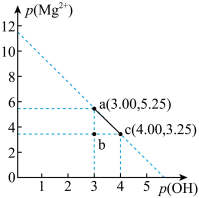

A.a点溶液满足:c( )>c(NH3·H2O)>c(Mg2+)>c(OH-) )>c(NH3·H2O)>c(Mg2+)>c(OH-) |
| B.b点溶液中无Mg(OH)2沉淀产生 |
C.c点溶液满足:2c(Mg2+)+c( )>c(Cl-) )>c(Cl-) |
| D.Ksp[Mg(OH)2]的数量级是10-11 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】向工业废水中加入硫化物可以获得CuS、FeS纳米粒子[已知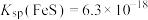 ,
, ],下列说法正确的是
],下列说法正确的是
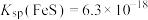 ,
, ],下列说法正确的是
],下列说法正确的是A.FeS固体不能用于去除工业废水中的 |
B.向 和 和 混合溶液中加入 混合溶液中加入 溶液,当两种沉淀共存时, 溶液,当两种沉淀共存时, |
C.向CuS饱和溶液中加入 固体,CuS的溶解平衡逆向移动,滤液中一定存在 固体,CuS的溶解平衡逆向移动,滤液中一定存在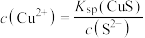 |
D.已知 溶液中 溶液中 ,可判断CuS易溶于稀盐酸 ,可判断CuS易溶于稀盐酸 |
您最近一年使用:0次
【推荐3】自然界中原生铜的硫化物经氧化、淋滤后变成CuSO4溶液,遇到闪锌矿(ZnS)可慢慢转变为铜蓝(CuS)。已知:Ksp(ZnS)=2×10-22,Ksp(CuS)=6×10-36。下列说法不正确的是
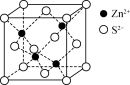

| A.1个ZnS晶胞(如图所示)中含4个S2- |
| B.Cu2+基态核外电子排布式为[Ar]3d9 |
C.反应ZnS(s)+Cu2+(aq)⇌CuS(s)+Zn2+(aq)正向进行,需满足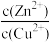 < < ×1014 ×1014 |
D.生成铜蓝后的溶液中一定存在:c(S2-)=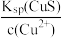 且c(S2-)> 且c(S2-)>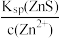 |
您最近一年使用:0次



