“绿水青山就是金山银山”,运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)汽车是近代重要的交通运输工具,随着汽车量的激增,汽车尾气造成的环境污染也日益严重。汽车尾气中的有害成分主要有CO、NO、SO2、颗粒物和臭氧等。
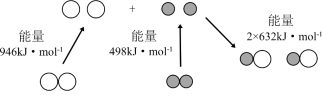
①汽车尾气中NO生成过程中的能量变化如图所示。1 mol N2和1 mol O2完全反应生成NO会_______ (填“吸收”或“放出”)_______ kJ能量。
②一种新型催化剂用于NO和CO的反应:NO+2CO2 CO2+N2为了测定在某种催化剂作用下该反应的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:
CO2+N2为了测定在某种催化剂作用下该反应的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:
前2 s内的平均反应速率v(N2)=_______ 。(保留小数点后一位)
③在容积固定的绝热容器中发生反应2NO+2CO 2CO2+N2,下列能说明该反应已达到平衡状态的是
2CO2+N2,下列能说明该反应已达到平衡状态的是_______ (填标号)
A.容器内混合气体温度不再变化 B.容器内的气体压强保持不变
C.2v逆(NO)=v正(N2) D.容器内混合气体密度保持不变
(2)煤燃烧排放的烟气中含有SO2和NO2,会形成酸雨,污染大气。
①NaClO2溶液在碱性条件下可对烟气进行脱硫、脱硝,效果非常好。完成下列对烟气脱氮过程的离子方程式:_______
_______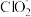 +_______NO+__________=_______Cl-+_______
+_______NO+__________=_______Cl-+_______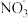 +______________。
+______________。
②针对含SO2的工业废气可以采用“钙基固硫法”。例如将生石灰与含硫的煤混合后再燃烧,可以将SO2最终转化为CaSO4,请写出生石灰将SO2转化为CaSO4的反应的化学方程式:_______
③将SO2转化为重要的化工原料H2SO4的原理示意图如图。
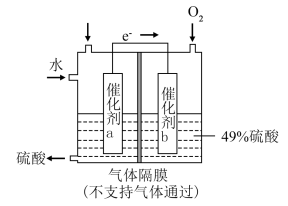
催化剂a表面的电极反应式为_______ 。若得到的硫酸质量分数仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为_______ 。
(1)汽车是近代重要的交通运输工具,随着汽车量的激增,汽车尾气造成的环境污染也日益严重。汽车尾气中的有害成分主要有CO、NO、SO2、颗粒物和臭氧等。
①汽车尾气中NO生成过程中的能量变化如图所示。1 mol N2和1 mol O2完全反应生成NO会

②一种新型催化剂用于NO和CO的反应:NO+2CO2
 CO2+N2为了测定在某种催化剂作用下该反应的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:
CO2+N2为了测定在某种催化剂作用下该反应的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/(10-4 mol·L-1) | 10 | 4.5 | 2.5 | 1.5 | 1.0 | 1.0 |
| c(CO)/(10-3 mol·L-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
前2 s内的平均反应速率v(N2)=
③在容积固定的绝热容器中发生反应2NO+2CO
 2CO2+N2,下列能说明该反应已达到平衡状态的是
2CO2+N2,下列能说明该反应已达到平衡状态的是A.容器内混合气体温度不再变化 B.容器内的气体压强保持不变
C.2v逆(NO)=v正(N2) D.容器内混合气体密度保持不变
(2)煤燃烧排放的烟气中含有SO2和NO2,会形成酸雨,污染大气。
①NaClO2溶液在碱性条件下可对烟气进行脱硫、脱硝,效果非常好。完成下列对烟气脱氮过程的离子方程式:
_______
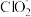 +_______NO+__________=_______Cl-+_______
+_______NO+__________=_______Cl-+_______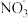 +______________。
+______________。②针对含SO2的工业废气可以采用“钙基固硫法”。例如将生石灰与含硫的煤混合后再燃烧,可以将SO2最终转化为CaSO4,请写出生石灰将SO2转化为CaSO4的反应的化学方程式:
③将SO2转化为重要的化工原料H2SO4的原理示意图如图。

催化剂a表面的电极反应式为
更新时间:2022-09-10 07:11:42
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】在密闭容器中进行反应①Fe(s)+CO2(g)  FeO(s)+CO(g) ΔH1=akJ·mol-
FeO(s)+CO(g) ΔH1=akJ·mol-
反应②2CO(g)+O2(g) 2CO2(g) △H2=b kJ·mol-
2CO2(g) △H2=b kJ·mol-
反应③2Fe(s)+O2(g) 2FeO(s) △H3
2FeO(s) △H3
(1) △H3=___________ (用含a、b的代数式表示)。
(2)反应①的化学平衡常数表达式K=____________ ,已知500℃时反应①的平衡常数K=1,在此温度下2 L密闭容器中进行反应①,Fe和CO2的起始量均为2.0 mol,达到平衡时CO2的转化率为______________ ,CO的平衡浓度为________________ 。
(3)将上述平衡体系升温至700℃,再次达到平衡时体系中CO的浓度是CO2浓度的两倍,则a___________ 0(填“>”、“<”或“=”)。为了加快化学反应速率且使体系中CO的物质的量增加,其他条件不变时,可以采取的措施有__________ (填序号)。
A.缩小反应器体积 B.再通入CO2 c.升高温度 D.使用合适的催化剂
 FeO(s)+CO(g) ΔH1=akJ·mol-
FeO(s)+CO(g) ΔH1=akJ·mol-反应②2CO(g)+O2(g)
 2CO2(g) △H2=b kJ·mol-
2CO2(g) △H2=b kJ·mol-反应③2Fe(s)+O2(g)
 2FeO(s) △H3
2FeO(s) △H3(1) △H3=
(2)反应①的化学平衡常数表达式K=
(3)将上述平衡体系升温至700℃,再次达到平衡时体系中CO的浓度是CO2浓度的两倍,则a
A.缩小反应器体积 B.再通入CO2 c.升高温度 D.使用合适的催化剂
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】氨广泛用于生产化肥、制冷剂等方面。回答下列问题:
(1)实验室可用下图所示装置合成氨。

①合成氨时,还原铁粉的作用是________________ 。
②锥形瓶中盛有一定量的水,并滴有几滴酚酞试剂,反应—段时间后,锥形瓶中溶液变红,则气体X的成分为N2、水蒸气、____________ 和_________________ 。
⑵最近斯坦福大学研究人员发明了一种SUNCAT的锂循环系统,可持续合成氨,其原理如图所示。
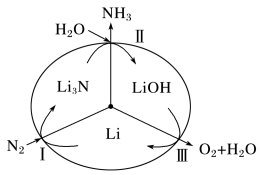
①图中反应Ⅱ的化学方程式为____________________ 。
②反应Ⅲ中能量转化的方式是__________________ (填“电能转变为化学能”或“化学能转变为电能”)。
(3)液氨可用作制冷剂,液氨气化时__________ (填“释放”或“吸收”)能量;液氨泄漏遇明火会发生爆炸。已知部分化学键的键能数据如下表所示:
则反应 4NH3(g)+3O2(g)=2N2(g)+6H2O(g)的反应热△H=____________ 。
(1)实验室可用下图所示装置合成氨。

①合成氨时,还原铁粉的作用是
②锥形瓶中盛有一定量的水,并滴有几滴酚酞试剂,反应—段时间后,锥形瓶中溶液变红,则气体X的成分为N2、水蒸气、
⑵最近斯坦福大学研究人员发明了一种SUNCAT的锂循环系统,可持续合成氨,其原理如图所示。

①图中反应Ⅱ的化学方程式为
②反应Ⅲ中能量转化的方式是
(3)液氨可用作制冷剂,液氨气化时
| 共价键 | N-H | O=O | N≡N | O-H |
| 键能/kJ·mol-1 | 391 | 498 | 946 | 463 |
则反应 4NH3(g)+3O2(g)=2N2(g)+6H2O(g)的反应热△H=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】甲醇是一种重要的液体清洁燃料,工业上有多种制备甲醇的方法。
Ⅰ.利用H2O2来氧化CH4制取液体燃料甲醇。
(1)已知: 2CH4(g) + O2(g) = 2CH3OH(l) ∆H1
2H2O2(l)= O2(g) + 2H2O(l) △H2
则H2O2氧化CH4的热化学方程式为_______ ( 用∆H1和∆H2来表示∆H)。
(2)该方法采用的温度为70℃,不选择更低或更高温度的原因是_______ 。
Ⅱ.工业。上也常使用CO2和H2在高温条件下制备甲醇,发生的反应为
主反应: CO2(g)+ 3H2(g) CHOH(g)+ H2O(g) ∆H<0
CHOH(g)+ H2O(g) ∆H<0
副反应: CO2(g) +H2(g) CO(g) + H2O(g) ∆H<0
CO(g) + H2O(g) ∆H<0
起始投料为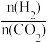 = 3。
= 3。
i.当反应只按主反应进行时,研究不同温度、压强下,平衡时甲醇的物质的量分数[x(CH3OH)]的变化规律,如下图所示。其中, x(CH3OH)-p图在t=250℃下测得, x(CH3OH)-t 图在p=5×105 Pa下测得。

(3)图中等压过程的曲线是_______ (填“a”或“b”),判断的依据是_______ 。
(4)当x(CH3OH)=0.10时,反应条件可能为_______ 或_______ 。
ii.当两个反应同时发生时,在T℃,恒压为1×106 Pa条件下达平衡时: x(CH3OH)=0.125,x(CO)=0.0625。
(5)该条件下CO2的总转化率=_______ ; 副反应的平衡常数Kp=_______ (保留3位有效数字,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
Ⅰ.利用H2O2来氧化CH4制取液体燃料甲醇。
(1)已知: 2CH4(g) + O2(g) = 2CH3OH(l) ∆H1
2H2O2(l)= O2(g) + 2H2O(l) △H2
则H2O2氧化CH4的热化学方程式为
(2)该方法采用的温度为70℃,不选择更低或更高温度的原因是
Ⅱ.工业。上也常使用CO2和H2在高温条件下制备甲醇,发生的反应为
主反应: CO2(g)+ 3H2(g)
 CHOH(g)+ H2O(g) ∆H<0
CHOH(g)+ H2O(g) ∆H<0副反应: CO2(g) +H2(g)
 CO(g) + H2O(g) ∆H<0
CO(g) + H2O(g) ∆H<0起始投料为
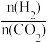 = 3。
= 3。i.当反应只按主反应进行时,研究不同温度、压强下,平衡时甲醇的物质的量分数[x(CH3OH)]的变化规律,如下图所示。其中, x(CH3OH)-p图在t=250℃下测得, x(CH3OH)-t 图在p=5×105 Pa下测得。

(3)图中等压过程的曲线是
(4)当x(CH3OH)=0.10时,反应条件可能为
ii.当两个反应同时发生时,在T℃,恒压为1×106 Pa条件下达平衡时: x(CH3OH)=0.125,x(CO)=0.0625。
(5)该条件下CO2的总转化率=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】 和
和 都是有毒气体,但新的研究表明,它们都是生命体系气体信号分子,在人体内具有重要的生理作用,
都是有毒气体,但新的研究表明,它们都是生命体系气体信号分子,在人体内具有重要的生理作用, 是高中阶段常见的气体。
是高中阶段常见的气体。
回答下列问题:
(1)反应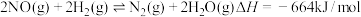 是联合硝酸工业减少污染物排放的重要反应。该反应分为三步完成(都是双分子反应,即反应物都只有两种分子),前两步反应如下:
是联合硝酸工业减少污染物排放的重要反应。该反应分为三步完成(都是双分子反应,即反应物都只有两种分子),前两步反应如下:
第1步:
第2步: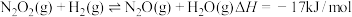
①写出第3步反应的热化学方程式:_______ 。
②基元反应 ,正反应速率
,正反应速率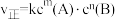 。
。
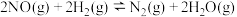 的正反应速率
的正反应速率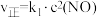 ,总反应速率
,总反应速率
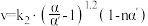 ,α是平衡转化率,α′是瞬时转化率,k、k1、k2均为速率常数,受温度影响,温度升高,速率常数增大。
,α是平衡转化率,α′是瞬时转化率,k、k1、k2均为速率常数,受温度影响,温度升高,速率常数增大。
I.复杂反应分为多步进行时,决定反应速率的是最_______ (填“快”或“慢”的一步,3步基元反应中,活化能最高的一步是第_______ 步。
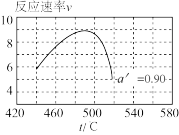
II.温度升高,α_______ (填“变大”、“变小”或“不变”),在α′=0.90时,一系列温度下的总反应速率—时间( )曲线如图所示,分析图中曲线先升后降的原因:
)曲线如图所示,分析图中曲线先升后降的原因:_______ 。
(2)用 冶炼
冶炼 的过程涉及如下反应:
的过程涉及如下反应:
反应I: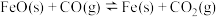
反应II:
①将 和
和 放入恒容密闭容器中,下列事实能说明反应I和II均已达到平衡状态的是
放入恒容密闭容器中,下列事实能说明反应I和II均已达到平衡状态的是_______ (填选项字母)。
A.容器内气体的密度不再发生变化 B. 的生成速率等于消耗速率。
的生成速率等于消耗速率。
C.容器内气体总压强不再发生变化 D.容器内 和
和 的物质的量相等
的物质的量相等
②在一个体积可变的容器中,维持温度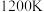 不变(此时反应I的分压平衡常数
不变(此时反应I的分压平衡常数 )。压缩容器体积,达到新平衡时,
)。压缩容器体积,达到新平衡时, 的分压
的分压_______ (填“变大”、“变小”或“不变”)。用压力传感器测得平衡时容器内压强为 ,计算反应II的分压平衡常数
,计算反应II的分压平衡常数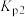 (写出计算过程):
(写出计算过程):_______ 。
 和
和 都是有毒气体,但新的研究表明,它们都是生命体系气体信号分子,在人体内具有重要的生理作用,
都是有毒气体,但新的研究表明,它们都是生命体系气体信号分子,在人体内具有重要的生理作用, 是高中阶段常见的气体。
是高中阶段常见的气体。回答下列问题:
(1)反应
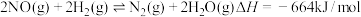 是联合硝酸工业减少污染物排放的重要反应。该反应分为三步完成(都是双分子反应,即反应物都只有两种分子),前两步反应如下:
是联合硝酸工业减少污染物排放的重要反应。该反应分为三步完成(都是双分子反应,即反应物都只有两种分子),前两步反应如下:第1步:

第2步:
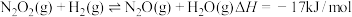
①写出第3步反应的热化学方程式:
②基元反应
 ,正反应速率
,正反应速率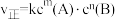 。
。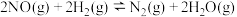 的正反应速率
的正反应速率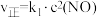 ,总反应速率
,总反应速率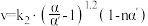 ,α是平衡转化率,α′是瞬时转化率,k、k1、k2均为速率常数,受温度影响,温度升高,速率常数增大。
,α是平衡转化率,α′是瞬时转化率,k、k1、k2均为速率常数,受温度影响,温度升高,速率常数增大。I.复杂反应分为多步进行时,决定反应速率的是最
II.温度升高,α
 )曲线如图所示,分析图中曲线先升后降的原因:
)曲线如图所示,分析图中曲线先升后降的原因:
(2)用
 冶炼
冶炼 的过程涉及如下反应:
的过程涉及如下反应:反应I:
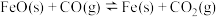
反应II:

①将
 和
和 放入恒容密闭容器中,下列事实能说明反应I和II均已达到平衡状态的是
放入恒容密闭容器中,下列事实能说明反应I和II均已达到平衡状态的是A.容器内气体的密度不再发生变化 B.
 的生成速率等于消耗速率。
的生成速率等于消耗速率。C.容器内气体总压强不再发生变化 D.容器内
 和
和 的物质的量相等
的物质的量相等②在一个体积可变的容器中,维持温度
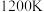 不变(此时反应I的分压平衡常数
不变(此时反应I的分压平衡常数 )。压缩容器体积,达到新平衡时,
)。压缩容器体积,达到新平衡时, 的分压
的分压 ,计算反应II的分压平衡常数
,计算反应II的分压平衡常数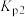 (写出计算过程):
(写出计算过程):
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】CH4、CH3OH(甲醇)既是重要的化工原料,又是未来重要的能源物质。
(1)将1.0molCH4和2.0molH2O(g)通入容积为2L的反应室,在一定条件下发生反应CH4(g)+H2O(g) CO(g)+3H2(g),测得在5min时达到平衡,CH4的平衡转化率为40%。则0~5min内,用H2O表示该反应的平均反应速率为
CO(g)+3H2(g),测得在5min时达到平衡,CH4的平衡转化率为40%。则0~5min内,用H2O表示该反应的平均反应速率为___ 。
(2)一定条件下,将1.0molCH4与2.0molH2O(g)充入密闭容器中发生反应CH4(g)+H2O(g) CH3OH(g)+H2(g),下列措施可以提高化学反应速率的是
CH3OH(g)+H2(g),下列措施可以提高化学反应速率的是___ (填选项序号)。
a.恒容条件下充入He b.增大体积
c.升高温度 d.投入更多的H2O(g)
(3)在恒容条件下进行反应CO2(g)+3H2(g) CH3OH(g)+H2O(g),则下列实验事实可以作为判断该反应达到平衡状态标志的是
CH3OH(g)+H2O(g),则下列实验事实可以作为判断该反应达到平衡状态标志的是___ (填选项序号)。
a.消耗1molCO2同时生成1molCH3OH
b.容器内压强保持不变
c.混合气体的密度保持不变
d.CH3OH(g)的浓度保持不变
(4)已知断裂几种化学键要吸收的能量如下:
16gCH4在O2中完全燃烧生成气态CO2和气态水时___ (填“吸收”或“放出”)约___ kJ热量。
(5)以KOH为电解质的甲醇—空气燃料电池是一种高效、轻污染的车载电池,其工作原理如图。回答下列问题:
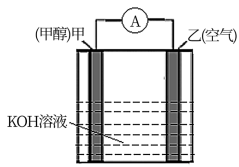
①该原电池的正极是___ (填“甲”或“乙”)
②负极的电极反应式___ 。
(1)将1.0molCH4和2.0molH2O(g)通入容积为2L的反应室,在一定条件下发生反应CH4(g)+H2O(g)
 CO(g)+3H2(g),测得在5min时达到平衡,CH4的平衡转化率为40%。则0~5min内,用H2O表示该反应的平均反应速率为
CO(g)+3H2(g),测得在5min时达到平衡,CH4的平衡转化率为40%。则0~5min内,用H2O表示该反应的平均反应速率为(2)一定条件下,将1.0molCH4与2.0molH2O(g)充入密闭容器中发生反应CH4(g)+H2O(g)
 CH3OH(g)+H2(g),下列措施可以提高化学反应速率的是
CH3OH(g)+H2(g),下列措施可以提高化学反应速率的是a.恒容条件下充入He b.增大体积
c.升高温度 d.投入更多的H2O(g)
(3)在恒容条件下进行反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),则下列实验事实可以作为判断该反应达到平衡状态标志的是
CH3OH(g)+H2O(g),则下列实验事实可以作为判断该反应达到平衡状态标志的是a.消耗1molCO2同时生成1molCH3OH
b.容器内压强保持不变
c.混合气体的密度保持不变
d.CH3OH(g)的浓度保持不变
(4)已知断裂几种化学键要吸收的能量如下:
| 化学键 | C—H | O=O | C=O | H—O |
| 断裂1mol键吸收的能量/kJ | 415 | 497 | 745 | 463 |
(5)以KOH为电解质的甲醇—空气燃料电池是一种高效、轻污染的车载电池,其工作原理如图。回答下列问题:

①该原电池的正极是
②负极的电极反应式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】CO是合成尿素、甲酸的原料。
(1)在100 kPa和T K下,由稳定单质生成1 mol化合物的焓变称为该物质在T K时的标准摩尔生成焓,用符号ΔHθ表示。已知石墨和一氧化碳的燃烧热分别为393.5 kJ·mol-1和283.0 kJ·mol-1,则CO(g)的ΔHθ=_________ 。
(2)合成尿素的反应:2NH3(g)+CO(g)⇌CO(NH2)2(g)+H2(g) ΔH=-81.0 kJ·mol-1;T℃时,在体积为2 L 的恒容密闭容器中,将2 mol的NH3和1 mol CO混合反应,5 min时,NH3的转化率为80%。则0~5 min平均反应速率为v(CO)=_________ 。
已知:
则:K1________ (填“>”或“<”)126.5;其判断理由是__________ 。
(3)若保持恒温恒容条件,将物质的量之和为3 mol的NH3和CO以不同的氨碳比进行反应,结果如图所示:

①若图中c表示平衡体系中尿素的体积分数,则a表示________ 的转化率。
②当 =
=________ 时,尿素含量最大;在该条件下,对于该反应既能增大反应速率又能使平衡正向移动的措施是_____ (写一种)。
(1)在100 kPa和T K下,由稳定单质生成1 mol化合物的焓变称为该物质在T K时的标准摩尔生成焓,用符号ΔHθ表示。已知石墨和一氧化碳的燃烧热分别为393.5 kJ·mol-1和283.0 kJ·mol-1,则CO(g)的ΔHθ=
(2)合成尿素的反应:2NH3(g)+CO(g)⇌CO(NH2)2(g)+H2(g) ΔH=-81.0 kJ·mol-1;T℃时,在体积为2 L 的恒容密闭容器中,将2 mol的NH3和1 mol CO混合反应,5 min时,NH3的转化率为80%。则0~5 min平均反应速率为v(CO)=
已知:
| 温度/K | 398 | 498 | … |
| 平衡常数(K) | 126.5 | K1 | … |
则:K1
(3)若保持恒温恒容条件,将物质的量之和为3 mol的NH3和CO以不同的氨碳比进行反应,结果如图所示:

①若图中c表示平衡体系中尿素的体积分数,则a表示
②当
 =
=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】2017年11月16日,国土资源部召开新闻发布会,宣布天然气水合物,即“可燃冰”新矿种获得国务院批准,成为我国第173个矿种。“可燃冰”主要成分的分子式是CH4·8H2O,一旦温度升高或压强降低,甲烷气就会逸出,固体水合物便趋于崩解。“可燃冰”将成为人类的后续能源。
(1)将320 g可燃冰释放的甲烷完全燃烧生成液态水时,可放出1 780.6 kJ的能量,则表示甲烷燃烧热的热化学方程式是__________________ 。
(2)CH4不仅是优质的气体燃料,还能利用它和CO2重整,发生反应:CO2(g)+CH4(g) 2CO(g)+2H2(g),获得合成气(主要成分为CO、H2),从而减少温室气体的排放。在一定条件下CH4的平衡转化率与温度及压强(单位:Pa)的关系如图所示。则y点:v(正)
2CO(g)+2H2(g),获得合成气(主要成分为CO、H2),从而减少温室气体的排放。在一定条件下CH4的平衡转化率与温度及压强(单位:Pa)的关系如图所示。则y点:v(正)____ (填“>”、“=”或“<”,下同)v(逆);压强:p1____ p2;该反应的ΔH____ 0。
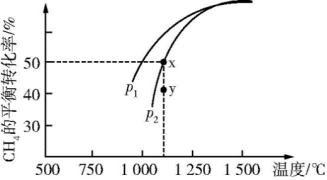
(3)在恒温、p2下,在一容积可变的容器中,达到平衡状态x时四种气体的物质的量均为1 mol,若此时再充入四种气体各1 mol,则平衡____ (填“向左”、“向右”或“不”)移动。
(4)一定条件下,CH4还可与NO2反应,改善雾霾天气,其化学方程式为CH4(g)+2NO2(g) CO2(g)+2H2O(g)+N2(g),在恒温恒容下,下列可以判断该反应达到平衡状态的是
CO2(g)+2H2O(g)+N2(g),在恒温恒容下,下列可以判断该反应达到平衡状态的是____ (填序号)。
a.v逆(N2)=2v正(H2O)
b.混合气体的密度不再变化
c.混合气体的物质的量不再变化
d.单位时间内有1 mol NO2消耗同时消耗1 mol CO2
e.混合气体的平均相对分子质量不变
f.CH4与CO2的物质的量之比不再发生变化
(5)在恒温恒容下,使1 mol CH4(g)与2 mol NO2反应,达平衡后,再往反应器中分别充入下列气体,可以使CH4(g)+2NO2(g) CO2(g)+2H2O(g)+N2(g)中NO2转化率增大的是
CO2(g)+2H2O(g)+N2(g)中NO2转化率增大的是____ (填序号)。
A.CH4 B.CO2 C.物质的量之比为1∶2的CH4与NO2 D.N2
(6)CH4还可以运用到电化学中,某课外小组用CH4为燃料,空气为氧化剂,稀土金属材料作电极,电浮选凝聚法处理污水,设计如图所示装置。则甲烷燃料电池的总反应式为______ 。为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(如图),A物质的化学式是______ 。
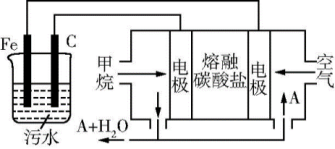
(1)将320 g可燃冰释放的甲烷完全燃烧生成液态水时,可放出1 780.6 kJ的能量,则表示甲烷燃烧热的热化学方程式是
(2)CH4不仅是优质的气体燃料,还能利用它和CO2重整,发生反应:CO2(g)+CH4(g)
 2CO(g)+2H2(g),获得合成气(主要成分为CO、H2),从而减少温室气体的排放。在一定条件下CH4的平衡转化率与温度及压强(单位:Pa)的关系如图所示。则y点:v(正)
2CO(g)+2H2(g),获得合成气(主要成分为CO、H2),从而减少温室气体的排放。在一定条件下CH4的平衡转化率与温度及压强(单位:Pa)的关系如图所示。则y点:v(正)
(3)在恒温、p2下,在一容积可变的容器中,达到平衡状态x时四种气体的物质的量均为1 mol,若此时再充入四种气体各1 mol,则平衡
(4)一定条件下,CH4还可与NO2反应,改善雾霾天气,其化学方程式为CH4(g)+2NO2(g)
 CO2(g)+2H2O(g)+N2(g),在恒温恒容下,下列可以判断该反应达到平衡状态的是
CO2(g)+2H2O(g)+N2(g),在恒温恒容下,下列可以判断该反应达到平衡状态的是a.v逆(N2)=2v正(H2O)
b.混合气体的密度不再变化
c.混合气体的物质的量不再变化
d.单位时间内有1 mol NO2消耗同时消耗1 mol CO2
e.混合气体的平均相对分子质量不变
f.CH4与CO2的物质的量之比不再发生变化
(5)在恒温恒容下,使1 mol CH4(g)与2 mol NO2反应,达平衡后,再往反应器中分别充入下列气体,可以使CH4(g)+2NO2(g)
 CO2(g)+2H2O(g)+N2(g)中NO2转化率增大的是
CO2(g)+2H2O(g)+N2(g)中NO2转化率增大的是A.CH4 B.CO2 C.物质的量之比为1∶2的CH4与NO2 D.N2
(6)CH4还可以运用到电化学中,某课外小组用CH4为燃料,空气为氧化剂,稀土金属材料作电极,电浮选凝聚法处理污水,设计如图所示装置。则甲烷燃料电池的总反应式为

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率,请回答下列问题。
(1) 工业合成氨反应N2+3H2 2NH3是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知1mol N2完全反应生成NH3可放出92kJ热量。如果将10 mol N2和足量H2混合,使其充分反应,放出的热量
2NH3是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知1mol N2完全反应生成NH3可放出92kJ热量。如果将10 mol N2和足量H2混合,使其充分反应,放出的热量___________ (填“大于”“小于”或“等于”)920 kJ。
(2) 实验室模拟工业合成氨时,在容积为2L的密闭容器内,反应经过10 min后,生成10 mol NH3。
①用N2表示的化学反应速率为___________ 。
②一定条件下,能说明该反应进行到最大限度的是___________ (填序号)
a.N2的转化率达到最大值
b.N2、H2和NH3的体积分数之比为1:3:2
c.体系内气体的密度保持不变
d.体系内各物质的浓度保持不变
(3) 用CH4和O2组合形成的质子交换膜燃料电池的结构如图所示:
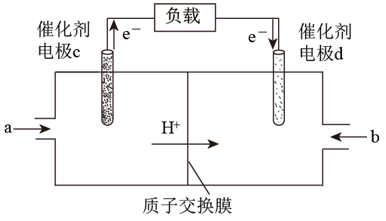
①电极d是___________ (填“正极”或“负极”),电极c的电极反应式为___________ 。
②若线路中转移2mol电子,则该燃料电池理论上消耗的O2在标准状况下的体积为___________ L。
(1) 工业合成氨反应N2+3H2
 2NH3是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知1mol N2完全反应生成NH3可放出92kJ热量。如果将10 mol N2和足量H2混合,使其充分反应,放出的热量
2NH3是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知1mol N2完全反应生成NH3可放出92kJ热量。如果将10 mol N2和足量H2混合,使其充分反应,放出的热量(2) 实验室模拟工业合成氨时,在容积为2L的密闭容器内,反应经过10 min后,生成10 mol NH3。
①用N2表示的化学反应速率为
②一定条件下,能说明该反应进行到最大限度的是
a.N2的转化率达到最大值
b.N2、H2和NH3的体积分数之比为1:3:2
c.体系内气体的密度保持不变
d.体系内各物质的浓度保持不变
(3) 用CH4和O2组合形成的质子交换膜燃料电池的结构如图所示:

①电极d是
②若线路中转移2mol电子,则该燃料电池理论上消耗的O2在标准状况下的体积为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】合理利用资源,降低碳的排放,实施低碳经济是今后经济生活主流。
(1)科学家致力于二氧化碳的“组合转化”技术研究,如将H2和CO2以4∶1比例混合通入反应器,适当条件下反应可获得一种能源。完成以下化学方程式:4H2+CO2
________ +2H2O。
(2)汽车尾气中的CO、NOx在适宜温度下采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。写出NO被CO还原的化学方程式:_______________ 。
(3)工业尾气中氮的氧化物常采用碱液吸收法处理。NO与NO2按物质的量之比1∶1被足量KOH溶液完全吸收后只得到一种钾盐,该钾盐的化学式是______________ 。
(4)CO2合成生产燃料甲醇(CH3OH)是碳减排的新方向。进行如下实验:某温度下在1 L的密闭容器中,充2 mol CO2和6 mol H2,发生:CO2(g)+3H2(g ) CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
①能判断该反应已达化学反应限度标志的是______________ (填字母)。
a.CO2百分含量保持不变
b.容器中H2浓度与CO2浓度之比为3:1
c.混合气体的平均相对分子质量保持不变
d.容器中混合气体的质量保持不变
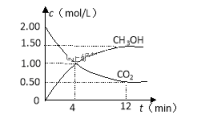
②现测得CO2和CH3OH(g)的浓度随时间变化如图所示。从反应开始到平衡,氢气的平均反应速率v (H2)=______ mol/(L • min),容器中起始的压强与平衡时的压强之比为___________ 。
(1)科学家致力于二氧化碳的“组合转化”技术研究,如将H2和CO2以4∶1比例混合通入反应器,适当条件下反应可获得一种能源。完成以下化学方程式:4H2+CO2

(2)汽车尾气中的CO、NOx在适宜温度下采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。写出NO被CO还原的化学方程式:
(3)工业尾气中氮的氧化物常采用碱液吸收法处理。NO与NO2按物质的量之比1∶1被足量KOH溶液完全吸收后只得到一种钾盐,该钾盐的化学式是
(4)CO2合成生产燃料甲醇(CH3OH)是碳减排的新方向。进行如下实验:某温度下在1 L的密闭容器中,充2 mol CO2和6 mol H2,发生:CO2(g)+3H2(g )
 CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。①能判断该反应已达化学反应限度标志的是
a.CO2百分含量保持不变
b.容器中H2浓度与CO2浓度之比为3:1
c.混合气体的平均相对分子质量保持不变
d.容器中混合气体的质量保持不变
②现测得CO2和CH3OH(g)的浓度随时间变化如图所示。从反应开始到平衡,氢气的平均反应速率v (H2)=

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在 稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
①哪一时间段反应速率最大_______ min(填“0~1”“1~2”“2~3”“3~4”或“4~5”),原因是_______ 。
②求3~4min时间段以盐酸的浓度变化来表示的该反应速率_______ (设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是_______(填字母)。
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。
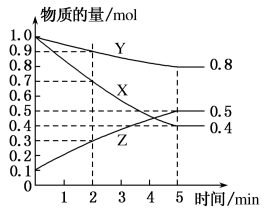
①该反应的化学方程式是_______ 。
②该反应达到平衡状态的标志是_______ (填字母)。
A.Y的体积分数在混合气体中保持不变
B.X、Y的反应速率比为
C.容器内气体压强保持不变
D.容器内气体的总质量保持不变
E.生成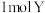 的同时消耗
的同时消耗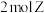
③2min内Y的转化率为_______ 。
(4)某兴趣小组为研究原电池原理,设计如图装置。
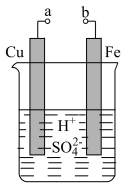
a和b用导线连接,Fe电极的电极反应式为_______ ,Cu极发生_______ 反应,溶液中 移向
移向_______ (填“Cu”或“Fe”)极。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在
 稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):| 时间/min | 1 | 2 | 3 | 4 | 5 |
| 氢气体积/mL(标准状况) | 100 | 240 | 464 | 576 | 620 |
①哪一时间段反应速率最大
②求3~4min时间段以盐酸的浓度变化来表示的该反应速率
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是_______(填字母)。
| A.蒸馏水 | B.KCl溶液 | C. 溶液 溶液 | D. 溶液 溶液 |

①该反应的化学方程式是
②该反应达到平衡状态的标志是
A.Y的体积分数在混合气体中保持不变
B.X、Y的反应速率比为

C.容器内气体压强保持不变
D.容器内气体的总质量保持不变
E.生成
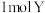 的同时消耗
的同时消耗
③2min内Y的转化率为
(4)某兴趣小组为研究原电池原理,设计如图装置。

a和b用导线连接,Fe电极的电极反应式为
 移向
移向
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】高铁酸钾(K2FeO4)是一种绿色氧化剂,在许多领域展现出广阔的应用前景。
(1)湿法制备K2FeO4:在KOH溶液中,用KClO直接氧化Fe(NO3)3即可制得K2FeO4。该反应的离子方程式为_________________________________ 。
(2)测定K2FeO4:样品纯度:i.称取样品mg,加入到盛有过量碱性亚铬酸钠[NaCr(OH)4]溶液的锥形瓶中充分反应;ii.将所得铬酸钠(Na2CrO4)溶液酸化;iii.在所得Na2Cr2O7溶液中加入8—9滴二苯胺磺酸钠溶液作指示剂,用c mol·L-1(NH4)2Fe(SO4)2溶液滴定至终点,消耗溶液体积为V mL。整个过程中发生的反应如下:
ⅰ.___ Cr(OH)4-+___ FeO42- +__ ( ) =__ Fe(OH)3(H2O)3↓+__ CrO42-+__ ( )
ⅱ.2CrO42- + 2H+=Cr2O72- + H2O;
ⅲ.Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O
①配平方程式i;
②利用上述数据计算该样品的纯度为________________ (用含字母的代数式表示)。
(3)高铁酸盐在水溶液中有四种含铁形体。25℃时,它们的物质的量分数随pH的变化如图所示:
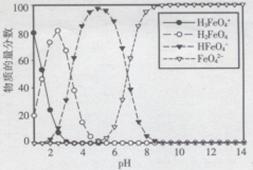
①pH=2.2时,溶液中主要含铁形体浓度的大小关系为________ ;为获得尽可能纯净的高铁酸盐,pH应控制在______________ 。
②已知H3FeO4+的电离常数分别为: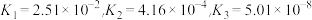
当PH=4时,溶液中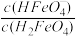 =
=___________ 。
③向pH=6的高铁酸盐溶液中加入KOH溶液,发生反应的离子方程式为______________ 。
(4)某新型电池以金属锂为负极,K2FeO4为正极,溶有LiPF6的有机溶剂为电解质。工作时Li+通过电解质迁移入K2FeO4晶体中,生成K2Li2FeO4。该电池的正极反应式为______________ .
(1)湿法制备K2FeO4:在KOH溶液中,用KClO直接氧化Fe(NO3)3即可制得K2FeO4。该反应的离子方程式为
(2)测定K2FeO4:样品纯度:i.称取样品mg,加入到盛有过量碱性亚铬酸钠[NaCr(OH)4]溶液的锥形瓶中充分反应;ii.将所得铬酸钠(Na2CrO4)溶液酸化;iii.在所得Na2Cr2O7溶液中加入8—9滴二苯胺磺酸钠溶液作指示剂,用c mol·L-1(NH4)2Fe(SO4)2溶液滴定至终点,消耗溶液体积为V mL。整个过程中发生的反应如下:
ⅰ.
ⅱ.2CrO42- + 2H+=Cr2O72- + H2O;
ⅲ.Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O
①配平方程式i;
②利用上述数据计算该样品的纯度为
(3)高铁酸盐在水溶液中有四种含铁形体。25℃时,它们的物质的量分数随pH的变化如图所示:

①pH=2.2时,溶液中主要含铁形体浓度的大小关系为
②已知H3FeO4+的电离常数分别为:
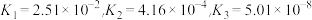
当PH=4时,溶液中
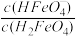 =
=③向pH=6的高铁酸盐溶液中加入KOH溶液,发生反应的离子方程式为
(4)某新型电池以金属锂为负极,K2FeO4为正极,溶有LiPF6的有机溶剂为电解质。工作时Li+通过电解质迁移入K2FeO4晶体中,生成K2Li2FeO4。该电池的正极反应式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】我国科学家开发的光催化剂硒化锌(ZnSe,不溶于水),可实现人工光合作用,利用CO2制备高附加值的产品,某小组设计一种以锌矿(主要成分是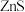 ,含FeS2、CuS、NiS、SiO2等)为原料制备ZnSe的工艺流程如图。
,含FeS2、CuS、NiS、SiO2等)为原料制备ZnSe的工艺流程如图。
已知:①“堆浸液”中含ZnSO4、FeSO4、CuSO4、NiSO4。
②常温下,Ksp(CuS)≈1×10-36,Ksp(ZnS)≈1×10-25
③pH过高时,FeOOH沉淀会转化成胶体。
④Zn(OH)2是两性氢氧化物。
回答下列问题:
(1)下列有关“堆浸”的说法正确的是____ (填标号); “堆浸”过程中ZnS转化成ZnSO4的化学方程式为____ 。
A.将锌矿粉碎过筛,有利于加快“堆浸”的速率
B.“堆浸”时温度越高越好,温度高有利于加快“堆浸”的速率
C.“堆浸”时加入大量的硫酸
(2)“除铁”最佳pH为3.0,如果pH过高,会导致溶液中Zn2+的含量降低,其主要原因:
①部分Zn2+转化成Zn(OH)2,②____ 。
(3)分析“除铜”时加入ZnS的原因:_____ 。
(4)若以“除镍”时发生的化学反应为原理设计原电池,则该原电池中在负极放电的物质是____ (填物质名称),正极上的电极反应式为_____ 。
(5)“合成”ZnSe后,从反应体系中分离出ZnSe的操作依次为____ 、洗涤、干燥。
(6)传统方法通常用“灼烧”法将锌矿转化成金属氧化物,再进行酸浸等步骤来制备ZnSe,新工艺采用细菌“堆浸”,与传统的“灼烧”法对比,从环保角度分析采用细菌“堆浸”的优点是____ 。
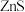 ,含FeS2、CuS、NiS、SiO2等)为原料制备ZnSe的工艺流程如图。
,含FeS2、CuS、NiS、SiO2等)为原料制备ZnSe的工艺流程如图。
已知:①“堆浸液”中含ZnSO4、FeSO4、CuSO4、NiSO4。
②常温下,Ksp(CuS)≈1×10-36,Ksp(ZnS)≈1×10-25
③pH过高时,FeOOH沉淀会转化成胶体。
④Zn(OH)2是两性氢氧化物。
回答下列问题:
(1)下列有关“堆浸”的说法正确的是
A.将锌矿粉碎过筛,有利于加快“堆浸”的速率
B.“堆浸”时温度越高越好,温度高有利于加快“堆浸”的速率
C.“堆浸”时加入大量的硫酸
(2)“除铁”最佳pH为3.0,如果pH过高,会导致溶液中Zn2+的含量降低,其主要原因:
①部分Zn2+转化成Zn(OH)2,②
(3)分析“除铜”时加入ZnS的原因:
(4)若以“除镍”时发生的化学反应为原理设计原电池,则该原电池中在负极放电的物质是
(5)“合成”ZnSe后,从反应体系中分离出ZnSe的操作依次为
(6)传统方法通常用“灼烧”法将锌矿转化成金属氧化物,再进行酸浸等步骤来制备ZnSe,新工艺采用细菌“堆浸”,与传统的“灼烧”法对比,从环保角度分析采用细菌“堆浸”的优点是
您最近一年使用:0次



