硼砂是含结晶水的四硼酸钠。以硼砂为原料,可以得到BF3、BN和硼酸等重要化合物,请根据下列信息回答有关问题:
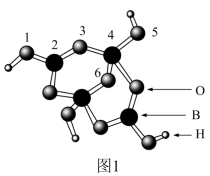
(1)硼砂中阴离子Xm-(含B、O、H三种元素)的球棍模型如图1所示,则在Xm-中,2号硼原子的杂化类型为_______ ;4号硼原子参与形成的化学键有_______ ;m=_______ (填数字)。
(2)BN中B的化合价为_______ ,请解释原因:_______ 。
(3)BF3和过量NaF作用可生成NaBF4,BF 的立体构型为
的立体构型为_______ ;NaBF4的电子式为_______ 。
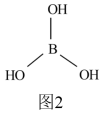
(4)硼酸[B(OH)3]结构如图2所示,分子中一个B原子与3个羟基相连,硼酸为一元弱酸,与过量NaOH反应生成[B(OH)4]-,请用化学键有关知识分析[B(OH)4]-的形成原因:_______
(1)硼砂中阴离子Xm-(含B、O、H三种元素)的球棍模型如图1所示,则在Xm-中,2号硼原子的杂化类型为

(2)BN中B的化合价为
(3)BF3和过量NaF作用可生成NaBF4,BF
 的立体构型为
的立体构型为(4)硼酸[B(OH)3]结构如图2所示,分子中一个B原子与3个羟基相连,硼酸为一元弱酸,与过量NaOH反应生成[B(OH)4]-,请用化学键有关知识分析[B(OH)4]-的形成原因:

更新时间:2022-08-16 16:59:13
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L层上有2对成对电子;E+ 原子核外有3层电子且M层3d轨道电子全充满。请回答:
(1)E元素基态原子的电子排布式为_________ 。
(2)B、C、D三种元素的第一电离能数值由小到大 的顺序为____ (填元素符号)
(3)D元素与氟元素相比,电负性:D______ F(填“>”、“=”或“<”),下列表述中能证明这一事实的是_______ (填选项序号)
A.常温下氟气的颜色比D单质的颜色深
B.氟气与D的氢化物剧烈反应,产生D的单质
C.氟与D形成的化合物中D元素呈正价态
D.比较两元素的单质与氢气化合时得电子的数目
(4)只含C、A两元素的离子化合物,其电子式为______ ,它的晶体中含有多种化学键,但一定不含有的化学键是______ (填选项序号)。
A.极性键 B.非极性键 C.离子键 D.金属键
(5)B2A4是重要的基本石油化工原料。lmolB2A4分子中含 键
键______ mol。
(1)E元素基态原子的电子排布式为
(2)B、C、D三种元素的第一电离能数值由
(3)D元素与氟元素相比,电负性:D
A.常温下氟气的颜色比D单质的颜色深
B.氟气与D的氢化物剧烈反应,产生D的单质
C.氟与D形成的化合物中D元素呈正价态
D.比较两元素的单质与氢气化合时得电子的数目
(4)只含C、A两元素的离子化合物,其电子式为
A.极性键 B.非极性键 C.离子键 D.金属键
(5)B2A4是重要的基本石油化工原料。lmolB2A4分子中含
 键
键
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】T、X、Y、Z、Q、R、W为周期表前四周期元素,原子序数依次递增。已知:
①W的原子序数为29,其余的均为短周期主族元素;
②T原子所处的周期数、族序数分别与其原子序数相等;
③X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同;
④Z的基态原子价电子排布为ns2npn+2;
⑤在该元素所在周期中,Q的基态原子的第一电离能最小;
⑥R的单质常温常压下是气体,其基态原子的M层上有1个未成对的p电子;
(1)X、Y、Q三种元素的电负性由大到小的顺序是______________ (用元素符号表示)。
(2)Y的氢化物分子间能形成氢键,R的氢化物分子间不易形成氢键,原因是_____________ 。
(3)W的基态原子的外围电子排布式为_____________ ,W形成的晶体的堆积方式为___________ 。
(4)T、X、Z三种元素组成的一种化合物M是新装修居室中常见的有害气体,它的分子式为XT2Z,分子空间构型为平面三角形,则该分子中中心原子采取__________ 杂化,1molM分子中σ键和π键的个数比为_____________ 。
(5)X与Y原子结合形成的X3Y4晶体,其晶体结构与金刚石类似,但硬度比金刚石大,请解释原因是_________________ 。
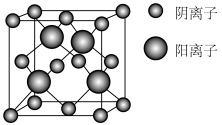
(6)WR的晶胞结构如图所示,阴离子周围最近的阳离子有____ 个;WR晶体的密度为ag·cm-3,则晶胞的体积是______ (只要求列出计算式)。
①W的原子序数为29,其余的均为短周期主族元素;
②T原子所处的周期数、族序数分别与其原子序数相等;
③X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同;
④Z的基态原子价电子排布为ns2npn+2;
⑤在该元素所在周期中,Q的基态原子的第一电离能最小;
⑥R的单质常温常压下是气体,其基态原子的M层上有1个未成对的p电子;
(1)X、Y、Q三种元素的电负性由大到小的顺序是
(2)Y的氢化物分子间能形成氢键,R的氢化物分子间不易形成氢键,原因是
(3)W的基态原子的外围电子排布式为
(4)T、X、Z三种元素组成的一种化合物M是新装修居室中常见的有害气体,它的分子式为XT2Z,分子空间构型为平面三角形,则该分子中中心原子采取
(5)X与Y原子结合形成的X3Y4晶体,其晶体结构与金刚石类似,但硬度比金刚石大,请解释原因是
(6)WR的晶胞结构如图所示,阴离子周围最近的阳离子有

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。
已知:①CuCl可以由CuCl2用适当的还原剂如SO2、SnCl2等还原制得:2Cu2++ 2C1-+SO2+2H2O 2CuCl↓+4H++
2CuCl↓+4H++ ,2CuCl2+SnCl2 =2CuCl↓+SnCl4
,2CuCl2+SnCl2 =2CuCl↓+SnCl4
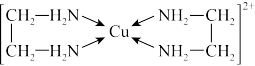
②CuCl2溶液与乙二胺(H2N-CH2CH2-NH2)可形成配离子:
请回答下列问题:
(1)基态Cu原子的核外电子排布式为_______ , H、 N、O三种元素的电负性由大到小的顺序是_______ 。
(2)SO2分子的空间构型为_______ ,与SnCl4互为等电子体的一种离子的符号为_______ 。
(3)乙二胺分子中氮原子轨道的杂化类型为_______ , 乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是_______ 。
(4)②中所形成的配离子中不含有的化学键类型有_______ (填标号)。
a.配位键 b.极性键 c.离子键 d.非极性键
(5)CuCl的晶胞结构如图所示。若晶胞边长为a cm,阿伏加德罗常数为NA mol-1,则该晶体的密度_______ g·cm-3。

已知:①CuCl可以由CuCl2用适当的还原剂如SO2、SnCl2等还原制得:2Cu2++ 2C1-+SO2+2H2O
 2CuCl↓+4H++
2CuCl↓+4H++ ,2CuCl2+SnCl2 =2CuCl↓+SnCl4
,2CuCl2+SnCl2 =2CuCl↓+SnCl4②CuCl2溶液与乙二胺(H2N-CH2CH2-NH2)可形成配离子:

请回答下列问题:
(1)基态Cu原子的核外电子排布式为
(2)SO2分子的空间构型为
(3)乙二胺分子中氮原子轨道的杂化类型为
(4)②中所形成的配离子中不含有的化学键类型有
a.配位键 b.极性键 c.离子键 d.非极性键
(5)CuCl的晶胞结构如图所示。若晶胞边长为a cm,阿伏加德罗常数为NA mol-1,则该晶体的密度

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】根据核外电子的排布特点推断元素的性质:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其基态原子的电子排布图为_____ ,在周期表中位于___ 区。
(2) B元素基态原子的M层全充满,N层没有成对电子且只有一个未成对电子,B的基态原子的价层电子排布式为_______ 。
(3)请利用电子排布的相关知识分析:稳定性:Fe3+______ Fe2+(填>或< ),原因___________ ,第一电离能:Mg____ Al(填>或< )原因__________ 。
(4) 有以下物质:①H2 ②N2 ③CO2 ④N2H4⑤H2O2 ⑥HCN(H—C≡N);只有σ键的是______ ;既有σ键又有π键的是__________ ;含有由两个原子的s轨道重叠形成的σ键的是_____ ;含有由一个原子的s轨道与另一个原子的p轨道重叠形成的σ键的是______ ;
(5) 通过 (3)的解答,请归纳基态原子核外电子排布除了符合构造原理外,泡利原理、洪特规则外,还有哪些结构稳定__________ 。
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其基态原子的电子排布图为
(2) B元素基态原子的M层全充满,N层没有成对电子且只有一个未成对电子,B的基态原子的价层电子排布式为
(3)请利用电子排布的相关知识分析:稳定性:Fe3+
(4) 有以下物质:①H2 ②N2 ③CO2 ④N2H4⑤H2O2 ⑥HCN(H—C≡N);只有σ键的是
(5) 通过 (3)的解答,请归纳基态原子核外电子排布除了符合构造原理外,泡利原理、洪特规则外,还有哪些结构稳定
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】A、B、C、D、E是元素周期表中五种常见元素,其原子序数依次增大。详细信息见表:
请回答下列问题:
(1)D的价电子排布式可表示为__ 。
(2)BC3-的空间构型为__ (用文字描述)。
(3)根据等电子原理,AC分子的结构式为__ 。
(4)1molAC2中σ键、π键数目之比为__ 。
(5)A、B、C的第一电离能由大到小顺序为__ 。
(6)E为__ 堆积金属,已知E原子的半径为acm,阿伏加 德罗常数的值为NA,则E晶体的密度是__ g·cm-3。(列出算式即可)。
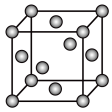
(7)E晶胞结构如图所示,E晶体中每个E原子周围距离最近的E原子数目为__ ;E2S为半导体材料,在其立方晶胞内部有4个S原子,其余S原子位于面心和顶点,则该晶胞中有__ 个E原子。
(8)将E单质的粉末加入NH3的浓溶液中,通入O2,充分反应后溶液呈深蓝色,写出该反应的离子方程式__ 。
| ① | A的一种核素在考古时常用来鉴定一些文物的年代 |
| ② | B的氧化物是导致光化学烟雾的主要物质之一 |
| ③ | C的某一种单质是空气的主要成分之一 |
| ④ | D的基态原子核外有6个原子轨道处于半充满状态 |
| ⑤ | E能形成红色的E2O和黑色的EO两种氧化物 |
(1)D的价电子排布式可表示为
(2)BC3-的空间构型为
(3)根据等电子原理,AC分子的结构式为
(4)1molAC2中σ键、π键数目之比为
(5)A、B、C的第一电离能由大到小顺序为
(6)E为
(7)E晶胞结构如图所示,E晶体中每个E原子周围距离最近的E原子数目为

(8)将E单质的粉末加入NH3的浓溶液中,通入O2,充分反应后溶液呈深蓝色,写出该反应的离子方程式
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】稀土元素是指元素周期表中原子序数为57到71的15种镧系元素,以及与镧系元素化学性质相似的钪(Sc)和钇(Y)共17种元素。稀土元素有“工业维生素”的美称,如今已成为极其重要的战略资源。
(1)钪(Sc)为21号元素,位于周期表的_____ 区,基态原子价电子排布图为_______ 。
(2)离子化合物Na3[Sc(OH)6]中,存在的化学键除离子键外还有_______ 。
(3)Sm(钐)的单质与l,2-二碘乙烷可发生如下反应:m+ICH2CH2I→SmI2+CH2=CH2。ICH2CH2I中碳原子杂化轨道类型为______ ,1molCH2=CH2中含有的σ键数目为______ 。常温下l,2-二碘乙烷为液体而乙烷为气体,其主要原因是__________ 。
(4)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中Pr(镨)原子位于面心和顶点。则PrO2(二氧化镨)的晶胞中有________ 个氧原子。
(5)Ce(铈)单质为面心立方晶体,其晶胞参数a=516pm。晶胞中Ce(铈)原子的配位数为_______ ,列式表示Ce(铈)单质的密度:________ g/cm3(用NA表示阿伏伽德罗常数的值,不必计算出结果)
(1)钪(Sc)为21号元素,位于周期表的
(2)离子化合物Na3[Sc(OH)6]中,存在的化学键除离子键外还有
(3)Sm(钐)的单质与l,2-二碘乙烷可发生如下反应:m+ICH2CH2I→SmI2+CH2=CH2。ICH2CH2I中碳原子杂化轨道类型为
(4)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中Pr(镨)原子位于面心和顶点。则PrO2(二氧化镨)的晶胞中有
(5)Ce(铈)单质为面心立方晶体,其晶胞参数a=516pm。晶胞中Ce(铈)原子的配位数为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】决定物质性质的重要因素是物质结构。请回答下列问题。
(1)CH 、·CH3、CH
、·CH3、CH 都是重要的有机反应中间体,有关它们的说法正确的是_____
都是重要的有机反应中间体,有关它们的说法正确的是_____
(2)在极性分子中,正电荷重心同负电荷重心间的距离称偶极长,通常用d表示。极性分子的极性强弱同偶极长和正(或负)电荷重心的电量(q)有关,一般用偶极矩(μ)来衡量。分子的偶极矩定义为偶极长和偶极上一端电荷电量的乘积,即μ=d·q。试回答以下问题:
①HCl、CS2、H2S、SO2四种分子中μ=0的是____________________ ;
②实验测得:μPF3=1.03、μBCl3=0。由此可知,PF3分子是_____ 构型,BCl3分子是_____ 构型。
(3)对物质的磁性研究表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是__________________ 。
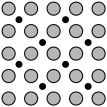
(4)利用光电子能谱证实:在洁净铁(可用于合成氨反应的催化剂)的表面上存在氮原子,右图为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子)。则在单层晶面上N/Fe原子数之比为________________ 。
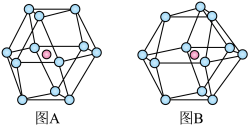
(5)金属晶体的结构可用等径圆球的密堆积来描述,在等径圆球的最密堆积的各种形式中,立方最密堆积和六方最密堆积最为重要,请指出下图中哪个为立方最密堆积______ (填“A”或“B”)
(1)CH
 、·CH3、CH
、·CH3、CH 都是重要的有机反应中间体,有关它们的说法正确的是_____
都是重要的有机反应中间体,有关它们的说法正确的是_____| A.它们均由甲烷去掉一个氢原子所得 |
| B.它们的空间构型相同,碳原子均可以采取sp2杂化 |
C.CH 与NH3、H3O+互为等电子体,几何构型均为三角锥形 与NH3、H3O+互为等电子体,几何构型均为三角锥形 |
D.CH 中的碳原子采取sp3杂化,所有原子均共面 中的碳原子采取sp3杂化,所有原子均共面 |
①HCl、CS2、H2S、SO2四种分子中μ=0的是
②实验测得:μPF3=1.03、μBCl3=0。由此可知,PF3分子是
(3)对物质的磁性研究表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是
(4)利用光电子能谱证实:在洁净铁(可用于合成氨反应的催化剂)的表面上存在氮原子,右图为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子)。则在单层晶面上N/Fe原子数之比为

(5)金属晶体的结构可用等径圆球的密堆积来描述,在等径圆球的最密堆积的各种形式中,立方最密堆积和六方最密堆积最为重要,请指出下图中哪个为立方最密堆积

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】我国科学家研究发现AgCrS2 (AMX2家族成员之一,A为一价金属,M为三价金属,X为氧族元素)在室温下具有超离子行为。回答下列问题:
(1)基态铬原子的价电子排布式为___________ ;基态硫原子核外电子的空间运动状态有___________ 种。
(2)同周期元素Si、P、S的第一电离能由大到小的顺序为___________ (用元素符号表示),O、S为同主族元素, H2O的沸点比H2S高的原因是___________ 。
(3)硫元素能形成多种微粒如H2S、SO2、SO3、 、
、 等。SO2的立体构型为
等。SO2的立体构型为___________ , 的中心原子的杂化类型是
的中心原子的杂化类型是___________ 。
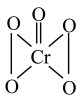
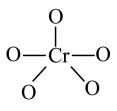
(4)CrO5中Cr元素化合价为+6价,常温下呈蓝色,则其结构式可能为___________ (填标号)。
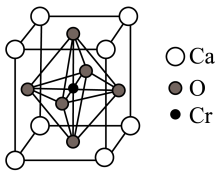
(5)某含铬化合物立方晶胞如图所示。该晶体的化学式为___________ ;与Cr最近的氧原子的个数为___________ ;Ca和Cr的最近距离为a nm,设NA为阿伏加德罗常数的值,则该晶体密度为__________ (填含a、NA的表达式)g·cm-3。
(1)基态铬原子的价电子排布式为
(2)同周期元素Si、P、S的第一电离能由大到小的顺序为
(3)硫元素能形成多种微粒如H2S、SO2、SO3、
 、
、 等。SO2的立体构型为
等。SO2的立体构型为 的中心原子的杂化类型是
的中心原子的杂化类型是(4)CrO5中Cr元素化合价为+6价,常温下呈蓝色,则其结构式可能为
 |  |  |
| A | B | C |

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。AC2是非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2:1,三个氯离子在外界。根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为_________ ;
(2)B的氢化物的分子立体构型是_____ ;其中心原子采取_______ 杂化。
(3)写出化合物AC2的电子式为_______ ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为______ 。
(4)E的核外电子排布式是______ ,ECl3形成的配合物的化学式为_____
(1)A、B、C的第一电离能由小到大的顺序为
(2)B的氢化物的分子立体构型是
(3)写出化合物AC2的电子式为
(4)E的核外电子排布式是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】氟及其化合物用途非常广泛。回答下列问题:
(1)聚四氟乙烯是一种准晶体,该晶体是一种无平移周期序,但有严格准周期位置序的独特晶体。可通过___ 方法区分晶体、准晶体和非晶体。
(2)K元素的基态原子的电子填充于___ 个不同的能级。
(3)[H2F]+[SbF6]-(氟酸锑)是一种超强酸,存在[H2F]+,该离子的空间构型为___ ,写出一种与[H2F]+具有相同空间构型和键合形式的阴离子是___ 。
(4)NH4F(氟化铵)可作为玻璃蚀刻剂、防腐剂、消毒剂等。NH4+的中心原子的杂化类型是___ ;氟化铵中存在___ (填字母)。
A.离子键 B.σ键 C.π键 D.氢键
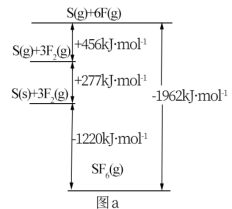
(5)SbF6被广泛用作高压电气设备绝缘介质。SbF6是一种共价化合物,可通过类似Born Haber循环能量构建能量图(见图a)计算相关键能。则F—F键的键能为
Haber循环能量构建能量图(见图a)计算相关键能。则F—F键的键能为___ kJ·mol-1,S—F的键能为___ kJ·mol-1。

(6)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃,密度为7.1g·cm-3。
①CuF比CuCl熔点高的原因是___ ;
②已知NA为阿伏加 德罗常数的值。CuF的晶胞结构如“图b”。则CuF的晶胞参数a=___ nm(列出计算式)。
(1)聚四氟乙烯是一种准晶体,该晶体是一种无平移周期序,但有严格准周期位置序的独特晶体。可通过
(2)K元素的基态原子的电子填充于
(3)[H2F]+[SbF6]-(氟酸锑)是一种超强酸,存在[H2F]+,该离子的空间构型为
(4)NH4F(氟化铵)可作为玻璃蚀刻剂、防腐剂、消毒剂等。NH4+的中心原子的杂化类型是
A.离子键 B.σ键 C.π键 D.氢键
(5)SbF6被广泛用作高压电气设备绝缘介质。SbF6是一种共价化合物,可通过类似Born
 Haber循环能量构建能量图(见图a)计算相关键能。则F—F键的键能为
Haber循环能量构建能量图(见图a)计算相关键能。则F—F键的键能为

(6)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃,密度为7.1g·cm-3。
①CuF比CuCl熔点高的原因是
②已知NA为阿伏加 德罗常数的值。CuF的晶胞结构如“图b”。则CuF的晶胞参数a=
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】均由两种短周期元素组成的A、B、C、D四种化合物分子都含有18个电子,四种化合物分子中所含原子的数目依次为2、3、4、6。A和C分子中各元素原子的个数比均为1:1,B和D分子中各元素原子的个数比均为1:2。D可作为火箭推进剂的燃料。请回答下列问题。
(1)A与HF相比,其沸点较低,原因是____ 。
(2)B分子的立体构型为____ 形,该分子属于____ (填“极性”或“非极性”)分子。
(3)A、B两种化合物分子的非氢元素原子的最高价氧化物对应的水化物的酸性强弱顺序为____ (用化学式表示),设A分子的非氢元素原子为X,B分子的中心原子为Y,比较下列物质的酸性强弱:HXO_____ HXO3____ HXO4(填“>”“<”或“=”,下同);H2YO3____ H2YO4。
(4)D分子中心原子的杂化方式是____ ,由该原子组成的单质分子中包含____ 个π键,与该单质分子互为等电子体的常见分子的分子式为___ 。
(1)A与HF相比,其沸点较低,原因是
(2)B分子的立体构型为
(3)A、B两种化合物分子的非氢元素原子的最高价氧化物对应的水化物的酸性强弱顺序为
(4)D分子中心原子的杂化方式是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】8−羟基喹啉( )被广泛用作
)被广泛用作 等金属离子的络合剂和萃取剂,也是重要的医药中间体。回答下列问题:
等金属离子的络合剂和萃取剂,也是重要的医药中间体。回答下列问题:
(1)8−羟基喹啉所含元素第一电离能由大到小顺序为___________ ;己8−羟基喹啉所有原子均在同一平面上,则氧原子的杂化方式为___________ ,分子中存在的大 键可表示为
键可表示为___________ 。
(2)8−羟基喹啉的熔点明显低于7−羟基喹啉( )、6−羟基喹啉(
)、6−羟基喹啉(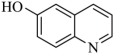 )的熔点的原因是
)的熔点的原因是___________ 。
(3)8−羟基喹啉与四氯化锗可制备印迹聚合物。基态 原子核外电子排布式为
原子核外电子排布式为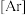
___________ ; 不能形成类似
不能形成类似 分子中的
分子中的 键,原因是
键,原因是______________________ 。
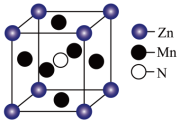
(4)某种含 特殊材料的晶胞结构如图所示,若该晶体的密度为
特殊材料的晶胞结构如图所示,若该晶体的密度为 ,则晶体中相邻N之间的最短距离为
,则晶体中相邻N之间的最短距离为___________  (列出计算式,
(列出计算式, 为阿伏伽德罗常数的值)。
为阿伏伽德罗常数的值)。
 )被广泛用作
)被广泛用作 等金属离子的络合剂和萃取剂,也是重要的医药中间体。回答下列问题:
等金属离子的络合剂和萃取剂,也是重要的医药中间体。回答下列问题:(1)8−羟基喹啉所含元素第一电离能由大到小顺序为
 键可表示为
键可表示为(2)8−羟基喹啉的熔点明显低于7−羟基喹啉(
 )、6−羟基喹啉(
)、6−羟基喹啉( )的熔点的原因是
)的熔点的原因是(3)8−羟基喹啉与四氯化锗可制备印迹聚合物。基态
 原子核外电子排布式为
原子核外电子排布式为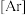
 不能形成类似
不能形成类似 分子中的
分子中的 键,原因是
键,原因是(4)某种含
 特殊材料的晶胞结构如图所示,若该晶体的密度为
特殊材料的晶胞结构如图所示,若该晶体的密度为 ,则晶体中相邻N之间的最短距离为
,则晶体中相邻N之间的最短距离为 (列出计算式,
(列出计算式, 为阿伏伽德罗常数的值)。
为阿伏伽德罗常数的值)。
您最近一年使用:0次



