碳是形成化合物种类最多的元素,其单质及其化合物是人类生产生活的主要能源物质。请回答下列问题:
已知:①CO(g)+2H2(g)=CH3OH(g) ΔH1=-99.0kJ•mol-1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g)=CO(g)+H2O(g) ΔH3=+41.0kJ•mol-1
(1)反应①熵变ΔS____ 0,该反应自发进行的条件是____ (填“低温”“高温”或“任意温度”)。
(2)CH3OH的燃烧热为726kJ•mol-1,计算16g甲醇燃烧放出的热量为____ kJ。
(3)反应CO2(g)+H2(g)=CO(g)+H2O(l)的ΔH____ ΔH3(填“>”“<”“=”)。
(4)根据盖斯定律计算反应②的ΔH2=____ kJ•mol-1,上述①②③反应中符合如图能量变化的是____ (填序号)。
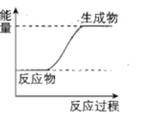
已知:①CO(g)+2H2(g)=CH3OH(g) ΔH1=-99.0kJ•mol-1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g)=CO(g)+H2O(g) ΔH3=+41.0kJ•mol-1
(1)反应①熵变ΔS
(2)CH3OH的燃烧热为726kJ•mol-1,计算16g甲醇燃烧放出的热量为
(3)反应CO2(g)+H2(g)=CO(g)+H2O(l)的ΔH
(4)根据盖斯定律计算反应②的ΔH2=

更新时间:2022-10-01 13:58:59
|
相似题推荐
填空题
|
较易
(0.85)
解题方法
【推荐1】人类利用化学反应不仅可以创造新物质,还可以实现不同形式能量之间的转化,化学反应所提供的能量大大促进了社会的发展。与研究化学反应中的物质变化一样,研究化学反应中的能量变化同样具有重要意义。热化学方程式是一种化学用语,它表示的是一个化学反应中的反应焓变和物质变化。
(1)下列反应中,生成物总能量低于反应物总能量的是___________。
| A.碳酸钙受热分解 | B.八水合氢氧化钡与氯化铵的反应 |
| C.金属与酸与水的反应 | D.煤与高温下的水蒸气反应 |
(2)下列说法错误的是___________。
| A.在同一反应中,焓变和反应热的数值不相等 |
| B.有化学键破坏的一定是化学反应,且一定伴随着能量的变化 |
C.一个化学反应中,反应物的焓小于生成物的焓时, |
| D.反应体系向环境中释放能量,反应体系的焓会减小 |
(3)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的一种反应原理如下:
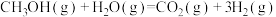
 ,下列说法正确的是___________。
,下列说法正确的是___________。A.1L 蒸汽与1L水蒸气反应生成1L 蒸汽与1L水蒸气反应生成1L 气体与3L氢气吸收热量49.0kJ 气体与3L氢气吸收热量49.0kJ |
B.1个 分子与1个水分子反应生成1个 分子与1个水分子反应生成1个 分子与3个 分子与3个 分子吸收热量49.0kJ 分子吸收热量49.0kJ |
C.1mol 气体与1mol液态水反应生成1mol 气体与1mol液态水反应生成1mol 气体与3mol氢气吸收的热量小于49.0kJ 气体与3mol氢气吸收的热量小于49.0kJ |
D.相同条件下1mol 与1mol 与1mol 的能量总和小于1mol 的能量总和小于1mol 与3mol 与3mol 的能量总和 的能量总和 |
(4)氢气是一种清洁能源,如图是
 和
和 反应生成
反应生成 的能量变化示意图,由图可知___________。
的能量变化示意图,由图可知___________。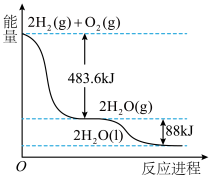
A. ,断键吸收的能量小于成键释放的能量 ,断键吸收的能量小于成键释放的能量 |
B.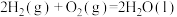 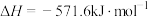 |
C. 和 和 具有的总能量比 具有的总能量比 所具有的总能量高 所具有的总能量高 |
D.生成2mol 需要吸收483.6kJ的能量 需要吸收483.6kJ的能量 |
(5)根据碘与氢气反应的热化学方程式
(ⅰ)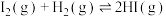
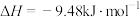
(ⅱ)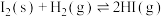
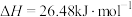
下列判断正确的是___________。
A.254g 中通入2g 中通入2g ,反应放热9.48kJ ,反应放热9.48kJ |
| B.1mol固态碘与1mol气态碘所含的能量相差17.00kJ |
| C.反应(ⅰ)的产物比反应(ⅱ)的产物稳定 |
| D.反应(ⅱ)的反应物总能量比反应(ⅰ)的反应物总能量低 |
(6)能表示反应
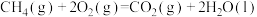 的示意图是
的示意图是A. 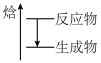 B.
B. 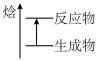 C.
C. 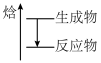 D.
D.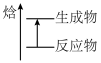
已知:常温常压下,8g甲烷气体在足量氧气中充分燃烧生成液态水和二氧化碳气体时放出445kJ热量,写出甲烷气体的燃烧热的热化学方程式:
(7)下表中的数据表示破坏1mol化学键需消耗的能量(即键能,单位为
 )。回答问题:
)。回答问题:| 化学键 | H―H | H―Cl |
| 键能 | 436 | 431 |
①下列关于键能的叙述正确的是
A.每生成1mol H―Cl吸收431kJ能量 B.每生成1mol H―Cl放出431kJ能量
C.每拆开1mol H―H放出436kJ能量 D.每拆开1mol H―H吸收436kJ能量
②已知热化学方程式: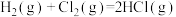
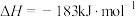 。则
。则 的键能为
的键能为 。
。
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】根据要求回答下列问题:
(1)下列过程不一定释放能量的是________ 。
A.化合反应 B.分解反应 C形成化学键 D.燃料燃烧 E.酸碱中和 F.炸药爆炸
(2)等质量的下列物质分别完全燃烧生成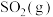 ,放出热量较多的是
,放出热量较多的是__________ 。
A.硫蒸气 B.硫固体
(3)已知 和
和 反应生成
反应生成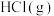 是放热反应,且断开1mol H-H键、1mol Cl-Cl键、1mol H-Cl键需吸收的能量分别为
是放热反应,且断开1mol H-H键、1mol Cl-Cl键、1mol H-Cl键需吸收的能量分别为 kJ、
kJ、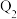 kJ、
kJ、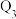 kJ。由此可以推知下列关系正确的是
kJ。由此可以推知下列关系正确的是_______ (填序号)。
A.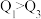 B.
B.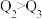 C.
C. D.
D.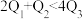 E.
E.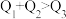 F.
F.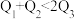
(1)下列过程不一定释放能量的是
A.化合反应 B.分解反应 C形成化学键 D.燃料燃烧 E.酸碱中和 F.炸药爆炸
(2)等质量的下列物质分别完全燃烧生成
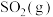 ,放出热量较多的是
,放出热量较多的是A.硫蒸气 B.硫固体
(3)已知
 和
和 反应生成
反应生成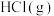 是放热反应,且断开1mol H-H键、1mol Cl-Cl键、1mol H-Cl键需吸收的能量分别为
是放热反应,且断开1mol H-H键、1mol Cl-Cl键、1mol H-Cl键需吸收的能量分别为 kJ、
kJ、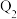 kJ、
kJ、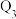 kJ。由此可以推知下列关系正确的是
kJ。由此可以推知下列关系正确的是A.
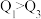 B.
B.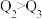 C.
C. D.
D.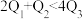 E.
E.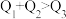 F.
F.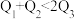
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐3】按要求回答下列问题:
(1)某同学做如下实验,以检验反应中的能量变化。
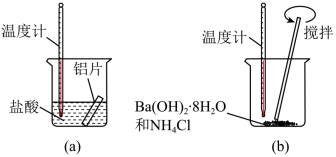
①在实验中发现反应后(a)中温度升高,由此可以判断(a)中反应是_______ 热反应,(b)中温度降低,由此可以判断(b)中反应是_______ 热反应。
②写出铝与盐酸反应的离子方程式:_______ 。
③根据能量守恒定律,(b)中反应物的总能量应该_______ (填“高于”或“低于”)其生成物的总能量。
(2)如图表示1mol 与1mol
与1mol 反应生成2molHCl的能量变化的理论分析示意图。
反应生成2molHCl的能量变化的理论分析示意图。
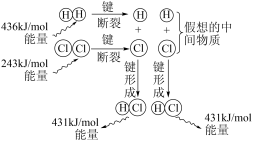
①化学键断裂需要_______ (填“释放”或“吸收”)能量。
②图中共释放的能量为_______ kJ。
③该反应的反应物的总能量_______ (填“大于”、“等于”或“小于”)生成物的总能量,所以该反应是_______ 反应。
(1)某同学做如下实验,以检验反应中的能量变化。

①在实验中发现反应后(a)中温度升高,由此可以判断(a)中反应是
②写出铝与盐酸反应的离子方程式:
③根据能量守恒定律,(b)中反应物的总能量应该
(2)如图表示1mol
 与1mol
与1mol 反应生成2molHCl的能量变化的理论分析示意图。
反应生成2molHCl的能量变化的理论分析示意图。
①化学键断裂需要
②图中共释放的能量为
③该反应的反应物的总能量
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐1】在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256kJ的热量。
(1)已知H2O(l)=H2O(g);ΔH=+44kJ/mol,试写出:液态肼燃烧生成氮气和液态水的热化学方程式___________ 。
(2)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是___________ 。
(1)已知H2O(l)=H2O(g);ΔH=+44kJ/mol,试写出:液态肼燃烧生成氮气和液态水的热化学方程式
(2)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐2】(1) 石墨
石墨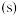 转变成金刚石
转变成金刚石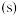 需要吸收
需要吸收 的热量,该反应的热化学方程式为
的热量,该反应的热化学方程式为____ 。
(2)在 、
、 下,一定质量的无水乙醇完全燃烧时放出热量
下,一定质量的无水乙醇完全燃烧时放出热量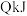 ,其燃烧生成的
,其燃烧生成的 用过量饱和澄清石灰水吸收可得
用过量饱和澄清石灰水吸收可得 沉淀,则乙醇燃烧的热化学方程式为
沉淀,则乙醇燃烧的热化学方程式为________ 。
(3)已知下列热化学方程式:
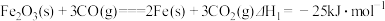 ①
①
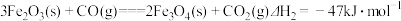 ②
②
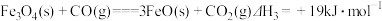 ③
③
写出 被
被 还原成
还原成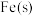 和
和 的热化学方程式:
的热化学方程式:________ 。
 石墨
石墨 转变成金刚石
转变成金刚石 需要吸收
需要吸收 的热量,该反应的热化学方程式为
的热量,该反应的热化学方程式为(2)在
 、
、 下,一定质量的无水乙醇完全燃烧时放出热量
下,一定质量的无水乙醇完全燃烧时放出热量 ,其燃烧生成的
,其燃烧生成的 用过量饱和澄清石灰水吸收可得
用过量饱和澄清石灰水吸收可得 沉淀,则乙醇燃烧的热化学方程式为
沉淀,则乙醇燃烧的热化学方程式为(3)已知下列热化学方程式:
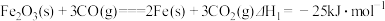 ①
①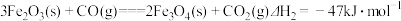 ②
②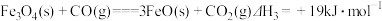 ③
③写出
 被
被 还原成
还原成 和
和 的热化学方程式:
的热化学方程式:
您最近一年使用:0次
【推荐3】回答下列问题
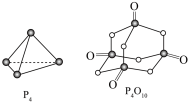
(1)白磷与氧可发生如下反应: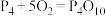 ,已知断裂下列化学键需要吸收的能量分别为:P—P
,已知断裂下列化学键需要吸收的能量分别为:P—P 、P—O
、P—O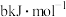 、P=O
、P=O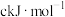 、O=O
、O=O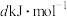 根据图示的分子结构和有关数据计算该反应的反应热为
根据图示的分子结构和有关数据计算该反应的反应热为_______ 。
(2)写出下列热化学方程式,在101kPa时,4.0g硫粉在氧气中完全燃烧生成二氧化硫,放出27kJ的热量,硫燃烧热的热化学方程式为_______ 。
(3)氮氧化物能破坏臭氧层: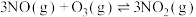

_______ 。
已知:反应Ⅰ: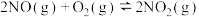
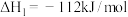
反应Ⅱ: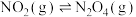
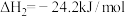
反应Ⅲ: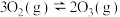
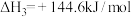
(4)碳氧化物的转化有重大用途,请回答下列问题,已知:
①

②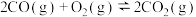

③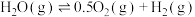

则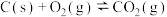

_______ ( 、
、 、
、 表示)。
表示)。
(1)白磷与氧可发生如下反应:
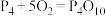 ,已知断裂下列化学键需要吸收的能量分别为:P—P
,已知断裂下列化学键需要吸收的能量分别为:P—P 、P—O
、P—O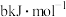 、P=O
、P=O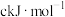 、O=O
、O=O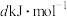 根据图示的分子结构和有关数据计算该反应的反应热为
根据图示的分子结构和有关数据计算该反应的反应热为
(2)写出下列热化学方程式,在101kPa时,4.0g硫粉在氧气中完全燃烧生成二氧化硫,放出27kJ的热量,硫燃烧热的热化学方程式为
(3)氮氧化物能破坏臭氧层:
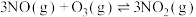

已知:反应Ⅰ:
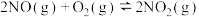
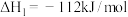
反应Ⅱ:
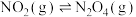
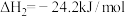
反应Ⅲ:
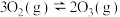
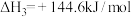
(4)碳氧化物的转化有重大用途,请回答下列问题,已知:
①


②
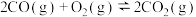

③
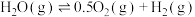

则
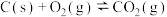

 、
、 、
、 表示)。
表示)。
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐1】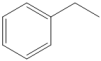 (g)
(g)
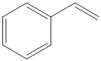 (g)+H2(g)
(g)+H2(g)
已知键能数据如图表格:
(1)计算上述反应的焓变
_____ 
(2)根据上述焓变的计算结果,结合该反应的熵变,以下判断正确的是_____。
 (g)
(g)
 (g)+H2(g)
(g)+H2(g)已知键能数据如图表格:
| 化学键 |  |  |  |  |
键能/ | 412 | 348 | 612 | 436 |


(2)根据上述焓变的计算结果,结合该反应的熵变,以下判断正确的是_____。
| A.高温时反应可以自发进行 |
| B.低温时反应可以自发进行 |
| C.任何温度下反应都可以自发进行 |
| D.任何温度下反应都不可以自发进行 |
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】将 氢化为
氢化为 有三种方法,对应的反应依次为:
有三种方法,对应的反应依次为:
①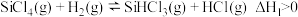
②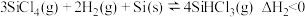
③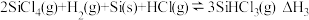
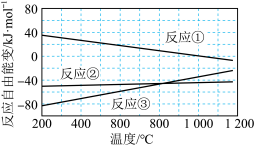
已知体系自由能变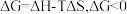 时反应自发进行。三个氢化反应的
时反应自发进行。三个氢化反应的 与温度的关系如图所示,可知:反应①能自发进行的最低温度是
与温度的关系如图所示,可知:反应①能自发进行的最低温度是_______ ;相同温度下,反应②比反应①的 小,主要原因是
小,主要原因是_________ 。
 氢化为
氢化为 有三种方法,对应的反应依次为:
有三种方法,对应的反应依次为:①
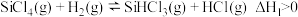
②
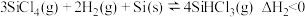
③
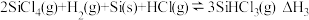
已知体系自由能变
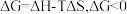 时反应自发进行。三个氢化反应的
时反应自发进行。三个氢化反应的 与温度的关系如图所示,可知:反应①能自发进行的最低温度是
与温度的关系如图所示,可知:反应①能自发进行的最低温度是 小,主要原因是
小,主要原因是
您最近一年使用:0次



