25 ℃时,50 mL 0.10 mol/L醋酸中存在电离平衡:CH3COOH CH3COO-+H+
CH3COO-+H+
(1)加入少量冰醋酸,上述平衡向_______ 移动〔填“左”、“右”、“不”,下同〕。
(2)加入少量0.1mol/L盐酸,上述平衡向_______ 移动。
(3)加入一定量蒸馏水,上述平衡向_______ 移动。
(4)加入20mL 0.1mol/LNaCl溶液,上述平衡向_______ 移动。
 CH3COO-+H+
CH3COO-+H+(1)加入少量冰醋酸,上述平衡向
(2)加入少量0.1mol/L盐酸,上述平衡向
(3)加入一定量蒸馏水,上述平衡向
(4)加入20mL 0.1mol/LNaCl溶液,上述平衡向
更新时间:2022-09-18 16:04:11
|
相似题推荐
填空题
|
较易
(0.85)
【推荐1】回答下列问题。
(1)现有常温下 的盐酸(甲)、
的盐酸(甲)、 的醋酸溶液(乙)和
的醋酸溶液(乙)和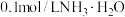 (丙),请根据下列操作回答:
(丙),请根据下列操作回答:
①常温下,将丙溶液加水稀释,下列数值变大的是___________ (填字母)。
A. B.
B. C.
C.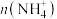 D.
D.
②已知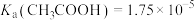 ,则醋酸溶液(乙)的浓度为
,则醋酸溶液(乙)的浓度为_______  (结果保留三位有效数字)。
(结果保留三位有效数字)。
③常温下,取甲、乙各1mL分别稀释至100mL,稀释后,溶液的pH:甲______ 乙(填“>”“<”或“=”)。
(2)①相同条件下,取相同体积、相同pH的 、
、 和
和 三种碱溶液,分别滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为
三种碱溶液,分别滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为 、
、 、
、 ,则三者的大小关系为
,则三者的大小关系为________ 。
②某温度下,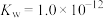 ,将
,将 的
的 溶液和
溶液和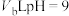 的
的 溶液混合均匀,测得溶液的
溶液混合均匀,测得溶液的 ,则
,则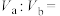
___________ 。
(3)已知:在25℃,有关弱电解质的电离平衡常数如下表:
①将 通入氨水中,当
通入氨水中,当 降至
降至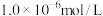 时,溶液中的
时,溶液中的
___________ 。
②下列微粒在溶液中不能大量共存的是___________ 。
A. 、
、 B.
B. 、
、 C.
C. 、
、 D.
D. 、
、
(1)现有常温下
 的盐酸(甲)、
的盐酸(甲)、 的醋酸溶液(乙)和
的醋酸溶液(乙)和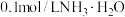 (丙),请根据下列操作回答:
(丙),请根据下列操作回答:①常温下,将丙溶液加水稀释,下列数值变大的是
A.
 B.
B. C.
C.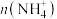 D.
D.
②已知
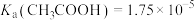 ,则醋酸溶液(乙)的浓度为
,则醋酸溶液(乙)的浓度为 (结果保留三位有效数字)。
(结果保留三位有效数字)。③常温下,取甲、乙各1mL分别稀释至100mL,稀释后,溶液的pH:甲
(2)①相同条件下,取相同体积、相同pH的
 、
、 和
和 三种碱溶液,分别滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为
三种碱溶液,分别滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为 、
、 、
、 ,则三者的大小关系为
,则三者的大小关系为②某温度下,
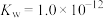 ,将
,将 的
的 溶液和
溶液和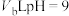 的
的 溶液混合均匀,测得溶液的
溶液混合均匀,测得溶液的 ,则
,则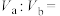
(3)已知:在25℃,有关弱电解质的电离平衡常数如下表:
| 弱电解质 |  |  |  |  |
| 电离平衡常数 | 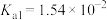  |   | 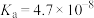 |  |
 通入氨水中,当
通入氨水中,当 降至
降至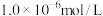 时,溶液中的
时,溶液中的
②下列微粒在溶液中不能大量共存的是
A.
 、
、 B.
B. 、
、 C.
C. 、
、 D.
D. 、
、
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】常温下,有 0.1 mol/L 的四种溶液:①HCl ②CH3COOH ③NaOH ④Na2CO3
(1)用化学用语解释溶液①呈酸性的原因:_________ 。
(2)溶液③的 pH=_________ 。
(3)溶液①、②分别与等量的溶液③恰好完全反应,消耗的体积:①_________ ②(填“>”、“<”或“=”)。
(4)溶液④加热后碱性增强,结合化学用语解释原因:_________ 。
(5)常温下,下列关于溶液②的判断正确的是_________ 。
a.c(CH3COO−) = 0.1 mol/L
b.溶液中c(H+) > c(CH3COO−) > c(OH −)
c.加入CH3COONa(s),c(H+)不变
d.滴入 NaOH 浓溶液,溶液导电性增强
(1)用化学用语解释溶液①呈酸性的原因:
(2)溶液③的 pH=
(3)溶液①、②分别与等量的溶液③恰好完全反应,消耗的体积:①
(4)溶液④加热后碱性增强,结合化学用语解释原因:
(5)常温下,下列关于溶液②的判断正确的是
a.c(CH3COO−) = 0.1 mol/L
b.溶液中c(H+) > c(CH3COO−) > c(OH −)
c.加入CH3COONa(s),c(H+)不变
d.滴入 NaOH 浓溶液,溶液导电性增强
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐3】已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH⇌CH3COO-+H+;ΔH>0
(1)25℃时,浓度均为0.1mol/L的盐酸和醋酸溶液,下列说法正确的是______ (填序号)
①两溶液的pH相同
②两溶液的导电能力相同
③由水电离出的c(OH-)相同
④中和等物质的量的NaOH溶液,消耗两溶液的体积相同
(2)25℃时,向pH均为1的盐酸和醋酸溶液中分别加水,随加水量的增多,两溶液pH的变化如图所示,则符合盐酸pH变化的曲线是______ ;

(3)25℃时,向体积为Va mL pH=3的醋酸溶液中滴加pH=11的NaOH溶液Vb mL至溶液恰好呈中性,则Va______ Vb(填“>”、“<”或“=”),请写出此时电荷守恒关系式:______ ;
(1)25℃时,浓度均为0.1mol/L的盐酸和醋酸溶液,下列说法正确的是
①两溶液的pH相同
②两溶液的导电能力相同
③由水电离出的c(OH-)相同
④中和等物质的量的NaOH溶液,消耗两溶液的体积相同
(2)25℃时,向pH均为1的盐酸和醋酸溶液中分别加水,随加水量的增多,两溶液pH的变化如图所示,则符合盐酸pH变化的曲线是

(3)25℃时,向体积为Va mL pH=3的醋酸溶液中滴加pH=11的NaOH溶液Vb mL至溶液恰好呈中性,则Va
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐1】一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示,请回答:
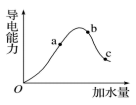
(1)a、b、c三点溶液酸性由强到弱的顺序为___________ 。
(2)若使c点溶液中的 c(CH3COO−) 提高,在如下措施中,不可选择的是______ (填字母,下同)。A.加热 B.加很稀的 NaOH 溶液 C.加固体 KOH D.加水 E.加固体 CH3COONa F.加 Zn 粒
(3)在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是___________。

(1)a、b、c三点溶液酸性由强到弱的顺序为
(2)若使c点溶液中的 c(CH3COO−) 提高,在如下措施中,不可选择的是
(3)在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是___________。
A. |
B. 个数 个数 |
C. 分子数 分子数 |
D. |
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】CH3COOH溶液加水稀释后,溶液中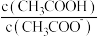 的值增大。
的值增大。______
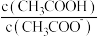 的值增大。
的值增大。
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐3】(1)t℃时,水的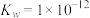 ,则该温度
,则该温度______ (填“>”“<”或“=”)25℃,其理由是________ 。
(2)在(1)中所述温度下, 的溶液呈
的溶液呈_______ (填“酸性”“碱性”或“中性”);若该溶液中只存在 溶质,则由水电离出的
溶质,则由水电离出的
______  。
。
(3)实验室用 和稀硫酸制取
和稀硫酸制取 ,反应时溶液中水的电离平衡
,反应时溶液中水的电离平衡_______ (填“向左”“向右”或“不”,下同)移动。在新制氯水中加入少量 固体,水的电离平衡
固体,水的电离平衡_______ 移动。
(4)25℃时, 的盐酸中水的电离程度
的盐酸中水的电离程度_________ (填“大于”“小于”或“等于”) 的
的 溶液中水的电离程度。
溶液中水的电离程度。
(5) 乙酸(甲,
乙酸(甲,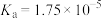 )和
)和 氯乙酸(乙,
氯乙酸(乙,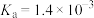 )的水溶液中,下列可以表示两溶液中由水电离出的
)的水溶液中,下列可以表示两溶液中由水电离出的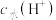 与加入水的体积V之间关系的是
与加入水的体积V之间关系的是______ (填字母)。
a.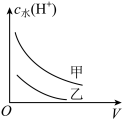 b.
b.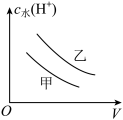 c.
c.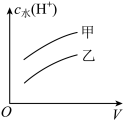 d.
d.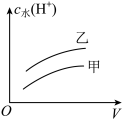
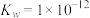 ,则该温度
,则该温度(2)在(1)中所述温度下,
 的溶液呈
的溶液呈 溶质,则由水电离出的
溶质,则由水电离出的
 。
。(3)实验室用
 和稀硫酸制取
和稀硫酸制取 ,反应时溶液中水的电离平衡
,反应时溶液中水的电离平衡 固体,水的电离平衡
固体,水的电离平衡(4)25℃时,
 的盐酸中水的电离程度
的盐酸中水的电离程度 的
的 溶液中水的电离程度。
溶液中水的电离程度。(5)
 乙酸(甲,
乙酸(甲,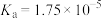 )和
)和 氯乙酸(乙,
氯乙酸(乙,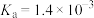 )的水溶液中,下列可以表示两溶液中由水电离出的
)的水溶液中,下列可以表示两溶液中由水电离出的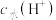 与加入水的体积V之间关系的是
与加入水的体积V之间关系的是a.
 b.
b. c.
c. d.
d.
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐1】一水合氨(NH3·H2O)是一种常见的弱碱,回答下列问题:
在0.1mol·L﹣1氨水中加入下列物质,一水合氨的电离平衡及平衡时物质的浓度的变化:
(1)写出NH3·H2O的电离方程式____ 。
(2)向氨水中加入NH4Cl固体,电离平衡向___ 移动(填“正向”、“逆向”或“不移动”,下同);pH ___ (填“增大”、“减小”或“不变”,下同)
(3)向氨水中加入FeCl3固体,电离平衡向_____ 移动;c(NH3·H2O)______
(4)已知常温下,NH3·H2O的电离常数为Kb=1.8×10-5,若氨水的浓度为2.0mol∙L-1,则溶液中OH-的浓度是___ mol∙L-1。
在0.1mol·L﹣1氨水中加入下列物质,一水合氨的电离平衡及平衡时物质的浓度的变化:
(1)写出NH3·H2O的电离方程式
(2)向氨水中加入NH4Cl固体,电离平衡向
(3)向氨水中加入FeCl3固体,电离平衡向
(4)已知常温下,NH3·H2O的电离常数为Kb=1.8×10-5,若氨水的浓度为2.0mol∙L-1,则溶液中OH-的浓度是
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐2】在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如右图所示。请回答:
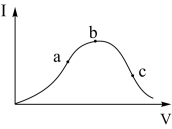
(1)a、b、c三点溶液中c(H+)由大到小的顺序为_____________ ;
(2)a、b、c三点中醋酸电离度最大的是_____________ ;
(3)若使C点溶液的c(CH3COO-)提高,在如下措施中可采取_____ (填标号)
A.通HCl气体
B.加Zn粒
C.加入固体KOH
D.加水
E.加固体CH3COONa

(1)a、b、c三点溶液中c(H+)由大到小的顺序为
(2)a、b、c三点中醋酸电离度最大的是
(3)若使C点溶液的c(CH3COO-)提高,在如下措施中可采取
A.通HCl气体
B.加Zn粒
C.加入固体KOH
D.加水
E.加固体CH3COONa
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐3】一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示,请回答:

(1)a、b、c三点溶液酸性由强到弱的顺序为___________ 。
(2)若使c点溶液中的 c(CH3COO−) 提高,在如下措施中,不可选择的是______ (填字母,下同)。A.加热 B.加很稀的 NaOH 溶液 C.加固体 KOH D.加水 E.加固体 CH3COONa F.加 Zn 粒
(3)在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是___________。

(1)a、b、c三点溶液酸性由强到弱的顺序为
(2)若使c点溶液中的 c(CH3COO−) 提高,在如下措施中,不可选择的是
(3)在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是___________。
A. |
B. 个数 个数 |
C. 分子数 分子数 |
D. |
您最近一年使用:0次



