常温下,有 0.1 mol/L 的四种溶液:①HCl ②CH3COOH ③NaOH ④Na2CO3
(1)用化学用语解释溶液①呈酸性的原因:_________ 。
(2)溶液③的 pH=_________ 。
(3)溶液①、②分别与等量的溶液③恰好完全反应,消耗的体积:①_________ ②(填“>”、“<”或“=”)。
(4)溶液④加热后碱性增强,结合化学用语解释原因:_________ 。
(5)常温下,下列关于溶液②的判断正确的是_________ 。
a.c(CH3COO−) = 0.1 mol/L
b.溶液中c(H+) > c(CH3COO−) > c(OH −)
c.加入CH3COONa(s),c(H+)不变
d.滴入 NaOH 浓溶液,溶液导电性增强
(1)用化学用语解释溶液①呈酸性的原因:
(2)溶液③的 pH=
(3)溶液①、②分别与等量的溶液③恰好完全反应,消耗的体积:①
(4)溶液④加热后碱性增强,结合化学用语解释原因:
(5)常温下,下列关于溶液②的判断正确的是
a.c(CH3COO−) = 0.1 mol/L
b.溶液中c(H+) > c(CH3COO−) > c(OH −)
c.加入CH3COONa(s),c(H+)不变
d.滴入 NaOH 浓溶液,溶液导电性增强
更新时间:2020-07-10 15:46:23
|
相似题推荐
填空题
|
较易
(0.85)
【推荐1】(1)常温下,0.05mol/L硫酸溶液中,c(H+)=_______ mol/L,pH值为_____ ,水电离的c(H+)=_______ mol/L
(2)某温度下,纯水中c(H+)=2×10-7mol/L,则纯水中c(OH-)=_________ mol/L,滴入盐酸使c(H+) =5×10-6mol/L,则c(OH-) =_________ mol/L
(2)某温度下,纯水中c(H+)=2×10-7mol/L,则纯水中c(OH-)=
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】在100.00 mL 0.1000 mol·L-1的二元弱酸H2A溶液中滴入50. 00 mL 0.1000mol·L-1NaOH溶液时,其pH值为4. 00;滴入150. 00 mL 0.1000 mol·L-1NaOH溶液时,其pH值为8.00.计算:0. 1000mol·L-1二元弱酸H2A溶液的pH值为___________ ;滴入100. 00mL 0. 1000 mol·L-1NaOH溶液后,溶液的pH值为 ____________ 。
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐3】(1)根据反应Br+H2⇌HBr+H的能量对反应历程的示意图甲进行判断,该反应为_______ 反应(填“吸热”或“放热”)
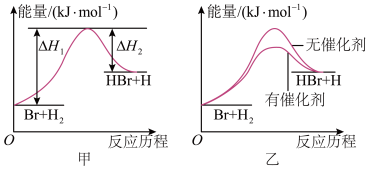
(2)常温下0.01mol·L-1 NaOH溶液的pH=_______ 。
(3)已知下列反应:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-870.3kJ/mol
②C(s)+O2(g)=CO2(g) ΔH2=-393.5kJ/mol
③H2(g)+ O2(g)=H2O(l) ΔH3=-285.8kJ/mol
O2(g)=H2O(l) ΔH3=-285.8kJ/mol
则反应2C(s)+2H2(g)+O2(g) =CH3COOH(l)的反应热为ΔH=_______ kJ/mol

(2)常温下0.01mol·L-1 NaOH溶液的pH=
(3)已知下列反应:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-870.3kJ/mol
②C(s)+O2(g)=CO2(g) ΔH2=-393.5kJ/mol
③H2(g)+
 O2(g)=H2O(l) ΔH3=-285.8kJ/mol
O2(g)=H2O(l) ΔH3=-285.8kJ/mol则反应2C(s)+2H2(g)+O2(g) =CH3COOH(l)的反应热为ΔH=
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐1】(1)内因:___________________ 。
(2)外因:①浓度:_________________________
②温度:________________________________________
③酸碱度
(3)酸式盐溶液的酸碱性:强酸酸式盐显__________ ,原因是_____________________________ 。多元弱酸酸式盐溶液的酸碱性取决于_____________________________________ ,例如NaHCO3溶液显碱性,原因是_________________ ,_______________________________ (离子方程式和文字说明);
NaHSO3溶液显酸性的原因是________________ ,_____________________ (离子方程式和文字说明)。
(4)用↑、↓、→、←表示,填表:CH3COONa溶液改变下列条件,填写变化情况:CH3COO-+H2O CH3COOH+OH-
CH3COOH+OH-_______________
(2)外因:①浓度:
②温度:
③酸碱度
(3)酸式盐溶液的酸碱性:强酸酸式盐显
NaHSO3溶液显酸性的原因是
(4)用↑、↓、→、←表示,填表:CH3COONa溶液改变下列条件,填写变化情况:CH3COO-+H2O
 CH3COOH+OH-
CH3COOH+OH-| 改变条件 | 平衡移动 | c(CH3COO-) | c(OH-) | 水解 |
| 加入CH3COONa | ||||
| 通入HCl | ||||
| 升温 | ||||
| 加水 | ||||
| 加NaOH | ||||
| 加HAc | ||||
| 加NH4Cl |
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】常压下,取不同浓度、不同温度的氨水进行各项内容的测定,得到下表实验数据。
(1)温度升高, 的电离平衡向
的电离平衡向________ (填“左”或“右”)移动,能支持该结论的表中数据是________ (填序号)。
a.电离常数 b.电离度 c. d.
d.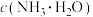
(2)表中 基本不变的原因是
基本不变的原因是________________ 。
(3)常温下,在氨水中加入一定量的氯化铵晶体,下列说法错误的是________ (填序号)。
A.溶液的 增大 B.氨水的电离度减小 C.
增大 B.氨水的电离度减小 C. 减小 D.
减小 D. 减小
减小
温度 |  | 电离常数 | 电离度 |  |
| 0 | 16.56 | 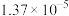 | 9.098 | 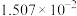 |
| 10 | 15.16 | 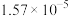 | 10.18 | 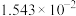 |
| 20 | 13.63 | 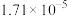 | 11.2 | 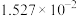 |
(1)温度升高,
 的电离平衡向
的电离平衡向a.电离常数 b.电离度 c.
 d.
d.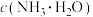
(2)表中
 基本不变的原因是
基本不变的原因是(3)常温下,在氨水中加入一定量的氯化铵晶体,下列说法错误的是
A.溶液的
 增大 B.氨水的电离度减小 C.
增大 B.氨水的电离度减小 C. 减小 D.
减小 D. 减小
减小
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐3】25℃时10mL0.10mol/L醋酸中存在电离平衡:CH3COOH CH3COO-+H+
CH3COO-+H+
(1)加入少量冰醋酸,醋酸电离程度___________ (填“增大”、“减小”、“不变”,下同)
(2)加入少量0.5mol/L盐酸,上述平衡向___________ 移动,c(H+)___________
(3)加入一定量蒸馏水,上述平衡向___________ 移动,n(H+)___________
(4)加入少量的Na2CO3固体,醋酸电离程度___________
 CH3COO-+H+
CH3COO-+H+(1)加入少量冰醋酸,醋酸电离程度
(2)加入少量0.5mol/L盐酸,上述平衡向
(3)加入一定量蒸馏水,上述平衡向
(4)加入少量的Na2CO3固体,醋酸电离程度
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐1】ⅰ.(1)氨气极易溶于水,氨气与水反应的化学方程式为_____________________ ;
氨水显碱性的原因是_____________________________ (用离子方程式表示)。
(2)在6份0.01 mol·L-1的氨水中分别加入下列物质:
A.浓氨水 B.纯水 C.少量浓硫酸 D.少量NaOH固体 E.少量Al2(SO4)3固体
①能使c(OH-)减少、c(NH4+)增大的是____ (填字母,下同)。
②能使c(OH-)增大、c(NH4+)减少的是____ 。
③能使c(OH-)和c(NH4+)都增大的是____ 。
④能使c(OH-)和c(NH4+)都减少的是____ 。
ⅱ.某温度下纯水中c(H+)=2×10-7 mol·L-1,则此时c(OH-)=________ ;该温度下向纯水中加盐酸使c(H+)=5×10-6 mol·L-1,则此时c(OH-)=______________________________ 。
氨水显碱性的原因是
(2)在6份0.01 mol·L-1的氨水中分别加入下列物质:
A.浓氨水 B.纯水 C.少量浓硫酸 D.少量NaOH固体 E.少量Al2(SO4)3固体
①能使c(OH-)减少、c(NH4+)增大的是
②能使c(OH-)增大、c(NH4+)减少的是
③能使c(OH-)和c(NH4+)都增大的是
④能使c(OH-)和c(NH4+)都减少的是
ⅱ.某温度下纯水中c(H+)=2×10-7 mol·L-1,则此时c(OH-)=
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】在22℃时,用 传感器测量
传感器测量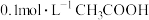 溶液的
溶液的 ,测得
,测得 约为3.0;然后,逐渐升高温度至29℃时,测得
约为3.0;然后,逐渐升高温度至29℃时,测得 降至2.9。加热过程中
降至2.9。加热过程中 变化的原因是
变化的原因是_______ 。
 传感器测量
传感器测量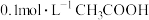 溶液的
溶液的 ,测得
,测得 约为3.0;然后,逐渐升高温度至29℃时,测得
约为3.0;然后,逐渐升高温度至29℃时,测得 降至2.9。加热过程中
降至2.9。加热过程中 变化的原因是
变化的原因是
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐3】H2S是二元弱酸,溶液中存在H2S H++HS-、HS-
H++HS-、HS- H++S2-。
H++S2-。
(1)向H2S溶液中加入CuSO4溶液时,电离平衡向_______ 移动,c(H+)________ ,c(S2-)________ 。
(2)向H2S溶液中加入NaOH固体时,电离平衡向_______ 移动,c(H+)________ ,c(S2-)________ 。
(3)若将H2S溶液加热至沸腾,c(H2S)________ 。
(4)若要增大H2S溶液中的c(S2-),最好加入__________ 。
 H++HS-、HS-
H++HS-、HS- H++S2-。
H++S2-。(1)向H2S溶液中加入CuSO4溶液时,电离平衡向
(2)向H2S溶液中加入NaOH固体时,电离平衡向
(3)若将H2S溶液加热至沸腾,c(H2S)
(4)若要增大H2S溶液中的c(S2-),最好加入
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐1】已知在氨水中存在下列平衡:NH3+H2O NH3·H2O
NH3·H2O NH4++OH-
NH4++OH-
①向氨水中加入MgCl2固体时,平衡_______ (向正反应、向逆反应、不)移动,OH-的浓度_______ (减小、增大、不变,下同),NH4+的浓度_______ 。
②向氨水中加入浓盐酸,平衡_______ (向正反应、向逆反应、不)移动,此时溶液中浓度增大的离子有(Cl-除外)___________________ 。
 NH3·H2O
NH3·H2O NH4++OH-
NH4++OH-①向氨水中加入MgCl2固体时,平衡
②向氨水中加入浓盐酸,平衡
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】ⅰ.(1)氨气极易溶于水,氨气与水反应的化学方程式为_____________________ ;
氨水显碱性的原因是_____________________________ (用离子方程式表示)。
(2)在6份0.01 mol·L-1的氨水中分别加入下列物质:
A.浓氨水 B.纯水 C.少量浓硫酸 D.少量NaOH固体 E.少量Al2(SO4)3固体
①能使c(OH-)减少、c(NH4+)增大的是____ (填字母,下同)。
②能使c(OH-)增大、c(NH4+)减少的是____ 。
③能使c(OH-)和c(NH4+)都增大的是____ 。
④能使c(OH-)和c(NH4+)都减少的是____ 。
ⅱ.某温度下纯水中c(H+)=2×10-7 mol·L-1,则此时c(OH-)=________ ;该温度下向纯水中加盐酸使c(H+)=5×10-6 mol·L-1,则此时c(OH-)=______________________________ 。
氨水显碱性的原因是
(2)在6份0.01 mol·L-1的氨水中分别加入下列物质:
A.浓氨水 B.纯水 C.少量浓硫酸 D.少量NaOH固体 E.少量Al2(SO4)3固体
①能使c(OH-)减少、c(NH4+)增大的是
②能使c(OH-)增大、c(NH4+)减少的是
③能使c(OH-)和c(NH4+)都增大的是
④能使c(OH-)和c(NH4+)都减少的是
ⅱ.某温度下纯水中c(H+)=2×10-7 mol·L-1,则此时c(OH-)=
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
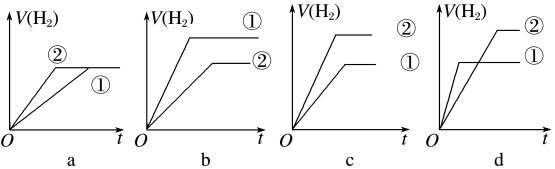
【推荐3】常温下,有c(H+)相同、体积相同的醋酸和盐酸两种溶液,采取以下措施:
(1)加适量醋酸钠晶体后,醋酸溶液中c(H+)___ (填“增大”、“减小”或“不变”,下同),盐酸中c(H+)___ 。
(2)加水稀释10倍后,溶液中的c(H+):醋酸___ (填“>”、“=”或“<”,下同)盐酸。加等浓度的NaOH溶液至恰好中和,所需NaOH溶液的体积:醋酸___ 盐酸。
(3)使温度都升高20℃,溶液中c(H+):醋酸___ (填“>”、“=”或“<”)盐酸。
(4)分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是___ (填字母)。(①表示盐酸,②表示醋酸)
(5)将0.1mol∙L-1的CH3COOH加水稀释,有关稀释后醋酸溶液的说法中,正确的是___ (填字母)。
a.电离程度增大
b.溶液中离子总数增多
c.溶液导电性增强
d.溶液中醋酸分子增多
(1)加适量醋酸钠晶体后,醋酸溶液中c(H+)
(2)加水稀释10倍后,溶液中的c(H+):醋酸
(3)使温度都升高20℃,溶液中c(H+):醋酸
(4)分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是

(5)将0.1mol∙L-1的CH3COOH加水稀释,有关稀释后醋酸溶液的说法中,正确的是
a.电离程度增大
b.溶液中离子总数增多
c.溶液导电性增强
d.溶液中醋酸分子增多
您最近一年使用:0次



