砷(As)的某些化合物具有独特的性质与用途,如 在医药、电子等领域有重要应用。某化工厂利用含硫化砷(As2S3)的废料制取As2O3(微溶于水)的流程如下。
在医药、电子等领域有重要应用。某化工厂利用含硫化砷(As2S3)的废料制取As2O3(微溶于水)的流程如下。 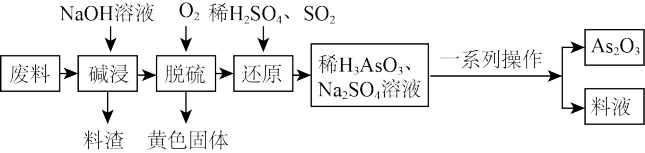
回答下列问题:
(1)砷与磷是同主族的相邻元素,其在周期表中的位置是_______ ,从物质化学性质角度看, 不可能是
不可能是_______ (填“酸”、“碱”或“两”)性氧化物。
(2)碱浸液中溶质主要为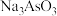 和
和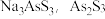 与NaOH反应的离子方程式:
与NaOH反应的离子方程式:_______ 。
(3)脱硫后以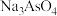 的形式存在,写出
的形式存在,写出 与
与 反应的化学方程式:
反应的化学方程式:_______ 。还原后砷以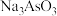 形式存在,则通入
形式存在,则通入 的反应中,氧化剂与还原剂的物质的量之比为
的反应中,氧化剂与还原剂的物质的量之比为_______ 。
(4)还原后加热溶液,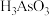 分解为
分解为 ,结晶得到相
,结晶得到相 ,
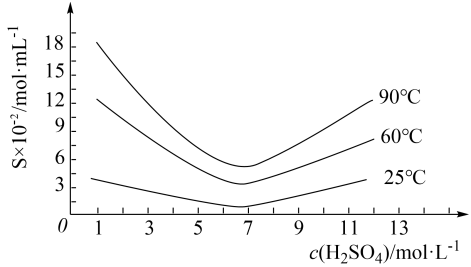
, 在不同温度和不同浓度硫酸中的溶解度(S)曲线如图所示,为了提高粗
在不同温度和不同浓度硫酸中的溶解度(S)曲线如图所示,为了提高粗 的沉淀率,“结晶”过程进行的操作是蒸发浓缩,冷却结晶,过滤,洗涤,在此过程中应控制的条件为
的沉淀率,“结晶”过程进行的操作是蒸发浓缩,冷却结晶,过滤,洗涤,在此过程中应控制的条件为_______ 。
(5)在工业生产中,最后一步所得滤液可循环使用,其目的是_______ 。
 在医药、电子等领域有重要应用。某化工厂利用含硫化砷(As2S3)的废料制取As2O3(微溶于水)的流程如下。
在医药、电子等领域有重要应用。某化工厂利用含硫化砷(As2S3)的废料制取As2O3(微溶于水)的流程如下。 
回答下列问题:
(1)砷与磷是同主族的相邻元素,其在周期表中的位置是
 不可能是
不可能是(2)碱浸液中溶质主要为
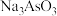 和
和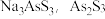 与NaOH反应的离子方程式:
与NaOH反应的离子方程式:(3)脱硫后以
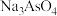 的形式存在,写出
的形式存在,写出 与
与 反应的化学方程式:
反应的化学方程式: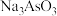 形式存在,则通入
形式存在,则通入 的反应中,氧化剂与还原剂的物质的量之比为
的反应中,氧化剂与还原剂的物质的量之比为(4)还原后加热溶液,
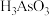 分解为
分解为 ,结晶得到相
,结晶得到相 ,
, 在不同温度和不同浓度硫酸中的溶解度(S)曲线如图所示,为了提高粗
在不同温度和不同浓度硫酸中的溶解度(S)曲线如图所示,为了提高粗 的沉淀率,“结晶”过程进行的操作是蒸发浓缩,冷却结晶,过滤,洗涤,在此过程中应控制的条件为
的沉淀率,“结晶”过程进行的操作是蒸发浓缩,冷却结晶,过滤,洗涤,在此过程中应控制的条件为
(5)在工业生产中,最后一步所得滤液可循环使用,其目的是
更新时间:2022-10-12 17:06:08
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】铋(Bi)与氮同主族,氯氧化铋(BiOCl)广泛用于彩釉调料、塑料助剂、油漆调色、生产金属铋等。一种用火法炼铜过程产铜转炉烟尘(除含铋的化合物之外,还有CuSO4、ZnSO4、CuS、Fe2O3、SiO2、铅砷化合物)制备高纯氯氧化铋的工艺流程如下:
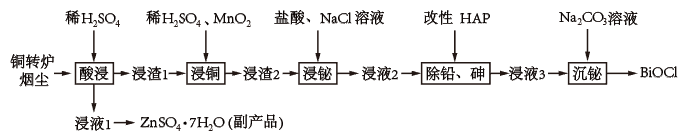
回答下列问题:
(1)向“酸浸”所得浸液1中加入Zn粉,主要目的是____________ ;充分反应后过滤,从溶液中获得ZnSO4·7H2O的操作为____________ 、过滤、洗涤、干燥。
(2)“浸铜”时,有单质硫生成,其离子方程式为__________ ;浸出渣中除含有硫外,还含有___________ (填化学式)和铅砷化合物。
(3)“浸铋”时,反应液必须保持强酸性,否则BiOCl会提前析出混入浸出渣使产率降低,原因是________ (用离子方程式表示)。
(4)“除铅、砷”时,加入改性HAP。浸液1与HAP的液固比(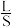 )与铅、砷去除率以及后续沉铋量的关系如下表:
)与铅、砷去除率以及后续沉铋量的关系如下表:
实验中应采用的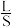 =
=_______ 。
(5)“沉铋“时需控制溶液的pH=3.0,此时BiCl3发生反应的化学方程式为___________ 。

回答下列问题:
(1)向“酸浸”所得浸液1中加入Zn粉,主要目的是
(2)“浸铜”时,有单质硫生成,其离子方程式为
(3)“浸铋”时,反应液必须保持强酸性,否则BiOCl会提前析出混入浸出渣使产率降低,原因是
(4)“除铅、砷”时,加入改性HAP。浸液1与HAP的液固比(
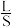 )与铅、砷去除率以及后续沉铋量的关系如下表:
)与铅、砷去除率以及后续沉铋量的关系如下表:
| 125:1 | 50:1 | 25:1 | 15:1 |
| Pb2+去除率/% | 84.86 | 94.15 | 95.40 | 96.83 |
| As3+去除率/% | 98.79 | 98.92 | 98.99 | 99.05 |
| m(沉铋)/g | 2.34 | 2.33 | 2.05 | 1.98 |
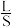 =
=(5)“沉铋“时需控制溶液的pH=3.0,此时BiCl3发生反应的化学方程式为
您最近一年使用:0次
【推荐2】取一定量的硫酸酸化的硫酸锰(MnSO4)溶液,向其中依次加入下列物质,对应现象如表所示:
已知:①金属铋(Bi)价态为+3时较稳定,Bi3+无色;
②铋酸钠(NaBiO3)无色,难溶于水;
③淀粉溶液遇到I2变成蓝色。
(1)NaBiO3中Bi的化合价为____ ,步骤1的氧化产物为____ ,参加反应的氧化剂和还原剂的个数比为____ 。
(2)请配平步骤2发生反应的化学方程式____ 。
 KMnO4+
KMnO4+ H2O2+
H2O2+ H2SO4→
H2SO4→ K2SO4+
K2SO4+ MnSO4+
MnSO4+ O2↑+
O2↑+ ____。
____。
(3)步骤2中过量的H2O2可以氧化KI,则步骤3对应的现象A为____ 。
(4)由上述现象可得NaBiO3、H2O2、MnO 、I2的氧化性由强到弱的顺序为
、I2的氧化性由强到弱的顺序为____ 。根据上述结论,请写出NaBiO3与KI溶液在酸性条件下反应的离子方程式_____ 。
| 步骤1 | 步骤2 | 步骤3 | |
| 试剂 | 适量NaBiO3 | 过量的H2O2溶液 | 适量KI-淀粉混合液 |
| 实验现象 | 溶液呈紫红色 | 紫红色消失,产生气泡 | 现象A |
②铋酸钠(NaBiO3)无色,难溶于水;
③淀粉溶液遇到I2变成蓝色。
(1)NaBiO3中Bi的化合价为
(2)请配平步骤2发生反应的化学方程式
 KMnO4+
KMnO4+ H2O2+
H2O2+ H2SO4→
H2SO4→ K2SO4+
K2SO4+ MnSO4+
MnSO4+ O2↑+
O2↑+ ____。
____。(3)步骤2中过量的H2O2可以氧化KI,则步骤3对应的现象A为
(4)由上述现象可得NaBiO3、H2O2、MnO
 、I2的氧化性由强到弱的顺序为
、I2的氧化性由强到弱的顺序为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】用含锌废渣(主要含Zn以及少量S、Fe、Mn、Cd等)制取氧化锌(ZnO)的工艺流程如图
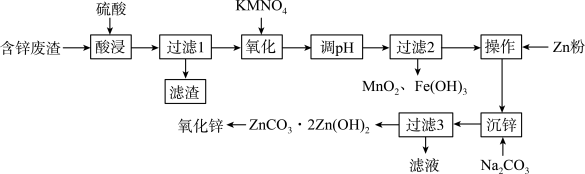
回答下列问题:
(1)“酸浸”时,锌、铁的浸出率如图(a)所示,应控制浸取终点的pH为________ 。
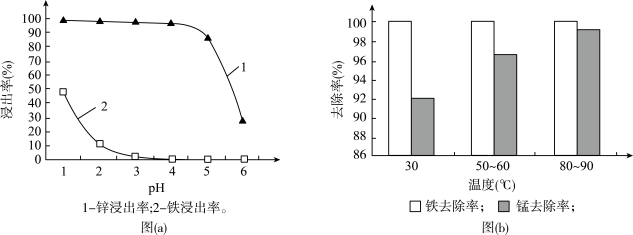
(2)“氧化”时,Fe2+、Mn2+去除率与温度的关系如图(b)所示,相同条件下还原性较强的是________ (填“Fe2+”或“Mn2+”),Fe2+被KMnO4氧化生成Fe3+和MnO2的离子方程式为________ 。
(3)加Zn粉“操作”的目的是________ 。
(4)“沉锌”的离子方程式为________ ,由碱式碳酸锌制备轻质氧化锌的方法是________ 。

回答下列问题:
(1)“酸浸”时,锌、铁的浸出率如图(a)所示,应控制浸取终点的pH为

(2)“氧化”时,Fe2+、Mn2+去除率与温度的关系如图(b)所示,相同条件下还原性较强的是
(3)加Zn粉“操作”的目的是
(4)“沉锌”的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
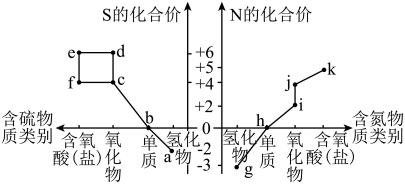
【推荐1】Ⅰ.部分含硫、氮物质的类别与硫元素和氮元素化合价的对应关系如图所示。
回答下列问题:
(1)j的化学名称是___________ 。
(2)下列有关a和g的叙述中,能说明N的非金属性比S强的是___________ (填字母)。
A.物质a的水溶液为酸性,而物质g的水溶液为碱性
B.物质a在300℃左右分解生成b,而物质g分解生成h的温度高于300℃
C.物质a液化的温度为-60℃,而物质g液化的温度为-34℃
(3)将pH=1的物质k的稀溶液倒入物质f的溶液中,会生成物质e,该反应的离子方程式是___________ 。
Ⅱ.S4N4(S是+2价)具有很好的导电性,在光学、电学等行业有着重要的用途。将干燥的物质g通入S2Cl2的CCl4溶液中,可制得该物质:6S2Cl2+16g=S4N4+S8+12NH4Cl(已知S8是硫单质中最稳定的)。
(4)上述制备反应中,物质g体现的性质有___________ ,其中被氧化的元素是___________ (填元素符号)。
(5)S4N4在常温下较稳定,但撞击或加热时会引起爆炸,生成非常稳定的单质产物,该爆炸反应的化学方程式是___________ 。
Ⅲ.二氯化二硫(S2Cl2)可作硫化剂、氯化剂。常温下是一种黄红色液体,沸点137℃,在潮湿的空气中剧烈水解而发烟。S2Cl2可通过硫与少量氯气在110~140℃反应制得,氯气过量则会生成SCl2,S2Cl2遇水剧烈水解,生成SO2、HCl和一种常见的固体。
(6)该固体是___________ (填名称)。
(7)甲同学为了验证两种气体产物,将水解生成的气体依次通过硝酸银与稀硝酸的混合溶液、品红溶液、NaOH溶液,该方案___________ (填“可行”或“不可行”),原因是___________ 。
(8)乙同学按如下实验方案检验S2Cl2是否含有杂质:
①取1.25g产品,在密闭容器中依次加入足量水、双氧水、Ba(NO3)2溶液,过滤;
②往①的滤液中加入足量AgNO3溶液,过滤、洗涤、干燥,称得固体质量为2.87g。
则产品中氯元素的质量分数为___________ ,由此可知产品中___________ (填“含有”或“不含有”)SCl2杂质。

回答下列问题:
(1)j的化学名称是
(2)下列有关a和g的叙述中,能说明N的非金属性比S强的是
A.物质a的水溶液为酸性,而物质g的水溶液为碱性
B.物质a在300℃左右分解生成b,而物质g分解生成h的温度高于300℃
C.物质a液化的温度为-60℃,而物质g液化的温度为-34℃
(3)将pH=1的物质k的稀溶液倒入物质f的溶液中,会生成物质e,该反应的离子方程式是
Ⅱ.S4N4(S是+2价)具有很好的导电性,在光学、电学等行业有着重要的用途。将干燥的物质g通入S2Cl2的CCl4溶液中,可制得该物质:6S2Cl2+16g=S4N4+S8+12NH4Cl(已知S8是硫单质中最稳定的)。
(4)上述制备反应中,物质g体现的性质有
(5)S4N4在常温下较稳定,但撞击或加热时会引起爆炸,生成非常稳定的单质产物,该爆炸反应的化学方程式是
Ⅲ.二氯化二硫(S2Cl2)可作硫化剂、氯化剂。常温下是一种黄红色液体,沸点137℃,在潮湿的空气中剧烈水解而发烟。S2Cl2可通过硫与少量氯气在110~140℃反应制得,氯气过量则会生成SCl2,S2Cl2遇水剧烈水解,生成SO2、HCl和一种常见的固体。
(6)该固体是
(7)甲同学为了验证两种气体产物,将水解生成的气体依次通过硝酸银与稀硝酸的混合溶液、品红溶液、NaOH溶液,该方案
(8)乙同学按如下实验方案检验S2Cl2是否含有杂质:
①取1.25g产品,在密闭容器中依次加入足量水、双氧水、Ba(NO3)2溶液,过滤;
②往①的滤液中加入足量AgNO3溶液,过滤、洗涤、干燥,称得固体质量为2.87g。
则产品中氯元素的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐2】分某研究性学习小组用下图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。
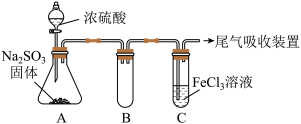
(1)反应开始一段时间后,装置C中的现象为__________ 。
(2)根据以上现象,该小组同学认为SO2与FeCl3溶液发生了氧化还原反应。
① 写出SO2与FeCl3溶液反应的离子方程式:____________ 。
② 向装置C中通入足量SO2发生反应后,检验生成的Fe2+的方法是__________ 。
③该小组同学向反应后的装置C的试管中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,则证明反应生成了SO42-。该做法不合理的理由是__________________ 。
(3)若将装置C中FeCl3溶液更换为Fe(NO3)3和BaCl2的混合液,可观察到装置C中出现白色沉淀,该小组对装置C中产生沉淀的原因提出下列假设(不考虑各因素的叠加):
假设1:装置A中白雾进入装置C中参与反应。
假设2:_______________________ 。
假设3:在酸性条件下NO3-能氧化SO2。
(4)请你设计实验验证上述假设3,写出实验步骤、预期现象和结论。

(1)反应开始一段时间后,装置C中的现象为
(2)根据以上现象,该小组同学认为SO2与FeCl3溶液发生了氧化还原反应。
① 写出SO2与FeCl3溶液反应的离子方程式:
② 向装置C中通入足量SO2发生反应后,检验生成的Fe2+的方法是
③该小组同学向反应后的装置C的试管中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,则证明反应生成了SO42-。该做法不合理的理由是
(3)若将装置C中FeCl3溶液更换为Fe(NO3)3和BaCl2的混合液,可观察到装置C中出现白色沉淀,该小组对装置C中产生沉淀的原因提出下列假设(不考虑各因素的叠加):
假设1:装置A中白雾进入装置C中参与反应。
假设2:
假设3:在酸性条件下NO3-能氧化SO2。
(4)请你设计实验验证上述假设3,写出实验步骤、预期现象和结论。
| 实验步骤(简述操作过程) | 预期现象和结论 |
| ① ② ③ |
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐3】 .某实验小组利用以下装置制取氨气并探究氨气的性质:
.某实验小组利用以下装置制取氨气并探究氨气的性质:___________ 。
(2)装置B中的干燥剂是___________ (填名称)。
(3)实验进行一段时间后,挤压装置D中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是___________ 。
(4)为防止过量氨气外逸,需要在上述装置的末端增加一个尾气吸收装置,应选用的装置是___________ (填“E”、“F”、“G”或“H”)。
 .探究氨气与氧化铜的反应,验证氨气的性质及部分反应产物。
.探究氨气与氧化铜的反应,验证氨气的性质及部分反应产物。
②反应前I装置中CuO质量为8g,反应后I装置中红色固体质量为6.8g,通过计算,写出I装置中发生反应的总方程式为___________ 。
(6)如图所示,若从a处通入 ,
, 溶液中产生白色沉淀,其化学式为
溶液中产生白色沉淀,其化学式为___________ 。若向a处分别通入___________ (填选项),也会产生白色沉淀,其化学式为___________ 。 B.
B. C.
C. D.
D.
 .某实验小组利用以下装置制取氨气并探究氨气的性质:
.某实验小组利用以下装置制取氨气并探究氨气的性质: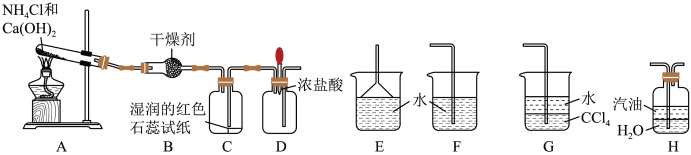
(2)装置B中的干燥剂是
(3)实验进行一段时间后,挤压装置D中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是
(4)为防止过量氨气外逸,需要在上述装置的末端增加一个尾气吸收装置,应选用的装置是
 .探究氨气与氧化铜的反应,验证氨气的性质及部分反应产物。
.探究氨气与氧化铜的反应,验证氨气的性质及部分反应产物。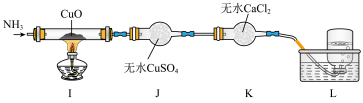
| 序号 | 实验现象 | 实验结论 |
| i | I装置中黑色CuO固体全部变红 | 反应生成了 或 或 |
| ii | J装置中无水 变蓝 变蓝 | 反应生成了 |
| iii | L装置中收集到无色无味气体 | 反应生成了 |
(6)如图所示,若从a处通入
 ,
, 溶液中产生白色沉淀,其化学式为
溶液中产生白色沉淀,其化学式为
 B.
B. C.
C. D.
D.
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐1】废旧太阳能电池CIGS具有较高的回收利用价值,其主要组成为Culn0.5Ga0.5Se2。某探究小组回收处理流程如图:
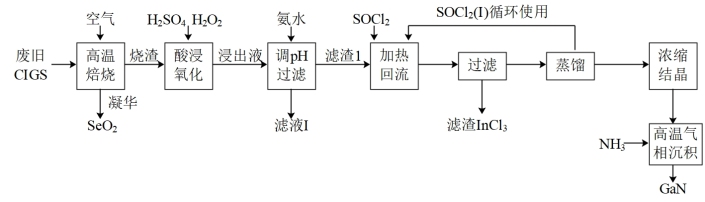
已知:①镓(Ga)和铟(In)位于元素周期表ⅢA族,镓与铝元素相邻。
②硒(Se)位于元素周期表ⅥA族。
回答下列问题:
(1)镓(Ga)原子结构示意图为____ 。
(2)“酸浸氧化”时发生的主要氧化还原反应的离子方程式为____ 。
(3)滤液Ⅰ中所含金属元素名称为_____ 。
(4)“滤渣Ⅰ”与SOCl2混合前需要洗涤、干燥,检验滤渣Ⅰ中SO 是否洗净的操作:
是否洗净的操作:____ ;SOCl2与一定量的水反应能产生两种气体,其中一种气体能使品红溶液褪色,写出SOCl2水解的化学方程式____ ;“加热回流”中SOCl2的作用:一种是将氢氧化物转化为氯化物,另一种是____ 。
(5)浓缩结晶后所得的GaCl3在“高温气相沉积”过程中发生的化学反应方程式为____ 。
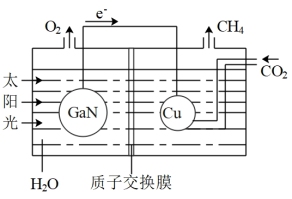
(6)如图表示氮化镓与铜组装成的人工光合系统的电池工作原理。电池工作时H+向_____ (填“左”或“右”)池移动;当电路中转移1.6mol电子时,电池中液体质量_____ (填“增重”还是“减轻”)_____ g。

已知:①镓(Ga)和铟(In)位于元素周期表ⅢA族,镓与铝元素相邻。
②硒(Se)位于元素周期表ⅥA族。
回答下列问题:
(1)镓(Ga)原子结构示意图为
(2)“酸浸氧化”时发生的主要氧化还原反应的离子方程式为
(3)滤液Ⅰ中所含金属元素名称为
(4)“滤渣Ⅰ”与SOCl2混合前需要洗涤、干燥,检验滤渣Ⅰ中SO
 是否洗净的操作:
是否洗净的操作:(5)浓缩结晶后所得的GaCl3在“高温气相沉积”过程中发生的化学反应方程式为
(6)如图表示氮化镓与铜组装成的人工光合系统的电池工作原理。电池工作时H+向

您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐2】下列框图中涉及的物质是中学化学常见的。其相互转化关系如图所示。已知:单质A在单质G中能燃烧,其产物溶于水得L;固体单C可以在B中燃烧;A、B、G通常为气态单质。请回答有关问题:
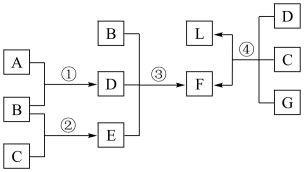
(1)写出B、L的名称:B_________ 、L_________ ;写出F在工业上的任何两点用途_______________________________________ 。
(2)写出③的化学方程式_____________________________ 。
(3)说出形成单质C的元素在元素周期表的位置,第____________ 周期,第_____ 族。
(4)将E通入到某种棕黄色的溶液中也有L、F生成。其反应的离子方程式为_______________________________________ 。
(5)写出④反应的化学方程式____________________ 。

(1)写出B、L的名称:B
(2)写出③的化学方程式
(3)说出形成单质C的元素在元素周期表的位置,第
(4)将E通入到某种棕黄色的溶液中也有L、F生成。其反应的离子方程式为
(5)写出④反应的化学方程式
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】某科研小组采用如下方案回收一种光盘金属层中的少量Ag(金属层中其他金属含量过低,对实验的影响可忽略):
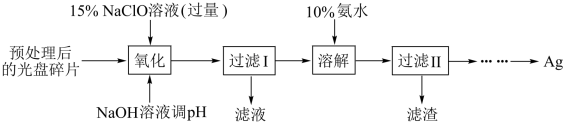
已知:①NaClO溶液与Ag反应的产物为AgCl、NaOH和
②NaClO溶液在受热或酸性条件下易分解: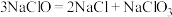
③铜和银是同族相邻元素
请回答下列问题:
(1)“氧化”阶段需在80℃条件下进行,适宜的加热方式为_____ ;
(2)银元素位于元素周期表的第_____ 周期第_____ 族,属于_____ 区;
(3)“溶解”阶段中发生的反应的离子方程式为_____ ;
(4)为提高Ag的回收率,需对“过滤Ⅱ”的滤渣进行洗涤,并将洗涤液合并入_____ ;
(5)若省略“过滤Ⅰ”,直接向冷却后的反应容器中滴加10%氨水,则需要增加氨水的用量,除因过量NaClO与 反应外(该条件下
反应外(该条件下 与
与 不反应),还因为
不反应),还因为_____ 。

已知:①NaClO溶液与Ag反应的产物为AgCl、NaOH和

②NaClO溶液在受热或酸性条件下易分解:
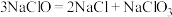
③铜和银是同族相邻元素
请回答下列问题:
(1)“氧化”阶段需在80℃条件下进行,适宜的加热方式为
(2)银元素位于元素周期表的第
(3)“溶解”阶段中发生的反应的离子方程式为
(4)为提高Ag的回收率,需对“过滤Ⅱ”的滤渣进行洗涤,并将洗涤液合并入
(5)若省略“过滤Ⅰ”,直接向冷却后的反应容器中滴加10%氨水,则需要增加氨水的用量,除因过量NaClO与
 反应外(该条件下
反应外(该条件下 与
与 不反应),还因为
不反应),还因为
您最近一年使用:0次
【推荐1】以经焙烧处理的锌冶炼钴渣(主要含有 、
、 、
、 、
、 ,少量
,少量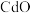 、
、 、
、 、
、 、
、 、
、 等杂质)为原料制备电池级
等杂质)为原料制备电池级 、
、 混合液的工艺流程如下:
混合液的工艺流程如下:
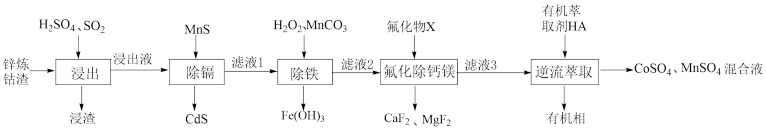
已知:常温下,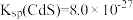 ,
,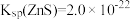 。
。
回答下列问题:
(1)“浸渣”的主要成分是___________ 。
(2)“浸出”时, 转化为
转化为 ,写出该反应的离子方程式
,写出该反应的离子方程式___________ 。
(3)若溶液中金属离子浓度为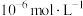 ,则认为该离子可忽略不计或沉淀完全。“除镉”时,为了确保
,则认为该离子可忽略不计或沉淀完全。“除镉”时,为了确保 恰好沉淀完全而
恰好沉淀完全而 不沉淀,
不沉淀,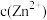 的值有何要求?
的值有何要求?___________ (列式计算说明)。
(4)“氟化物 ”为___________(填标号)。
”为___________(填标号)。
(5)萃取时,发生反应: 。采取“逆流萃取”的作用是
。采取“逆流萃取”的作用是___________ ,有机相可通过硫酸处理后得到的副产品为___________ (填化学式)。
 、
、 、
、 、
、 ,少量
,少量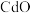 、
、 、
、 、
、 、
、 、
、 等杂质)为原料制备电池级
等杂质)为原料制备电池级 、
、 混合液的工艺流程如下:
混合液的工艺流程如下:
已知:常温下,
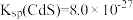 ,
,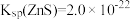 。
。回答下列问题:
(1)“浸渣”的主要成分是
(2)“浸出”时,
 转化为
转化为 ,写出该反应的离子方程式
,写出该反应的离子方程式(3)若溶液中金属离子浓度为
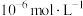 ,则认为该离子可忽略不计或沉淀完全。“除镉”时,为了确保
,则认为该离子可忽略不计或沉淀完全。“除镉”时,为了确保 恰好沉淀完全而
恰好沉淀完全而 不沉淀,
不沉淀,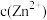 的值有何要求?
的值有何要求?(4)“氟化物
 ”为___________(填标号)。
”为___________(填标号)。A. | B. | C. | D. |
 。采取“逆流萃取”的作用是
。采取“逆流萃取”的作用是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐2】实验室里用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁[Fe2(OH)n(SO4)3—n/2]m和绿矾(FeSO4·7H2O),其过程如下:

(1)过程①中,FeS和O2、H2SO4反应的化学方程式是_____________________ 。
(2)验证固体W焙烧后产生的气体含有SO2的方法是___________________ 。
(3)制备绿矾时,向溶液X中加入过量________ ,充分反应后,经______ 操作得到溶液Y,再经浓缩、结晶等步骤得到绿矾。
(4)溶液Z的pH将影响聚铁中铁的质量分数,若溶液Z的pH偏小,将导致聚铁中铁的质量分数偏____ (填“高”或“低”),过程②中将溶液加热到70~80 ℃的目的是___ 。

(1)过程①中,FeS和O2、H2SO4反应的化学方程式是
(2)验证固体W焙烧后产生的气体含有SO2的方法是
(3)制备绿矾时,向溶液X中加入过量
(4)溶液Z的pH将影响聚铁中铁的质量分数,若溶液Z的pH偏小,将导致聚铁中铁的质量分数偏
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐3】碘是人类生命必需的微量元素,主要来源于海产品。
完成下列填空:
通过水浴加热蒸馏碘的CCl4溶液回收CCl4,收集得到浅红色的液体。再向该液体中加入少量活性炭,静
置。待溶液浅红色消失。操作Y,即可得无色的CCl4液体。
(1)蒸馏时用到的玻璃仪器有酒精灯、蒸馏烧瓶、烧杯、锥形瓶、______ 、______ 等。
(2)收集得到浅红色的液体,说明收集得到的液体中含有______ (化学式),操作Y的名称是________ 。
利用活性炭可以提高提碘后母液中碘的回收利用。如图是模拟该方法的流程:

(3)操作A利用了碘单质_______ 的性质将碘单质和炭柱分离。
(4)活性炭在该实验方法中起到的作用是________________________________________ 。
(5)相对于蒸馏分离,评价活性炭吸附碘单质方法的两个优点:___________ 、___________ 。
(6)工业上选择NaNO2作为提碘母液的氧化剂,反应生成NO,则NaNO2与母液中NaI的质量比应不少于____________ 。
取研细的I2、KClO3各0.02mol置于锥形瓶中,慢慢加入浓盐酸,直到I2完全消失,没有黄绿色气体产生。将锥形瓶置于冰水中,有卤素互化物A析出,剩余溶液中只检出K+和Cl-。若将A水浴加热,产生红棕色液体B和黄绿色气体。(已知:卤素互化物是指不同卤素之间形成的化合物)
(7)试确定A的化学式:____________________ 。写出简要的推理过程:_______________ 。
(8)能否确定B的化学式? 说明理由_______________ 。
完成下列填空:
通过水浴加热蒸馏碘的CCl4溶液回收CCl4,收集得到浅红色的液体。再向该液体中加入少量活性炭,静
置。待溶液浅红色消失。操作Y,即可得无色的CCl4液体。
(1)蒸馏时用到的玻璃仪器有酒精灯、蒸馏烧瓶、烧杯、锥形瓶、
(2)收集得到浅红色的液体,说明收集得到的液体中含有
利用活性炭可以提高提碘后母液中碘的回收利用。如图是模拟该方法的流程:

(3)操作A利用了碘单质
(4)活性炭在该实验方法中起到的作用是
(5)相对于蒸馏分离,评价活性炭吸附碘单质方法的两个优点:
(6)工业上选择NaNO2作为提碘母液的氧化剂,反应生成NO,则NaNO2与母液中NaI的质量比应不少于
取研细的I2、KClO3各0.02mol置于锥形瓶中,慢慢加入浓盐酸,直到I2完全消失,没有黄绿色气体产生。将锥形瓶置于冰水中,有卤素互化物A析出,剩余溶液中只检出K+和Cl-。若将A水浴加热,产生红棕色液体B和黄绿色气体。(已知:卤素互化物是指不同卤素之间形成的化合物)
(7)试确定A的化学式:
(8)能否确定B的化学式? 说明理由
您最近一年使用:0次



