回答下列问题:
(1)已知稀溶液中,1 mol H2SO4与2 mol NaOH恰好完全反应时,放出114.6kJ热量,写出该反应表示中和热的热化学方程式:_______ 。
(2)利用甲烷的还原性,可以对大气中的氮氧化合物进行处理。已知一定条件下:
①4 NO(g)=2 NO2(g)+N2(g) △H1=- 293 kJ·mol-l
②CH4(g)+4NO(g)=2 N2(g)+CO2(g)+2H2O(g) △H2= - 1160 kJ·mol-1
则CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=_______ kJ·mol-1,该反应能在_______ 下自发进行。(选填“低温”、“高温”或“任何温度”)
(3)①恒温恒容的密闭容器中,发生反应CO (g)+H2S(g)⇌COS (g) +H2 (g), 若反应前只充10molCO和xmolH2S,达到平衡时CO的物质的量为8mol,且化学平衡常数为0.1,则x=_______ mol。
②恒温恒容时,能表明Fe2O3(s)+3CO(g)⇌2Fe(s)+3CO2(g)达平衡状态的是_______ (填字母)
A.单位时间内生成n molCO同时消耗n molCO2
B. c(CO)不随时间改变
C. CO2的体积分数不变
D. Fe 的浓度不变
E.容器内压强不再变化
F.正反应的平衡常数不再变化
G.气体的总质量不再变化
(4)某种新工艺装置是氯碱工业装置和另一种电化学装置组合而成,相关物料的传输与转化关系如下图所示,其中电极未标出,所用的离子交换膜都只允许阳离子通过。
_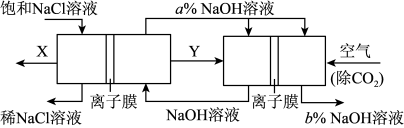
图中物质Y的电子式_______ , 图中b%_______ a%(填“<”或“>”或“=”),通入除去CO2的空气一极的电极反应式为_______ 。
(1)已知稀溶液中,1 mol H2SO4与2 mol NaOH恰好完全反应时,放出114.6kJ热量,写出该反应表示中和热的热化学方程式:
(2)利用甲烷的还原性,可以对大气中的氮氧化合物进行处理。已知一定条件下:
①4 NO(g)=2 NO2(g)+N2(g) △H1=- 293 kJ·mol-l
②CH4(g)+4NO(g)=2 N2(g)+CO2(g)+2H2O(g) △H2= - 1160 kJ·mol-1
则CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=
(3)①恒温恒容的密闭容器中,发生反应CO (g)+H2S(g)⇌COS (g) +H2 (g), 若反应前只充10molCO和xmolH2S,达到平衡时CO的物质的量为8mol,且化学平衡常数为0.1,则x=
②恒温恒容时,能表明Fe2O3(s)+3CO(g)⇌2Fe(s)+3CO2(g)达平衡状态的是
A.单位时间内生成n molCO同时消耗n molCO2
B. c(CO)不随时间改变
C. CO2的体积分数不变
D. Fe 的浓度不变
E.容器内压强不再变化
F.正反应的平衡常数不再变化
G.气体的总质量不再变化
(4)某种新工艺装置是氯碱工业装置和另一种电化学装置组合而成,相关物料的传输与转化关系如下图所示,其中电极未标出,所用的离子交换膜都只允许阳离子通过。
_

图中物质Y的电子式
更新时间:2022-09-27 22:58:07
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
【推荐1】有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,其中B是地壳中含量最多的元素。已知A、C及B、E分别是同主族元素,且B、E两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍。处于同周期的C、D、E元素中,D是该周期金属元素中金属性最弱的元素。
(1)试比较C、D两元素最高价氧化物对应水化物碱性的强弱(填化学式)______ >_______ ;
(2) A、B、C形成的化合物的晶体类型为__________ ;电子式为__________ ;
(3)写出D单质与C元素最高价氧化物对应水化物反应的离子方程式___________ ;
(4)写出两种均含A、B、C、E四种元素的化合物在溶液中相互反应、且生成气体的离子方程式_________________________ ;
(5)A单质和B单质能构成电池,该电池用多孔惰性电极浸入浓KOH溶液,两极分别通入A单质和B单质,写出该电池负极电极反应方程式_______________ ;
(6)通常条件下,C的最高价氧化物对应水化物2mol与E最高价氧化物对应水化物1mol的稀溶液间反应放出的热量为114.6kJ,试写出表示该热量变化的离子方程式__________ 。
(1)试比较C、D两元素最高价氧化物对应水化物碱性的强弱(填化学式)
(2) A、B、C形成的化合物的晶体类型为
(3)写出D单质与C元素最高价氧化物对应水化物反应的离子方程式
(4)写出两种均含A、B、C、E四种元素的化合物在溶液中相互反应、且生成气体的离子方程式
(5)A单质和B单质能构成电池,该电池用多孔惰性电极浸入浓KOH溶液,两极分别通入A单质和B单质,写出该电池负极电极反应方程式
(6)通常条件下,C的最高价氧化物对应水化物2mol与E最高价氧化物对应水化物1mol的稀溶液间反应放出的热量为114.6kJ,试写出表示该热量变化的离子方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】某学习小组拟用如图所示装置来间接测定醋酸的电离热(即1 mol CH3COOH完全电离所吸收的热量),原理如下:

I.测定强酸与强碱的中和热
取50 mL 0.55 mol·L-1的NaOH溶液和50 mL 0.50 mol·L-1的HCl溶液进行反应。
(1)仪器a的名称___________ 。
(2)NaOH溶液稍过量的原因是___________ 。
(3)测得反应前后体系的温度值(℃)分别为T0、T1,则该过程放出的热量为______ J(反应放出的热量Q可用公式Q =cρV总·ΔT计算,其中c和ρ分别取4.18J·g-1·℃-1和1.0g·mL-1,忽略水以外各物质的热量,下同)。
(4)①已知:H+(aq)+OH-(aq)= H2O(l) ΔH=-57.3 kJ·mol-1,实验I测得中和热数值偏低,产生偏差的原因可能为______ (填字母)。
A.实验装置保温、隔热效果差
B.用量筒量取酸和碱溶液的体积时均仰视读数
C.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
D.读取混合液的最高温度记为反应后体系的温度值
②实验室中盐酸和NaOH溶液已耗尽,请推荐一种酸______ 和一种碱______ 替代。
Ⅱ.测定醋酸与NaOH溶液的中和热
取50 mL 0.55 mol·L-1的NaOH溶液和50 mL 0.50 mol·L-1的醋酸溶液反应,测定反应放出的热量。
(5)实验I测得ΔH中和= -a kJ·mol-1,实验Ⅱ测得ΔH’中和=-b kJ·mol-1。写出表示醋酸电离热的电离方程式___________ (ΔH用含a、b的计算式表示)。

I.测定强酸与强碱的中和热
取50 mL 0.55 mol·L-1的NaOH溶液和50 mL 0.50 mol·L-1的HCl溶液进行反应。
(1)仪器a的名称
(2)NaOH溶液稍过量的原因是
(3)测得反应前后体系的温度值(℃)分别为T0、T1,则该过程放出的热量为
(4)①已知:H+(aq)+OH-(aq)= H2O(l) ΔH=-57.3 kJ·mol-1,实验I测得中和热数值偏低,产生偏差的原因可能为
A.实验装置保温、隔热效果差
B.用量筒量取酸和碱溶液的体积时均仰视读数
C.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
D.读取混合液的最高温度记为反应后体系的温度值
②实验室中盐酸和NaOH溶液已耗尽,请推荐一种酸
Ⅱ.测定醋酸与NaOH溶液的中和热
取50 mL 0.55 mol·L-1的NaOH溶液和50 mL 0.50 mol·L-1的醋酸溶液反应,测定反应放出的热量。
(5)实验I测得ΔH中和= -a kJ·mol-1,实验Ⅱ测得ΔH’中和=-b kJ·mol-1。写出表示醋酸电离热的电离方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】Ⅰ中和热的测定:测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
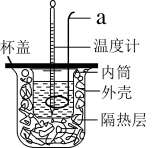
(1)仪器a的名称为_______ ,实验中还需要用到的玻璃仪器是_______ 。
(2)用相同浓度和体积的氨水代替 溶液进行上述实验,测得的中和热数值会偏小,原因为
溶液进行上述实验,测得的中和热数值会偏小,原因为_______ 。
Ⅱ.在试管中进行溶液间反应时,同学们无法观察到 转化为
转化为 ,于是又设计了如下实验(电压表读数:
,于是又设计了如下实验(电压表读数: )。
)。
注:其他条件不变时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大;离子的氧化性(或还原性)强弱与其浓度有关。
(3)步骤ⅰ中,B中石墨上的电极反应式是_______ 。
(4)结合信息,解释实验步骤ⅳ中 的原因
的原因_______ 。
(5)能说明 转化为
转化为 的实验现象是
的实验现象是_______ 。

(1)仪器a的名称为
(2)用相同浓度和体积的氨水代替
 溶液进行上述实验,测得的中和热数值会偏小,原因为
溶液进行上述实验,测得的中和热数值会偏小,原因为Ⅱ.在试管中进行溶液间反应时,同学们无法观察到
 转化为
转化为 ,于是又设计了如下实验(电压表读数:
,于是又设计了如下实验(电压表读数: )。
)。| 装置 | 步骤 | 电压表读数 |
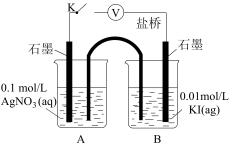 | ⅰ.如图连接装置并加入试剂,闭合K | a |
ⅱ.向B中滴入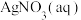 ,至沉淀完全 ,至沉淀完全 | b | |
ⅲ.再向B中投入一定量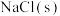 | c | |
ⅳ.重复ⅰ,再向B中加入与ⅲ等量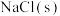 | a |
(3)步骤ⅰ中,B中石墨上的电极反应式是
(4)结合信息,解释实验步骤ⅳ中
 的原因
的原因(5)能说明
 转化为
转化为 的实验现象是
的实验现象是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】 的综合利用是实现碳中和、碳达峰的重要措施之一、中科院的科学家已实现实验室条件下
的综合利用是实现碳中和、碳达峰的重要措施之一、中科院的科学家已实现实验室条件下 到汽油及淀粉的合成。
到汽油及淀粉的合成。 和
和 合成甲醇是人工合成淀粉的第一步,请根据信息回答下列问题。
合成甲醇是人工合成淀粉的第一步,请根据信息回答下列问题。
I.
(1)某课题小组研究了不同催化剂对反应 的影响。下图是某铜基催化剂催化该反应的反应历程。反应过程中
的影响。下图是某铜基催化剂催化该反应的反应历程。反应过程中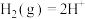 共发生了
共发生了___________ 次。生成 的化学方程式为
的化学方程式为___________ ,该反应与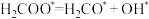 相比,在同一条件更
相比,在同一条件更___________ (填“难”或“易”)进行。

二氧化碳加氢制甲醇反应在铜基催化剂催化作用下的反应历程
II. 和
和 一定条件下可以合成甲醇,但是该过程往往存在副反应ⅱ。
一定条件下可以合成甲醇,但是该过程往往存在副反应ⅱ。
反应i:
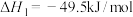
反应ii:

(2)已知反应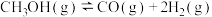
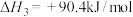 ,则
,则
_____  。
。
(3)恒压下将 和
和 按体积比
按体积比 混合,在不同催化剂作用下发生反应ⅰ和反应ⅱ,在相同的时间段内
混合,在不同催化剂作用下发生反应ⅰ和反应ⅱ,在相同的时间段内 的选择性和产率随温度的变化如图。
的选择性和产率随温度的变化如图。

已知: 选择性
选择性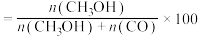 100%。
100%。
①在上述条件下合成甲醇的工业条件是___________ 。
a.210℃ b.230℃ c.CZT催化剂 d.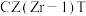 催化剂
催化剂
②在230℃以上,升高温度甲醇的产率降低,但 的转化率增大,原因是
的转化率增大,原因是___________ 。
(4)温度为T℃时,在一个刚性容器中模拟工业上合成 ,往容器中通入
,往容器中通入 、
、 进行反应,反应过程中容器内的压强随着时间变化如下表所示。
进行反应,反应过程中容器内的压强随着时间变化如下表所示。
①请计算反应开始至 的平均反应速率
的平均反应速率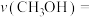
___________ 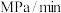 。
。
②此时 的选择性为80%,则反应ⅰ的压强平衡常数
的选择性为80%,则反应ⅰ的压强平衡常数
___________  (只列计算式,压强平衡常数;用平衡分压代替平衡浓度,分压=总压×气体物质的量分数)。
(只列计算式,压强平衡常数;用平衡分压代替平衡浓度,分压=总压×气体物质的量分数)。
 的综合利用是实现碳中和、碳达峰的重要措施之一、中科院的科学家已实现实验室条件下
的综合利用是实现碳中和、碳达峰的重要措施之一、中科院的科学家已实现实验室条件下 到汽油及淀粉的合成。
到汽油及淀粉的合成。 和
和 合成甲醇是人工合成淀粉的第一步,请根据信息回答下列问题。
合成甲醇是人工合成淀粉的第一步,请根据信息回答下列问题。I.
(1)某课题小组研究了不同催化剂对反应
 的影响。下图是某铜基催化剂催化该反应的反应历程。反应过程中
的影响。下图是某铜基催化剂催化该反应的反应历程。反应过程中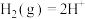 共发生了
共发生了 的化学方程式为
的化学方程式为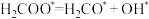 相比,在同一条件更
相比,在同一条件更
二氧化碳加氢制甲醇反应在铜基催化剂催化作用下的反应历程
II.
 和
和 一定条件下可以合成甲醇,但是该过程往往存在副反应ⅱ。
一定条件下可以合成甲醇,但是该过程往往存在副反应ⅱ。反应i:

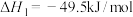
反应ii:


(2)已知反应
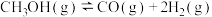
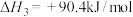 ,则
,则
 。
。(3)恒压下将
 和
和 按体积比
按体积比 混合,在不同催化剂作用下发生反应ⅰ和反应ⅱ,在相同的时间段内
混合,在不同催化剂作用下发生反应ⅰ和反应ⅱ,在相同的时间段内 的选择性和产率随温度的变化如图。
的选择性和产率随温度的变化如图。
已知:
 选择性
选择性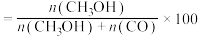 100%。
100%。①在上述条件下合成甲醇的工业条件是
a.210℃ b.230℃ c.CZT催化剂 d.
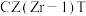 催化剂
催化剂②在230℃以上,升高温度甲醇的产率降低,但
 的转化率增大,原因是
的转化率增大,原因是(4)温度为T℃时,在一个刚性容器中模拟工业上合成
 ,往容器中通入
,往容器中通入 、
、 进行反应,反应过程中容器内的压强随着时间变化如下表所示。
进行反应,反应过程中容器内的压强随着时间变化如下表所示。时间 | 0 | 10 | 20 | 30 | 40 | 50 |
压强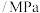 | 120 | 105 | 95 | 90 | 88 | 88 |
 的平均反应速率
的平均反应速率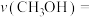
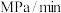 。
。②此时
 的选择性为80%,则反应ⅰ的压强平衡常数
的选择性为80%,则反应ⅰ的压强平衡常数
 (只列计算式,压强平衡常数;用平衡分压代替平衡浓度,分压=总压×气体物质的量分数)。
(只列计算式,压强平衡常数;用平衡分压代替平衡浓度,分压=总压×气体物质的量分数)。
您最近一年使用:0次
【推荐2】肼(N2H4)作为火箭发射的燃料助力神舟十七号载人飞船发射取得圆满成功。回答下列问题:
(1)以Fe2+配合物为催化中心,可实现NH2OH与NH3转化为N2H4,反应历程如下所示:___________ ,形成的化学键是___________ (填标号)。
a.N-H键 b.O-H键 c.N-O键 d.N-N键
②若将NH2OH替换为ND2OD,反应所得含氮物质是___________ 。
(2)键能是指气态分子中lmol化学键解离成气态原子所吸收的能量。已知部分化学键的键能如下表所示:
则N2H4(g)和O2(g)反应的热化学方程式是___________ 。
若用F2(g)代替O2(g)作氧化剂,反应释放的能量更大。
已知:H2(g)+F2(g)=2HF(g) H =-538kJ/mol
H =-538kJ/mol
2H2(g)+O2(g)=2H2O(g) H =-484kJ/mol
H =-484kJ/mol
则N2H4(g)+2F2(g)=N2(g)+4HF(g)的 H =
H =_______ kJ/mol。
(3)N2H4是二元弱碱,在水中的电离方式与NH3相似。N2H4第二步电离的方程式是________ ,N2H4与H2SO4形成正盐的化学式是___________ 。
(1)以Fe2+配合物为催化中心,可实现NH2OH与NH3转化为N2H4,反应历程如下所示:
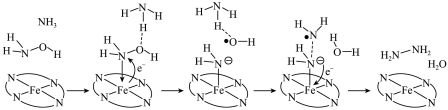
a.N-H键 b.O-H键 c.N-O键 d.N-N键
②若将NH2OH替换为ND2OD,反应所得含氮物质是
(2)键能是指气态分子中lmol化学键解离成气态原子所吸收的能量。已知部分化学键的键能如下表所示:
| 化学键 | N-H | O-H | O=O | N≡N | N-N |
| 键能/(kJ·mol-1) | 391 | 463 | 497 | 945 | 193 |
若用F2(g)代替O2(g)作氧化剂,反应释放的能量更大。
已知:H2(g)+F2(g)=2HF(g)
 H =-538kJ/mol
H =-538kJ/mol2H2(g)+O2(g)=2H2O(g)
 H =-484kJ/mol
H =-484kJ/mol则N2H4(g)+2F2(g)=N2(g)+4HF(g)的
 H =
H =(3)N2H4是二元弱碱,在水中的电离方式与NH3相似。N2H4第二步电离的方程式是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】阅读题目,回答问题。
(1)已知: P4(s)+6Cl2(g)=4PCl3(g) ΔH=akJ·mol-1, P4(s)+10Cl2(g)=4PCl5(g) ΔH=b kJ·mol-1,P4具有正四面体结构,PCl5中P—Cl键的键能为c kJ·mol-1,PCl3中P—Cl键的键能为1.2c kJ·mol-1。请回答:PCl3(g)和氯气反应生成PCl5(g)的热化学方程式为________________________________ ,Cl—Cl 键的键能为_________________________ 。
(2)离子液体是一种室温熔融盐非水体系。由有机阳离子、Al2Cl7-利AlCl4-组成的离子液体作电解液时,可在钢制品上电镀铝。则钢制品应接电源的__________ 极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为_________________________ 。
(3)人工肾脏可用间接电化学方法除去代谢产物中的尿素,原理如图

①电源的负极为_____________ (填“A”或“B”)。
②阳极室中发生的反应为_____________________ ,______________________ 。
③电解结束后,阴极室溶液的pH 与电解前相比将____________________ 。
(1)已知: P4(s)+6Cl2(g)=4PCl3(g) ΔH=akJ·mol-1, P4(s)+10Cl2(g)=4PCl5(g) ΔH=b kJ·mol-1,P4具有正四面体结构,PCl5中P—Cl键的键能为c kJ·mol-1,PCl3中P—Cl键的键能为1.2c kJ·mol-1。请回答:PCl3(g)和氯气反应生成PCl5(g)的热化学方程式为
(2)离子液体是一种室温熔融盐非水体系。由有机阳离子、Al2Cl7-利AlCl4-组成的离子液体作电解液时,可在钢制品上电镀铝。则钢制品应接电源的
(3)人工肾脏可用间接电化学方法除去代谢产物中的尿素,原理如图

①电源的负极为
②阳极室中发生的反应为
③电解结束后,阴极室溶液的pH 与电解前相比将
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】尿素[CO(NH2)2][s]是首个由无机物人工合成的有机物。
(1)在尿素合成塔中发生的反应可表示为2NH3(g)+CO2(g) NH2COONH4(l)
NH2COONH4(l)  H1=-119.2 kJ∙mol-1;NH2COONH4(l)
H1=-119.2 kJ∙mol-1;NH2COONH4(l) CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)  H2=+15.5kJ∙mol-1,已知第一步反应为快速反应,第二步反应为慢速反应,则2NH3(g)+CO2(g)
H2=+15.5kJ∙mol-1,已知第一步反应为快速反应,第二步反应为慢速反应,则2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)  H3=
H3=___________ kJ∙mol-1,下列图象能表示尿素合成塔中发生反应的能量变化历程的是___________ (填标号)。
A .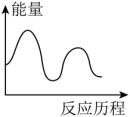 B.
B. 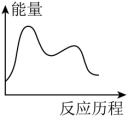 C.
C. 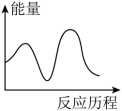 D.
D.
(2)T℃,在2L的密闭容器中,通入2molNH3和1molCO2,保持体积不变,发生反应,2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g),10min时反应刚好达到平衡。测得起始压强为平衡时压强的1.5倍,则:
CO(NH2)2(s)+H2O(g),10min时反应刚好达到平衡。测得起始压强为平衡时压强的1.5倍,则:
①NH3的平衡转化率为___________ 。
②能说明上述反应达到平衡状态的是___________ (填标号)。
A.n(CO2):n(NH3)=1:2
B.混合气体的密度不再发生变化
C.CO2的体积分数在混合气体中保持不变
D.单位时间内消耗2molNH3,同时生成1molH2O
(3)一定温度下,某恒容密闭容器中发生反应2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g),若原料气中
CO(NH2)2(s)+H2O(g),若原料气中 =m,测得m与CO2的平衡转化率(α)的关系如图所示:
=m,测得m与CO2的平衡转化率(α)的关系如图所示:
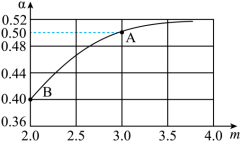
若平衡时A点容器内总压强为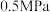 ,则上述反应的平衡常数Kp=
,则上述反应的平衡常数Kp=___________  。(用平衡分压代平衡浓度计算,分压=总压×物质的量分数)
。(用平衡分压代平衡浓度计算,分压=总压×物质的量分数)
(1)在尿素合成塔中发生的反应可表示为2NH3(g)+CO2(g)
 NH2COONH4(l)
NH2COONH4(l)  H1=-119.2 kJ∙mol-1;NH2COONH4(l)
H1=-119.2 kJ∙mol-1;NH2COONH4(l) CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)  H2=+15.5kJ∙mol-1,已知第一步反应为快速反应,第二步反应为慢速反应,则2NH3(g)+CO2(g)
H2=+15.5kJ∙mol-1,已知第一步反应为快速反应,第二步反应为慢速反应,则2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)  H3=
H3=A .
 B.
B.  C.
C.  D.
D.
(2)T℃,在2L的密闭容器中,通入2molNH3和1molCO2,保持体积不变,发生反应,2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g),10min时反应刚好达到平衡。测得起始压强为平衡时压强的1.5倍,则:
CO(NH2)2(s)+H2O(g),10min时反应刚好达到平衡。测得起始压强为平衡时压强的1.5倍,则:①NH3的平衡转化率为
②能说明上述反应达到平衡状态的是
A.n(CO2):n(NH3)=1:2
B.混合气体的密度不再发生变化
C.CO2的体积分数在混合气体中保持不变
D.单位时间内消耗2molNH3,同时生成1molH2O
(3)一定温度下,某恒容密闭容器中发生反应2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g),若原料气中
CO(NH2)2(s)+H2O(g),若原料气中 =m,测得m与CO2的平衡转化率(α)的关系如图所示:
=m,测得m与CO2的平衡转化率(α)的关系如图所示:
若平衡时A点容器内总压强为
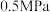 ,则上述反应的平衡常数Kp=
,则上述反应的平衡常数Kp= 。(用平衡分压代平衡浓度计算,分压=总压×物质的量分数)
。(用平衡分压代平衡浓度计算,分压=总压×物质的量分数)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】汽车尾气净化器中的主要反应: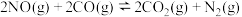 ,某科研小组在
,某科研小组在 密闭容器中充入
密闭容器中充入 和
和 ,对该反应进行了一系列的研究,在一定温度
,对该反应进行了一系列的研究,在一定温度 下,测得
下,测得 随时间
随时间 变化的曲线如图所示。
变化的曲线如图所示。
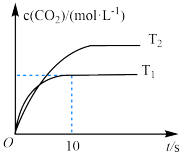
(1)该反应的
___________ 0(填“>”“<”或“=”)。下列选项中,能说明该反应达到平衡状态的依据是___________ 。
A. B.
B. 的浓度不再变化
的浓度不再变化
C.混合气体的平均相对分子质量不再改变 D.混合气体密度不变
(2)在温度为 时,若反应从开始到
时,若反应从开始到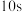 时
时 的平均反应速率
的平均反应速率 则
则
___________ ,此温度下平衡常数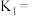
___________ ,平衡时,向此容器中再通入 和
和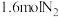 ,则平衡
,则平衡___________ (填“向正反应方向”“向逆反应方向”或“不”)移动,原因是___________ 。
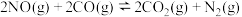 ,某科研小组在
,某科研小组在 密闭容器中充入
密闭容器中充入 和
和 ,对该反应进行了一系列的研究,在一定温度
,对该反应进行了一系列的研究,在一定温度 下,测得
下,测得 随时间
随时间 变化的曲线如图所示。
变化的曲线如图所示。
(1)该反应的

A.
 B.
B. 的浓度不再变化
的浓度不再变化C.混合气体的平均相对分子质量不再改变 D.混合气体密度不变
(2)在温度为
 时,若反应从开始到
时,若反应从开始到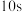 时
时 的平均反应速率
的平均反应速率 则
则
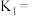
 和
和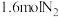 ,则平衡
,则平衡
您最近一年使用:0次
【推荐3】国内外目前生产苯乙烯的方法主要是乙烯脱氢法,反应原理为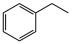 (g)
(g)
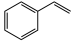 (g)+ H2(g)
(g)+ H2(g) 。
。
(1)已知:部分化学键的键能数据如下表所示:
则
_____ 。
(2)实际生产过程中,通常向乙苯中掺入水蒸气,保持体系总压为常压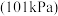 的条件下进行反应、乙苯的平衡转化率与温度、投料比
的条件下进行反应、乙苯的平衡转化率与温度、投料比 的关系如图所示。
的关系如图所示。

①掺入水蒸气的目的是_____ 。
②投料比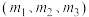 由大到小的顺序为
由大到小的顺序为_____ 。
③若投料比 ,反应温度为
,反应温度为 ,并保持体系总压为常压的条件下进行反应,下列事实不能作为该反应达到平衡的依据的是
,并保持体系总压为常压的条件下进行反应,下列事实不能作为该反应达到平衡的依据的是_____ (填字母)。
a、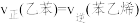
b、容器内气体密度不再变化
c、容器内气体的平均相对分子质量不再变化
d、苯乙烯的体积分数不再变化
e、容器内苯乙烯与 的物质的量之比不再变化
的物质的量之比不再变化
④若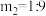 ,保持体系总压为常压
,保持体系总压为常压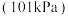 ,则A点温度下,该反应的平衡常数
,则A点温度下,该反应的平衡常数
_____  (列出计算式即可,
(列出计算式即可, 为用平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数);若其他条件不变,将A点对应起始反应物置于某恒容密闭容器中,则乙苯的平衡转化率
为用平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数);若其他条件不变,将A点对应起始反应物置于某恒容密闭容器中,则乙苯的平衡转化率_____ (填“>”“<”或“=”)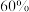 。
。
(3)近年来,用 作为温和氧化剂,选择性氧化乙苯制苯乙烯的绿色反应体系不断取得新进展,在
作为温和氧化剂,选择性氧化乙苯制苯乙烯的绿色反应体系不断取得新进展,在 气氛下,乙苯脱氢反应可能存在一步法和二步法两种途径,如图所示。
气氛下,乙苯脱氢反应可能存在一步法和二步法两种途径,如图所示。
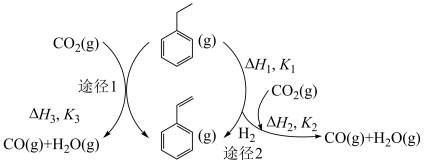
则CO2(g)+ (g)
(g)
 (g)+CO(g)+H2O(g),反应的平衡常数
(g)+CO(g)+H2O(g),反应的平衡常数
_____ (用含 、
、 的代数式表示)。
的代数式表示)。
(4)某光电催化反应器如图所示,A极是 电极,B极是
电极,B极是 电极。写出A极由
电极。写出A极由 制异丙醇的电极反应式:
制异丙醇的电极反应式:_____ 。

 (g)
(g)
 (g)+ H2(g)
(g)+ H2(g) 。
。(1)已知:部分化学键的键能数据如下表所示:
| 共价键 | 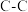 |  | 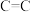 |  |
键能 | 347.7 | 413.4 | 615 | 436 |
则

(2)实际生产过程中,通常向乙苯中掺入水蒸气,保持体系总压为常压
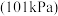 的条件下进行反应、乙苯的平衡转化率与温度、投料比
的条件下进行反应、乙苯的平衡转化率与温度、投料比 的关系如图所示。
的关系如图所示。
①掺入水蒸气的目的是
②投料比
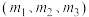 由大到小的顺序为
由大到小的顺序为③若投料比
 ,反应温度为
,反应温度为 ,并保持体系总压为常压的条件下进行反应,下列事实不能作为该反应达到平衡的依据的是
,并保持体系总压为常压的条件下进行反应,下列事实不能作为该反应达到平衡的依据的是a、
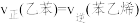
b、容器内气体密度不再变化
c、容器内气体的平均相对分子质量不再变化
d、苯乙烯的体积分数不再变化
e、容器内苯乙烯与
 的物质的量之比不再变化
的物质的量之比不再变化④若
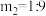 ,保持体系总压为常压
,保持体系总压为常压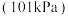 ,则A点温度下,该反应的平衡常数
,则A点温度下,该反应的平衡常数
 (列出计算式即可,
(列出计算式即可, 为用平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数);若其他条件不变,将A点对应起始反应物置于某恒容密闭容器中,则乙苯的平衡转化率
为用平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数);若其他条件不变,将A点对应起始反应物置于某恒容密闭容器中,则乙苯的平衡转化率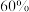 。
。(3)近年来,用
 作为温和氧化剂,选择性氧化乙苯制苯乙烯的绿色反应体系不断取得新进展,在
作为温和氧化剂,选择性氧化乙苯制苯乙烯的绿色反应体系不断取得新进展,在 气氛下,乙苯脱氢反应可能存在一步法和二步法两种途径,如图所示。
气氛下,乙苯脱氢反应可能存在一步法和二步法两种途径,如图所示。
则CO2(g)+
 (g)
(g)
 (g)+CO(g)+H2O(g),反应的平衡常数
(g)+CO(g)+H2O(g),反应的平衡常数
 、
、 的代数式表示)。
的代数式表示)。(4)某光电催化反应器如图所示,A极是
 电极,B极是
电极,B极是 电极。写出A极由
电极。写出A极由 制异丙醇的电极反应式:
制异丙醇的电极反应式:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】氯碱工业是以电解饱和食盐水为基础的化学工业。
I.电解所用的氯化钠溶液需精制,除去有影响的Ca2+、Mg2+、NH4+、SO42-及泥沙,其精制流程如下:
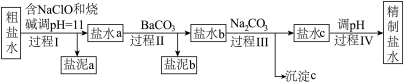
已知:①Ca2+、Mg2+开始形成相应氢氧化物沉淀的pH如下表。
②Ksp(BaSO4)= 1.1×10-10,Ksp(BaCO3)=2.6×10-9,Ksp(CaCO3)=5.0×10-9。
(1)盐泥a除泥沙外,还含有____________________________________ 。
(2)过程I中,NaClO的作用是将NH4+转化为N2,反应的离子方程式为________________________ 。
(3)过程III中,沉淀c主要成分的化学式为________________________ 。
(4)过程IV调pH目的是____________ 。
II.如图是将电解池与燃料电池相组合电解精制饱和食盐水的新工艺,可以节(电)能30%以上。相关物料的传输与转化关系如图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
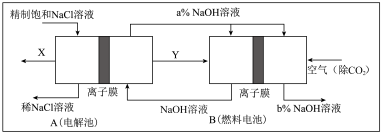
(1)图中X是____________ (填化学式)。
(2)Y在装置B中发生的电极反应式为____________ 。
(3)写出A装置中发生的总反应离子方程式____________ ,比较图示中氧氧化钠溶液质量分数a%与b%的大小:________________________ 。
(4)若用装置B作为装置A的辅助电源,每当消耗标准状况下氧气的体积为11.2L时,则装置B可向装置A提供的电量约为____________ (一个e-的电量为1.60×10-19C;计算结果精确到0.01)。
I.电解所用的氯化钠溶液需精制,除去有影响的Ca2+、Mg2+、NH4+、SO42-及泥沙,其精制流程如下:

已知:①Ca2+、Mg2+开始形成相应氢氧化物沉淀的pH如下表。
| Ca(OH)2 | Mg(OH)2 | |
| pH | ≥11.5 | ≥9.2 |
②Ksp(BaSO4)= 1.1×10-10,Ksp(BaCO3)=2.6×10-9,Ksp(CaCO3)=5.0×10-9。
(1)盐泥a除泥沙外,还含有
(2)过程I中,NaClO的作用是将NH4+转化为N2,反应的离子方程式为
(3)过程III中,沉淀c主要成分的化学式为
(4)过程IV调pH目的是
II.如图是将电解池与燃料电池相组合电解精制饱和食盐水的新工艺,可以节(电)能30%以上。相关物料的传输与转化关系如图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。

(1)图中X是
(2)Y在装置B中发生的电极反应式为
(3)写出A装置中发生的总反应离子方程式
(4)若用装置B作为装置A的辅助电源,每当消耗标准状况下氧气的体积为11.2L时,则装置B可向装置A提供的电量约为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
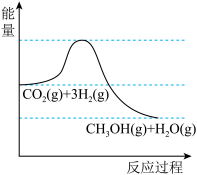
【推荐2】以CO2生产甲醇(CH3OH)是实现“碳中和”的重要途径。其原理是CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。
(1)该反应的能量变化如图所示,该反应为_______ (填“放热”或“吸热”)反应。
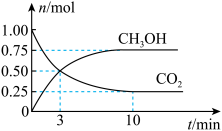
(3)在体积为2L的密闭容器中,充入1molCO2和3molH2,测得CO2、CH3OH的物质的量随时间变化如图。反应达到平衡状态,此时H2的转化率为_______ 。不能 说明该反应已达平衡状态的是_______。
(5)用CH3OH和O2组合形成的质子交换膜燃料电池的结构如图。_______ (填“正极”或“负极”),电极d的电极反应式_______ 。
②若线路中转移1mol电子,则该燃料电池理论上消耗的O2在标准状况下的体积为_______ L。
(1)该反应的能量变化如图所示,该反应为
| A.升高温度 | B.充入He | C.加入合适的催化剂 | D.降低压强 |
| A.CO2、H2的浓度均不再变化 |
| B.体系压强不变 |
| C.n(CH3OH)∶n(H2O)=1∶1 |
| D.H2的消耗速率与CH3OH的生成速率之比为3∶1 |

②若线路中转移1mol电子,则该燃料电池理论上消耗的O2在标准状况下的体积为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】硫一碘循环分解水制氢主要涉及下列反应:
Ⅰ.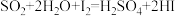
Ⅱ.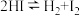
Ⅲ.
(1)分析上述反应,下列判断正确的是___________ 。
a.反应Ⅲ易在常温下进行 b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O d.循环过程产生1 mol O2的同时产生1 molH2
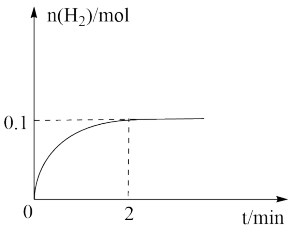
(2)一定温度下,向1L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。该温度下, 的平衡常数K=
的平衡常数K=___________ 。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则平衡后,_________ 是原来的2倍。
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡___________ 移动(填“向左”“向右”或“不”);若加入少量下列试剂中的___________ ,产生 的速率将增大。
的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制作氢氧燃料电池。已知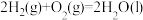
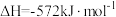 某氢氧燃料电池释放228.8 kJ电能时,生成1 mol液态水,该电池的能量转化率为
某氢氧燃料电池释放228.8 kJ电能时,生成1 mol液态水,该电池的能量转化率为___________ 。
Ⅰ.
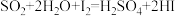
Ⅱ.
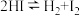
Ⅲ.

(1)分析上述反应,下列判断正确的是
a.反应Ⅲ易在常温下进行 b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O d.循环过程产生1 mol O2的同时产生1 molH2
(2)一定温度下,向1L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。该温度下,
 的平衡常数K=
的平衡常数K=
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡
 的速率将增大。
的速率将增大。a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制作氢氧燃料电池。已知
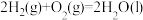
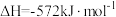 某氢氧燃料电池释放228.8 kJ电能时,生成1 mol液态水,该电池的能量转化率为
某氢氧燃料电池释放228.8 kJ电能时,生成1 mol液态水,该电池的能量转化率为
您最近一年使用:0次



