用低品铜矿(主要含CuS、FeO)制备Cu2O的一种流程如下:
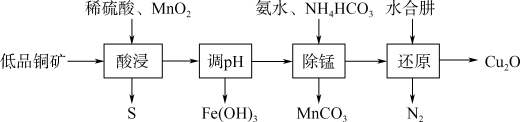
(1)“酸浸”中CuS发生反应的化学方程式为_______ 。
(2)写出基态Mn2+的核外电子排布式_______ 。
(3)“调pH”后溶液pH约4,此时溶液Fe3+物质的量浓度为_______ 。[Ksp[Fe(OH)3]=1×10-38]
(4)“除锰”时的离子方程式为_______ 。
(5)“还原”前需测定铜氨离子{[Cu(NH3)4]2+}的浓度来确定水合肼的用量。20.0mL除去Mn2+的铜氨溶液于100mL容量瓶中,加水稀释至刻度;准确量取25.00mL稀释后的溶液于锥形瓶中,滴加3mol·L-1H2SO4至pH为3~4,加入过量KI固体。以淀粉溶液为指示剂,生成的碘用0.1000mol·L-1Na2S2O3标准溶液滴定至终点(反应为2Cu2++4I-=2CuI+I2,I2+2S2O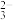 =2I-+S4O
=2I-+S4O ),重复2~3次,平均消耗Na2S2O3标准溶液22.00mL。计算铜氨溶液的物质的量浓度
),重复2~3次,平均消耗Na2S2O3标准溶液22.00mL。计算铜氨溶液的物质的量浓度_______ 。
(6)保持其它条件不变,水合肼浓度对Cu2O的产率的影响如图所示。水合肼浓度大于3.25mol·L-1时Cu2O的产率下降,[Cu(NH3)4]2+的转化率仍增大,可能的原因是_______ 。

(1)“酸浸”中CuS发生反应的化学方程式为
(2)写出基态Mn2+的核外电子排布式
(3)“调pH”后溶液pH约4,此时溶液Fe3+物质的量浓度为
(4)“除锰”时的离子方程式为
(5)“还原”前需测定铜氨离子{[Cu(NH3)4]2+}的浓度来确定水合肼的用量。20.0mL除去Mn2+的铜氨溶液于100mL容量瓶中,加水稀释至刻度;准确量取25.00mL稀释后的溶液于锥形瓶中,滴加3mol·L-1H2SO4至pH为3~4,加入过量KI固体。以淀粉溶液为指示剂,生成的碘用0.1000mol·L-1Na2S2O3标准溶液滴定至终点(反应为2Cu2++4I-=2CuI+I2,I2+2S2O
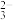 =2I-+S4O
=2I-+S4O ),重复2~3次,平均消耗Na2S2O3标准溶液22.00mL。计算铜氨溶液的物质的量浓度
),重复2~3次,平均消耗Na2S2O3标准溶液22.00mL。计算铜氨溶液的物质的量浓度(6)保持其它条件不变,水合肼浓度对Cu2O的产率的影响如图所示。水合肼浓度大于3.25mol·L-1时Cu2O的产率下降,[Cu(NH3)4]2+的转化率仍增大,可能的原因是

更新时间:2022/10/18 20:46:05
|
相似题推荐
【推荐1】硫氰化钾(KSCN)是一种用途广泛的化学药品,常用于合成树脂、杀虫杀菌剂等。某实验小组用下图所示的装置制备硫氰化钾。
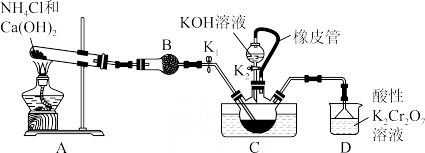
已知CS2是一种难溶于水的无色液体,密度为1.26g/cm3,NH3难溶于CS2。回答下列问题:
(1)制备NH4SCN溶液:三颈烧瓶内盛放有CS2、水和催化剂,实验开始时,打开K1(K2处于关闭状态),加热装置A、C,使A中产生的氨气缓缓通入到三颈烧瓶中,反应至CS2消失,反应的化学方程式为:CS2+3NH3= NH4SCN+NH4HS。
NH4SCN+NH4HS。
①仪器B的名称是_______ 。
②三颈烧瓶左侧导管口必须插入到下层的CS2液体中,主要原因是_______ (写出一条原因即可)。
(2)制备KSCN溶液:
①熄灭A处的酒精灯,关闭K1,移开水浴,将装置C继续加热至105℃,NH4HS完全分解后(化学方程式为NH4HS NH3↑+H2S↑),打开K2,继续保持溶液温度为105℃,缓缓滴入适量的KOH溶液,制得KSCN溶液。反应的化学方程式为
NH3↑+H2S↑),打开K2,继续保持溶液温度为105℃,缓缓滴入适量的KOH溶液,制得KSCN溶液。反应的化学方程式为_______ 。
②装置D可用于处理尾气,已知酸性重铬酸钾溶液能将H2S氧化生成浅黄色沉淀,铬元素被还原为Cr3+,写出其氧化H2S的离子方程式_______ 。
(3)制备KSCN晶体:先滤去三颈烧瓶中的固体催化剂,再减压蒸发浓缩_______ 、过滤、洗涤、干燥,得到硫氰化钾晶体。
(4)测定产品纯度:准确称取W g KSCN样品,配成250.0 mL溶液;另取25.00 mLc mol·L-1AgNO3标准溶液于锥形瓶中,并加入少量稀硝酸和NH4Fe(SO4)2溶液,用KSCN溶液滴定AgNO3,AgNO3恰好完全转化为AgSCN沉淀时,消耗KSCN溶液V mL。
①将称得的样品配制成溶液,所使用的仪器除烧杯和玻璃棒外还有_______ 。;在滴定管中装入KSCN溶液的前一步,应进行的操作为_______ ;NH4Fe(SO4)2溶液的作用是_______ 。
②产品中KSCN质量分数为_______ (列出计算式,KSCN摩尔质量为97 g/mol);若其它操作正确,在滴定终点读取滴定管刻度时,俯视滴定管内液体液面,则最后测定结果_______ (填“偏大”“偏小”或“不受影响”)。

已知CS2是一种难溶于水的无色液体,密度为1.26g/cm3,NH3难溶于CS2。回答下列问题:
(1)制备NH4SCN溶液:三颈烧瓶内盛放有CS2、水和催化剂,实验开始时,打开K1(K2处于关闭状态),加热装置A、C,使A中产生的氨气缓缓通入到三颈烧瓶中,反应至CS2消失,反应的化学方程式为:CS2+3NH3=
 NH4SCN+NH4HS。
NH4SCN+NH4HS。①仪器B的名称是
②三颈烧瓶左侧导管口必须插入到下层的CS2液体中,主要原因是
(2)制备KSCN溶液:
①熄灭A处的酒精灯,关闭K1,移开水浴,将装置C继续加热至105℃,NH4HS完全分解后(化学方程式为NH4HS
 NH3↑+H2S↑),打开K2,继续保持溶液温度为105℃,缓缓滴入适量的KOH溶液,制得KSCN溶液。反应的化学方程式为
NH3↑+H2S↑),打开K2,继续保持溶液温度为105℃,缓缓滴入适量的KOH溶液,制得KSCN溶液。反应的化学方程式为②装置D可用于处理尾气,已知酸性重铬酸钾溶液能将H2S氧化生成浅黄色沉淀,铬元素被还原为Cr3+,写出其氧化H2S的离子方程式
(3)制备KSCN晶体:先滤去三颈烧瓶中的固体催化剂,再减压蒸发浓缩
(4)测定产品纯度:准确称取W g KSCN样品,配成250.0 mL溶液;另取25.00 mLc mol·L-1AgNO3标准溶液于锥形瓶中,并加入少量稀硝酸和NH4Fe(SO4)2溶液,用KSCN溶液滴定AgNO3,AgNO3恰好完全转化为AgSCN沉淀时,消耗KSCN溶液V mL。
①将称得的样品配制成溶液,所使用的仪器除烧杯和玻璃棒外还有
②产品中KSCN质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】可溶性氯化物中氯含量的测定常采用莫尔法,此法是以K2CrO4为指示剂,用AgNO3标准溶液进行滴定。其实验步骤为:
一、配制0.100mol·L-1AgNO3溶液
准确称取AgNO38.50g,溶于500mL不含氯离子的蒸馏水中,摇匀后,贮存于带玻璃塞的棕色试剂瓶中。
二、0.100mol·L-1AgNO3溶液的标定
准确称取0.585g NaCl于100mL烧杯中,用蒸馏水溶解后,定量转移入100mL容量瓶中,加水稀释至刻度,摇匀。
取所配NaCl溶液25.00mL 3份,分别置于锥形瓶中,加25mL水,1mL 5% K2CrO4溶液,在不断摇动下用AgNO3溶液滴定,至溶液呈砖红色[2Ag++CrO42-=Ag2CrO4↓(砖红色)]。实验测得三次所耗硝酸银溶液体积的平均值为26.32mL。
三、氯化物试样中氯的测定
准确移取25.00mL氯化物试液3份,分别置于锥形瓶中,加入25mL水,1mL 5% K2CrO4溶液,在不断摇动下用AgNO3标准溶液滴定至溶液呈砖红色。实验测得三次所耗硝酸银溶液的体积的平均值为VmL。
回答下列问题:
(1)NaCl固体使用前,要将其置于坩埚中加热,并用_____ 不断搅拌,以除掉氯化钠晶体中的水。
(2)AgNO3溶液需要标定的主要原因是__________________ 。
(3)指示剂CrO42-在溶液中存在下列的平衡:2H++2CrO42- 2HCrO4-
2HCrO4- Cr2O72-+H2O,由此判断该滴定适宜的pH值范围可能是
Cr2O72-+H2O,由此判断该滴定适宜的pH值范围可能是___ 。(填代号)
A.1——6.5 B.6.5——10.5 C.10.5——14
(4)用硝酸银滴定氯离子达到化学计量点时,c(Ag+)=c(Cl-),若此时要求不生成Ag2CrO4沉淀,c(CrO42-)最大不能超过________ mol·L-1,因此,实验中对指示剂的浓度有较高的要求。(已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.8×10-12)
(5)CrO42-的黄色对滴定终点的判断没有影响的原因是_______________ 。
(6)AgNO3标准溶液的准确浓度为_____ mol·L-1,列出计算可溶性氯化物试液中氯元素的含量的式子:____________ g·L-1。
一、配制0.100mol·L-1AgNO3溶液
准确称取AgNO38.50g,溶于500mL不含氯离子的蒸馏水中,摇匀后,贮存于带玻璃塞的棕色试剂瓶中。
二、0.100mol·L-1AgNO3溶液的标定
准确称取0.585g NaCl于100mL烧杯中,用蒸馏水溶解后,定量转移入100mL容量瓶中,加水稀释至刻度,摇匀。
取所配NaCl溶液25.00mL 3份,分别置于锥形瓶中,加25mL水,1mL 5% K2CrO4溶液,在不断摇动下用AgNO3溶液滴定,至溶液呈砖红色[2Ag++CrO42-=Ag2CrO4↓(砖红色)]。实验测得三次所耗硝酸银溶液体积的平均值为26.32mL。
三、氯化物试样中氯的测定
准确移取25.00mL氯化物试液3份,分别置于锥形瓶中,加入25mL水,1mL 5% K2CrO4溶液,在不断摇动下用AgNO3标准溶液滴定至溶液呈砖红色。实验测得三次所耗硝酸银溶液的体积的平均值为VmL。
回答下列问题:
(1)NaCl固体使用前,要将其置于坩埚中加热,并用
(2)AgNO3溶液需要标定的主要原因是
(3)指示剂CrO42-在溶液中存在下列的平衡:2H++2CrO42-
 2HCrO4-
2HCrO4- Cr2O72-+H2O,由此判断该滴定适宜的pH值范围可能是
Cr2O72-+H2O,由此判断该滴定适宜的pH值范围可能是A.1——6.5 B.6.5——10.5 C.10.5——14
(4)用硝酸银滴定氯离子达到化学计量点时,c(Ag+)=c(Cl-),若此时要求不生成Ag2CrO4沉淀,c(CrO42-)最大不能超过
(5)CrO42-的黄色对滴定终点的判断没有影响的原因是
(6)AgNO3标准溶液的准确浓度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】[Ni(NH3)x]Cly可用于镀镍。某实验小组欲制备[Ni(NH3)x]Cly,并测定产品的化学式。已知[Ni(NH3)x]Cly易溶于冷水、稀氨水,不溶于浓氨水,乙醚、乙醇,在潮湿空气中易生成Ni(OH)2;乙醚的挥发性强于乙醇;Ag2CrO4是一种难溶于水的砖红色晶体。
Ⅰ.制备[Ni(NH3)x]Cly
①将镍粉用浓硝酸溶解,获得Ni(NO3)2溶液。
②向Ni(NO3)2溶液中缓慢加入浓氨水,冰水浴冷却结晶,过滤、洗涤。
③将所得沉淀移入如图装置,加入浓盐酸使沉淀溶解,冷却后慢慢加入浓氨水和NH4Cl的混合液,充分反应,过滤,分别用三种洗涤剂依次洗涤、干燥。
Ⅱ.测定[Ni(NH3)x]Cly的化学式
④氯含量的测定:准确称取0.232g产品,用蒸馏水溶解后,加入过量硝酸,用NaOH溶液调节pH=7,加入少量K2CrO4作指示剂,用0.1mol/LAgNO3标准溶液滴定,三次滴定平均消耗标准溶液20.00mL。
⑤氨含量测定;准确称取0.232g产品于锥形瓶中,加入25.00mL过量盐酸溶解,加入指示剂甲基红(变色pH范围为4.4~6.2),三次滴定平均消耗0.5mol/L标准NaOH溶液13.00mL;另取25.00mL上述盐酸,加入指示剂甲基红,三次滴定平均消耗0.5mol/L标准NaOH溶液25.00mL。
回答下列问题:_______ 。
(2)装置b中最适宜的试剂是_______(填标号)。
(3)步骤③选用洗涤剂的洗涤顺序为_______ 。
(4)步骤④中滴定前用标准液润洗滴定管的操作是:从滴定管上口加入3~5mL标准液,_______ ,将液体从滴定管下部放入预置烧杯中。判断步骤④滴定终点的现象是_______ 。
(5)实验测得的[Ni(NH3)x]Cly的
_______ ,
_______ 。
Ⅰ.制备[Ni(NH3)x]Cly
①将镍粉用浓硝酸溶解,获得Ni(NO3)2溶液。
②向Ni(NO3)2溶液中缓慢加入浓氨水,冰水浴冷却结晶,过滤、洗涤。
③将所得沉淀移入如图装置,加入浓盐酸使沉淀溶解,冷却后慢慢加入浓氨水和NH4Cl的混合液,充分反应,过滤,分别用三种洗涤剂依次洗涤、干燥。
Ⅱ.测定[Ni(NH3)x]Cly的化学式
④氯含量的测定:准确称取0.232g产品,用蒸馏水溶解后,加入过量硝酸,用NaOH溶液调节pH=7,加入少量K2CrO4作指示剂,用0.1mol/LAgNO3标准溶液滴定,三次滴定平均消耗标准溶液20.00mL。
⑤氨含量测定;准确称取0.232g产品于锥形瓶中,加入25.00mL过量盐酸溶解,加入指示剂甲基红(变色pH范围为4.4~6.2),三次滴定平均消耗0.5mol/L标准NaOH溶液13.00mL;另取25.00mL上述盐酸,加入指示剂甲基红,三次滴定平均消耗0.5mol/L标准NaOH溶液25.00mL。
回答下列问题:

(2)装置b中最适宜的试剂是_______(填标号)。
| A.NaOH溶液 | B.浓盐酸 | C.蒸馏水 | D.浓硫酸 |
(3)步骤③选用洗涤剂的洗涤顺序为
(4)步骤④中滴定前用标准液润洗滴定管的操作是:从滴定管上口加入3~5mL标准液,
(5)实验测得的[Ni(NH3)x]Cly的


您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】铁(Fe)、钴(Co)、镍(Ni)是第四周期第Ⅷ族的元素,在化学上称为铁系元素,其化合物在生产生活中应用广泛。
(1)基态Ni原子的核外电子排布式为___ 。
(2)铁系元素能与CO形成Fe(CO)5、Ni(CO)4等金属羰基化合物。已知室温时Fe(CO)5为浅黄色液体,沸点103℃,则Fe(CO)5中含有的化学键类型包括___ 。
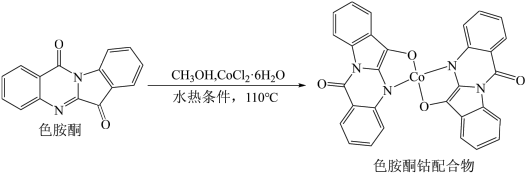
(3)以甲醇为溶剂,Co3+可与色胺酮分子配位结合形成对DNA具有切割作用的色胺酮钴配合物(合成过程如图所示)。色氨酮分子中N原子的杂化类型为___ 。X射线衍射分析显示色胺酮钴配合物晶胞中还含有一个CH3OH分子,CH3OH是通过___ 作用与色胺酮钴配合物相结合。 ,
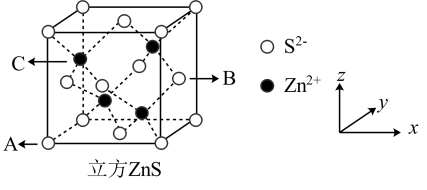
, ),则C点的原子坐标为
),则C点的原子坐标为___ 。
②立方ZnS的晶胞参数a=541pm,则其晶体密度为___ g•cm-3。(列出计算表达式)
(1)基态Ni原子的核外电子排布式为
(2)铁系元素能与CO形成Fe(CO)5、Ni(CO)4等金属羰基化合物。已知室温时Fe(CO)5为浅黄色液体,沸点103℃,则Fe(CO)5中含有的化学键类型包括
| A.极性共价键 | B.离子键 | C.配位键 | D.金属键 |
 ,
, ),则C点的原子坐标为
),则C点的原子坐标为②立方ZnS的晶胞参数a=541pm,则其晶体密度为
您最近一年使用:0次
【推荐2】催化剂的研究一直是一个重要的领域。根据所学知识,回答下列问题:
I.铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有 、
、 、
、 、
、 、
、 等氧化物中的几种。
等氧化物中的几种。
(1)基态氧原子中,核外电子有___________ 种空间运动状态,能量最高的电子的电子云在空间有___________ 个伸展方向。
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用“ ”表示,与之相反的用“
”表示,与之相反的用“ ”表示,
”表示,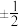 即称为电子的自旋磁量子数。对于基态的铁原子,其价层电子自旋磁量子数的代数和为
即称为电子的自旋磁量子数。对于基态的铁原子,其价层电子自旋磁量子数的代数和为___________ 。
Ⅱ.我国科研人员研制出了 (M为
(M为 、等金属)等催化剂,使得合成氨工业的温度、压强分别降到了
、等金属)等催化剂,使得合成氨工业的温度、压强分别降到了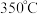 、
、 ,这是近年来合成氨反应研究中的重要突破。
,这是近年来合成氨反应研究中的重要突破。
(3) 在元素周期表中位于
在元素周期表中位于___________ 区。
(4)第三电离能:
___________ (填“ ”或“
”或“ ”)
”) ,原因是
,原因是___________ 。
Ⅲ. 、
、 、
、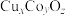 、
、 是常见的无机非贵金属光催化剂等。
是常见的无机非贵金属光催化剂等。
(5)铜元素的焰色试验呈绿色,下列三种波长为橙、黄、绿色对应的波长,则其中绿色对应的辐射波长为___________ (填标号)。
A.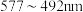 B.
B.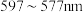 C.
C.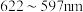
I.铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有
 、
、 、
、 、
、 、
、 等氧化物中的几种。
等氧化物中的几种。(1)基态氧原子中,核外电子有
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用“
 ”表示,与之相反的用“
”表示,与之相反的用“ ”表示,
”表示,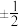 即称为电子的自旋磁量子数。对于基态的铁原子,其价层电子自旋磁量子数的代数和为
即称为电子的自旋磁量子数。对于基态的铁原子,其价层电子自旋磁量子数的代数和为Ⅱ.我国科研人员研制出了
 (M为
(M为 、等金属)等催化剂,使得合成氨工业的温度、压强分别降到了
、等金属)等催化剂,使得合成氨工业的温度、压强分别降到了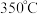 、
、 ,这是近年来合成氨反应研究中的重要突破。
,这是近年来合成氨反应研究中的重要突破。(3)
 在元素周期表中位于
在元素周期表中位于(4)第三电离能:

 ”或“
”或“ ”)
”) ,原因是
,原因是Ⅲ.
 、
、 、
、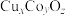 、
、 是常见的无机非贵金属光催化剂等。
是常见的无机非贵金属光催化剂等。(5)铜元素的焰色试验呈绿色,下列三种波长为橙、黄、绿色对应的波长,则其中绿色对应的辐射波长为
A.
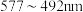 B.
B.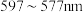 C.
C.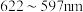
您最近一年使用:0次
【推荐3】元素及其化合物在生产、生活和科研中应用广泛。回答下列问题:
(1)砷在元素周期表中位于___________ 区,其基态价电子排布式为___________
(2)烟火燃放过程中会产生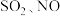 等有毒气体。硫原子最高能级电子云轮廓图的形状是
等有毒气体。硫原子最高能级电子云轮廓图的形状是___________ ,N、O、S原子的第一电离能由大到小的顺序是___________
(3)向 溶液中通入过量氨气可以生成
溶液中通入过量氨气可以生成 ,
, 电子式为
电子式为___________ 比较 键中键角大小,
键中键角大小,
___________  (填“<,>或=”),
(填“<,>或=”), 与
与 均为三角锥形分子,
均为三角锥形分子, 分子中的氮原子不易与
分子中的氮原子不易与 形成配离子,从电负性角度分析其原因是
形成配离子,从电负性角度分析其原因是___________
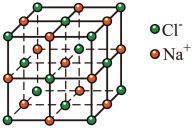
(4)已知 (晶胞如图所示)晶胞的密度为
(晶胞如图所示)晶胞的密度为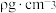 ,
, 的摩尔质量为
的摩尔质量为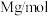 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则在
,则在 晶体里
晶体里 和
和 的最短距离为
的最短距离为___________ pm。
(1)砷在元素周期表中位于
(2)烟火燃放过程中会产生
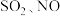 等有毒气体。硫原子最高能级电子云轮廓图的形状是
等有毒气体。硫原子最高能级电子云轮廓图的形状是(3)向
 溶液中通入过量氨气可以生成
溶液中通入过量氨气可以生成 ,
, 电子式为
电子式为 键中键角大小,
键中键角大小,
 (填“<,>或=”),
(填“<,>或=”), 与
与 均为三角锥形分子,
均为三角锥形分子, 分子中的氮原子不易与
分子中的氮原子不易与 形成配离子,从电负性角度分析其原因是
形成配离子,从电负性角度分析其原因是(4)已知
 (晶胞如图所示)晶胞的密度为
(晶胞如图所示)晶胞的密度为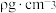 ,
, 的摩尔质量为
的摩尔质量为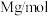 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则在
,则在 晶体里
晶体里 和
和 的最短距离为
的最短距离为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】已知:钴金属元素常见化合价为+2和+3,CoCl2易溶于水。回答下列问题:
(1)甲同学用 与盐酸反应制备
与盐酸反应制备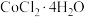 ,其实验装置如下:
,其实验装置如下:
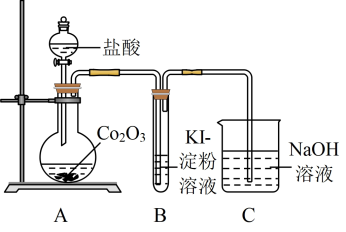
①A中发生反应的离子方程式为_______ 。盐酸体现出的性质有_______ 。
②C中氢氧化钠溶液的作用是_______ 。
(2)乙同学利用如图装置检验乙酸钴结晶水合物在氮气气氛中的分解产物,其中E、F、G中的试剂均足量。已知PdCl2溶液能被CO还原为Pd。
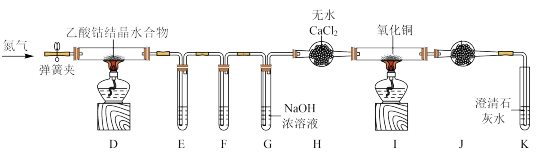
①装置E中试剂的作用是_______ 。
②经分析知分解产物还有C2H6,已知C2H6在较高温度下具有还原性,则上述实验中可确定有C2H6生成的现象是_______ 。
③反应完后持续通N2的作用是_______ 。
(1)甲同学用
 与盐酸反应制备
与盐酸反应制备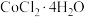 ,其实验装置如下:
,其实验装置如下:
①A中发生反应的离子方程式为
②C中氢氧化钠溶液的作用是
(2)乙同学利用如图装置检验乙酸钴结晶水合物在氮气气氛中的分解产物,其中E、F、G中的试剂均足量。已知PdCl2溶液能被CO还原为Pd。

①装置E中试剂的作用是
②经分析知分解产物还有C2H6,已知C2H6在较高温度下具有还原性,则上述实验中可确定有C2H6生成的现象是
③反应完后持续通N2的作用是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】利用硫酸厂烧渣(含铁的氧化物和少量FeS及SiO2)制碱式硫酸铁的流程如下:

(1)SO2与过量NaOH溶液反应的离子方程式为_____________ 。
(2)滤渣的主要成分为________ (填化学式)。
(3)反应1中加双氧水的目的是将Fe2+氧化为Fe3+,该反应的离子方程式为________ 。
(4)碱式硫酸铁的化学式为Fex(OH)y(SO4)z·nH2O,为确定其组成进行如下实验:
①称取1.6920g样品溶于足量的稀盐酸中;
②加足量的BaCl2溶液,过滤、洗涤、干燥、称重,得固体质量为2.3300g;
③向步骤②的滤液中加过量的NaOH溶液,过滤、洗涤、灼烧、称重,得固体质量为0.6400g。
根据以上实验数据确定该碱式硫酸铁的化学式_________ (写出计算过程)。

(1)SO2与过量NaOH溶液反应的离子方程式为
(2)滤渣的主要成分为
(3)反应1中加双氧水的目的是将Fe2+氧化为Fe3+,该反应的离子方程式为
(4)碱式硫酸铁的化学式为Fex(OH)y(SO4)z·nH2O,为确定其组成进行如下实验:
①称取1.6920g样品溶于足量的稀盐酸中;
②加足量的BaCl2溶液,过滤、洗涤、干燥、称重,得固体质量为2.3300g;
③向步骤②的滤液中加过量的NaOH溶液,过滤、洗涤、灼烧、称重,得固体质量为0.6400g。
根据以上实验数据确定该碱式硫酸铁的化学式
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】某无色透明溶液X含有以下离子中的若干种: 、
、 、
、 、
、 、
、 、
、 、
、 、
、 。为确定其成分,进行如下实验(假设气体均全部逸出,且体积折合为标准状况):
。为确定其成分,进行如下实验(假设气体均全部逸出,且体积折合为标准状况):
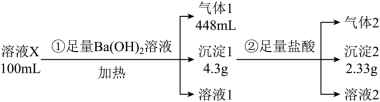
回答下列问题:
(1)溶液X中一定不含的阳离子是___________ 。
(2)“沉淀1”的成分是___________ (填化学式),②中产生气体2反应的化学方程式为___________ 。
(3)溶液X中___________ (填“存在”或“不存在”) 。若存在
。若存在 ,则
,则 的物质的量浓度至少为
的物质的量浓度至少为___________  (若不存在
(若不存在 ,则该空不填)。
,则该空不填)。
 、
、 、
、 、
、 、
、 、
、 、
、 、
、 。为确定其成分,进行如下实验(假设气体均全部逸出,且体积折合为标准状况):
。为确定其成分,进行如下实验(假设气体均全部逸出,且体积折合为标准状况):
回答下列问题:
(1)溶液X中一定不含的阳离子是
(2)“沉淀1”的成分是
(3)溶液X中
 。若存在
。若存在 ,则
,则 的物质的量浓度至少为
的物质的量浓度至少为 (若不存在
(若不存在 ,则该空不填)。
,则该空不填)。
您最近一年使用:0次



