某小组同学探究 与
与 溶液的反应。
溶液的反应。
(1)实验Ⅰ:用如下装置(夹持、加热仪器略)制备 ,将
,将 通入
通入 溶液中。
溶液中。 ;静置9h后,溶液变为浅绿色。
;静置9h后,溶液变为浅绿色。
①浓 与Cu反应的化学方程式是
与Cu反应的化学方程式是_______ 。
②试剂a是_______ 。
(2)分析C中溶液颜色变化的原因。
①溶液颜色由黄色最终变为浅绿色的原因是_______ 。(写离子方程式)。
②针对溶液颜色变为红棕色,提出了两种假设。
假设1:主要与 、
、 有关。
有关。
假设2:主要与 、
、 有关。
有关。
实验Ⅱ证实假设1不成立,假设2成立。
实验Ⅱ:向 溶液中加入
溶液中加入 溶液,
溶液,_______ (填现象),然后滴加_______ (填试剂),溶液变为黄色。
(3)进一步探究 与
与 、
、 显红棕色的原因。
显红棕色的原因。
查阅资料: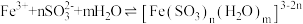 (红棕色)
(红棕色)
实验Ⅲ:向 溶液中滴加
溶液中滴加 溶液,溶液由黄色变成红棕色,析出大量橙黄色沉淀。
溶液,溶液由黄色变成红棕色,析出大量橙黄色沉淀。
甲同学认为橙黄色沉淀中可能含有 、
、 、
、 ,并设计如下检验方案。
,并设计如下检验方案。 溶液褪色不能证明橙黄色沉淀中含有
溶液褪色不能证明橙黄色沉淀中含有 ,理由是
,理由是_______ 。
②实验证实橙黄色沉淀中含有 、不含
、不含 ,试剂b、c分别是
,试剂b、c分别是_______ 、_______ 。
(4)实验反思:实验I静置5min后溶液颜色由红棕色变回黄色可能的原因是_______ 。
 与
与 溶液的反应。
溶液的反应。(1)实验Ⅰ:用如下装置(夹持、加热仪器略)制备
 ,将
,将 通入
通入 溶液中。
溶液中。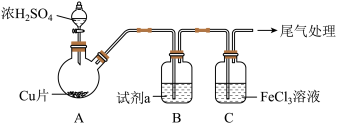
 ;静置9h后,溶液变为浅绿色。
;静置9h后,溶液变为浅绿色。①浓
 与Cu反应的化学方程式是
与Cu反应的化学方程式是②试剂a是
(2)分析C中溶液颜色变化的原因。
①溶液颜色由黄色最终变为浅绿色的原因是
②针对溶液颜色变为红棕色,提出了两种假设。
假设1:主要与
 、
、 有关。
有关。假设2:主要与
 、
、 有关。
有关。实验Ⅱ证实假设1不成立,假设2成立。
实验Ⅱ:向
 溶液中加入
溶液中加入 溶液,
溶液,(3)进一步探究
 与
与 、
、 显红棕色的原因。
显红棕色的原因。查阅资料:
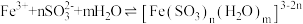 (红棕色)
(红棕色)实验Ⅲ:向
 溶液中滴加
溶液中滴加 溶液,溶液由黄色变成红棕色,析出大量橙黄色沉淀。
溶液,溶液由黄色变成红棕色,析出大量橙黄色沉淀。甲同学认为橙黄色沉淀中可能含有
 、
、 、
、 ,并设计如下检验方案。
,并设计如下检验方案。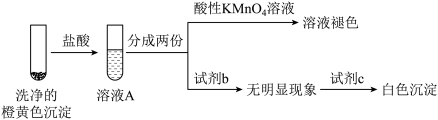
 溶液褪色不能证明橙黄色沉淀中含有
溶液褪色不能证明橙黄色沉淀中含有 ,理由是
,理由是②实验证实橙黄色沉淀中含有
 、不含
、不含 ,试剂b、c分别是
,试剂b、c分别是(4)实验反思:实验I静置5min后溶液颜色由红棕色变回黄色可能的原因是
更新时间:2022-11-04 21:21:20
|
相似题推荐
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐1】几种中学化学常见的单质及其化合物相互转化的关系图如下:
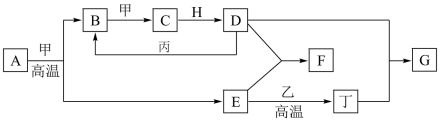
可供参考的信息有:
①甲、乙、丙、丁为单质,其余为化合物。
②A由X和Y两种元素组成,其原子个数比为1∶2,元素质量之比为7∶8。
③B气体是引起酸雨的主要物质,H常温下为无色无味的液体,E常用作红色油漆和涂料。
试根据上述信息回答下列问题:
(1)A的化学式为_______ ,每反应1molA转移的电子数为_______ mol;
(2)F与丁单质也可以化合生成G,试写出该反应的离子方程式_______ ;
(3)少量F的饱和溶液分别滴加到下列物质中,得到三种分散系①、②、③。

分散系③与①、②的本质区别是:_______ ;
(4)化合物M与H组成元素相同,可以将G氧化为F,且不引进新的离子。试写出M在酸性环境下将G氧化为F的离子方程式:_______ 。

可供参考的信息有:
①甲、乙、丙、丁为单质,其余为化合物。
②A由X和Y两种元素组成,其原子个数比为1∶2,元素质量之比为7∶8。
③B气体是引起酸雨的主要物质,H常温下为无色无味的液体,E常用作红色油漆和涂料。
试根据上述信息回答下列问题:
(1)A的化学式为
(2)F与丁单质也可以化合生成G,试写出该反应的离子方程式
(3)少量F的饱和溶液分别滴加到下列物质中,得到三种分散系①、②、③。

分散系③与①、②的本质区别是:
(4)化合物M与H组成元素相同,可以将G氧化为F,且不引进新的离子。试写出M在酸性环境下将G氧化为F的离子方程式:
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐2】某化学研究性学习小组为了制取焦亚硫酸钠( ),并对其性质进行研究。特进行如下实验:
),并对其性质进行研究。特进行如下实验:
实验一 制取焦亚硫酸钠。
研究小组采用下图装置(实验前已除尽装置内的空气)制取 。装置Ⅱ中有
。装置Ⅱ中有 晶体析出,发生的反应为:
晶体析出,发生的反应为: 。
。
(1)装置Ⅰ中通常采用70%~80%的浓硫酸与亚硫酸钠固体反应制取 ,而不用98%的浓硫酸或极稀的稀硫酸,原因是
,而不用98%的浓硫酸或极稀的稀硫酸,原因是________________________ 。
(2)若要从装置Ⅱ中获得已析出的晶体,所采取的分离方法需用到的玻璃仪器有________ 。
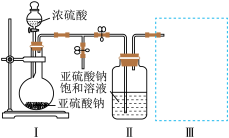
(3)装置Ⅲ用于处理尾气,请画出用来处理尾气并防止发生倒吸的实验装置,注明相应的试剂。
____________________________________________________________
(4)已知 溶于水后,立即生成
溶于水后,立即生成 ,该反应的离子方程式为
,该反应的离子方程式为________________________ 。
(5)用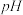 试纸测得
试纸测得 溶液呈酸性,其溶液呈酸性的原因是
溶液呈酸性,其溶液呈酸性的原因是________________________ 。
(6)取少量焦亚硫酸钠晶体于试管中,其中滴加酸性 溶液,剧烈反应,溶液紫红色很快褪去,经测定溶液中产生
溶液,剧烈反应,溶液紫红色很快褪去,经测定溶液中产生 ,该反应的离子方程式是
,该反应的离子方程式是________________________ 。
实验三 焦亚硫酸钠的含量测定。
测定产品中焦亚硫酸钠的质量分数常用剩余碘量法。
已知: ;
; 。
。
①精确称取干燥的产品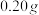 放入碘量瓶(带磨口塞的锥形瓶)中。
放入碘量瓶(带磨口塞的锥形瓶)中。
②向碘量瓶中准确移取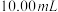 ,
, 的标准碘溶液(过量),振荡,使其与产品中的焦亚硫酸钠充分反应。
的标准碘溶液(过量),振荡,使其与产品中的焦亚硫酸钠充分反应。
③加入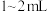 淀粉溶液,用标准
淀粉溶液,用标准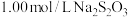 溶液滴定至接近终点,重复操作3次,经计算得消耗标准液平均体积为
溶液滴定至接近终点,重复操作3次,经计算得消耗标准液平均体积为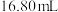 。
。
(7)上述实验操作滴定终点的现象为________________________ ;根据上述实验,计算产品中焦亚硫酸钠的质量分数为________________________ 。
 ),并对其性质进行研究。特进行如下实验:
),并对其性质进行研究。特进行如下实验:实验一 制取焦亚硫酸钠。
研究小组采用下图装置(实验前已除尽装置内的空气)制取
 。装置Ⅱ中有
。装置Ⅱ中有 晶体析出,发生的反应为:
晶体析出,发生的反应为: 。
。(1)装置Ⅰ中通常采用70%~80%的浓硫酸与亚硫酸钠固体反应制取
 ,而不用98%的浓硫酸或极稀的稀硫酸,原因是
,而不用98%的浓硫酸或极稀的稀硫酸,原因是(2)若要从装置Ⅱ中获得已析出的晶体,所采取的分离方法需用到的玻璃仪器有

(3)装置Ⅲ用于处理尾气,请画出用来处理尾气并防止发生倒吸的实验装置,注明相应的试剂。
(4)已知
 溶于水后,立即生成
溶于水后,立即生成 ,该反应的离子方程式为
,该反应的离子方程式为(5)用
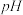 试纸测得
试纸测得 溶液呈酸性,其溶液呈酸性的原因是
溶液呈酸性,其溶液呈酸性的原因是(6)取少量焦亚硫酸钠晶体于试管中,其中滴加酸性
 溶液,剧烈反应,溶液紫红色很快褪去,经测定溶液中产生
溶液,剧烈反应,溶液紫红色很快褪去,经测定溶液中产生 ,该反应的离子方程式是
,该反应的离子方程式是实验三 焦亚硫酸钠的含量测定。
测定产品中焦亚硫酸钠的质量分数常用剩余碘量法。
已知:
 ;
; 。
。①精确称取干燥的产品
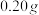 放入碘量瓶(带磨口塞的锥形瓶)中。
放入碘量瓶(带磨口塞的锥形瓶)中。②向碘量瓶中准确移取
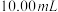 ,
, 的标准碘溶液(过量),振荡,使其与产品中的焦亚硫酸钠充分反应。
的标准碘溶液(过量),振荡,使其与产品中的焦亚硫酸钠充分反应。③加入
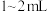 淀粉溶液,用标准
淀粉溶液,用标准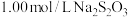 溶液滴定至接近终点,重复操作3次,经计算得消耗标准液平均体积为
溶液滴定至接近终点,重复操作3次,经计算得消耗标准液平均体积为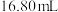 。
。(7)上述实验操作滴定终点的现象为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐3】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关 和
和 )(设为装置A)称重,记为
)(设为装置A)称重,记为 。将样品装入石英玻璃管中,再次将装置A称重,记为
。将样品装入石英玻璃管中,再次将装置A称重,记为 。按下图连接好装置进行实验。
。按下图连接好装置进行实验。
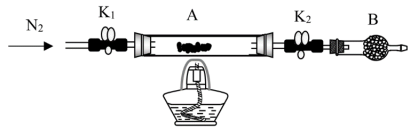
①仪器B的名称是_______ 。
②将下列实验操作步骤正确排序_______ (填标号);重复上述操作步骤,直至A质量几乎不变,记为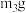 。
。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭 和
和
d.打开 和
和 ,缓缓通入
,缓缓通入 e.称量A f.冷却至室温
e.称量A f.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=_______ (列式表示)。若实验时按a、d次序操作,则使x_______ (填“偏大”“偏小”或“无影响”)。
(2)为探究硫酸亚铁的分解产物,将(2)中已质量几乎不变的装置A接入下图所示的装置中,打开 和
和 ,缓缓通入
,缓缓通入 ,加热。实验后反应管中残留固体为红棕色粉末。
,加热。实验后反应管中残留固体为红棕色粉末。
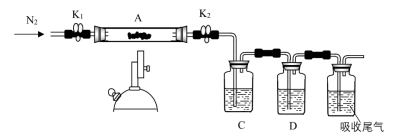
①C、D中的溶液依次为_______ (填标号)。
a.品红 b.NaOH c. d.
d. e.浓
e.浓
②写出硫酸亚铁高温分解反应的化学方程式_______ 。
(3)有同学认为本实验中生成的 和氯水都有漂白性,二者混合后的漂白性会增强,他将
和氯水都有漂白性,二者混合后的漂白性会增强,他将 和
和 按同温同压下体积比1:1同时通入到品红溶液中,结果发现品红溶液未褪色,请分析原因:
按同温同压下体积比1:1同时通入到品红溶液中,结果发现品红溶液未褪色,请分析原因:_______ (用离子方程式表示)。
(4)探究 的酸性强于HClO(可能需要的装置和试剂如图所示)。
的酸性强于HClO(可能需要的装置和试剂如图所示)。
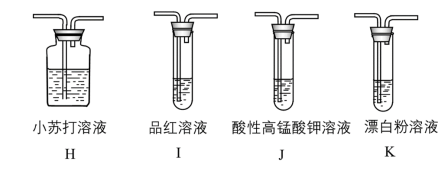
所需装置的连接顺序为:纯净的 →
→_______ (填装置字母代号)。能证明 的酸性强于HClO的实验现象是
的酸性强于HClO的实验现象是_______ 。
(1)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关
 和
和 )(设为装置A)称重,记为
)(设为装置A)称重,记为 。将样品装入石英玻璃管中,再次将装置A称重,记为
。将样品装入石英玻璃管中,再次将装置A称重,记为 。按下图连接好装置进行实验。
。按下图连接好装置进行实验。
①仪器B的名称是
②将下列实验操作步骤正确排序
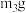 。
。a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭
 和
和
d.打开
 和
和 ,缓缓通入
,缓缓通入 e.称量A f.冷却至室温
e.称量A f.冷却至室温③根据实验记录,计算绿矾化学式中结晶水数目x=
(2)为探究硫酸亚铁的分解产物,将(2)中已质量几乎不变的装置A接入下图所示的装置中,打开
 和
和 ,缓缓通入
,缓缓通入 ,加热。实验后反应管中残留固体为红棕色粉末。
,加热。实验后反应管中残留固体为红棕色粉末。
①C、D中的溶液依次为
a.品红 b.NaOH c.
 d.
d. e.浓
e.浓
②写出硫酸亚铁高温分解反应的化学方程式
(3)有同学认为本实验中生成的
 和氯水都有漂白性,二者混合后的漂白性会增强,他将
和氯水都有漂白性,二者混合后的漂白性会增强,他将 和
和 按同温同压下体积比1:1同时通入到品红溶液中,结果发现品红溶液未褪色,请分析原因:
按同温同压下体积比1:1同时通入到品红溶液中,结果发现品红溶液未褪色,请分析原因:(4)探究
 的酸性强于HClO(可能需要的装置和试剂如图所示)。
的酸性强于HClO(可能需要的装置和试剂如图所示)。
所需装置的连接顺序为:纯净的
 →
→ 的酸性强于HClO的实验现象是
的酸性强于HClO的实验现象是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】电子工业中,人们常用FeCl3溶液腐蚀覆在绝缘板上的铜箔制造印刷电路板。某项目学习小组设计如下流程处理废液和资源回收:
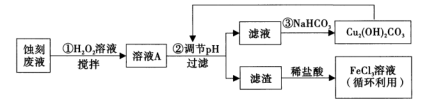
(1)FeCl3溶液中通常加入一定量的盐酸,其加入盐酸的目的是___________ ;将FeCl3溶液蒸干、灼烧后,得到的主要固体产物是___________ 。
(2)用足量FeCl3溶液蚀刻铜箔后的废液中含有的金属阳离子有___________ (填离子符号)。
(3)步骤①中加入H2O2溶液的目的是___________ 。 (用离子方程式表示)。
(4)已知:生成氢氧化物沉淀的pH
根据表中数据推测调节pH的范围是___________ 。
(5)步骤③中,由于NaHCO3部分水解生成Cu2(OH)2CO3沉淀和CO2气体,写出其反应的离子方程式___________ 。
(6)步骤③中生成的Cu2(OH)2CO3中会混有少量CuCO3取样品w g,测得n(Cu)=a mol, 则Cu2(OH)2CO3的纯度为___________ (用字母表示,列出表达式即可)。

(1)FeCl3溶液中通常加入一定量的盐酸,其加入盐酸的目的是
(2)用足量FeCl3溶液蚀刻铜箔后的废液中含有的金属阳离子有
(3)步骤①中加入H2O2溶液的目的是
(4)已知:生成氢氧化物沉淀的pH
| Cu( OH)2 | Fe(OH)2 | Fe( OH)3 | |
| 开始沉淀时 | 4.7 | 7.0 | 1.9 |
| 沉淀完全时 | 6.7 | 9.0 | 3.2 |
(5)步骤③中,由于NaHCO3部分水解生成Cu2(OH)2CO3沉淀和CO2气体,写出其反应的离子方程式
(6)步骤③中生成的Cu2(OH)2CO3中会混有少量CuCO3取样品w g,测得n(Cu)=a mol, 则Cu2(OH)2CO3的纯度为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),过程如图:
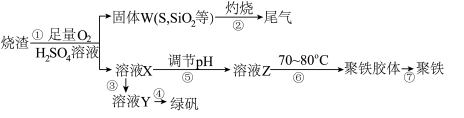
过程⑥中,将溶液Z加热到70~80℃,目的是_____ 。

过程⑥中,将溶液Z加热到70~80℃,目的是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】根据信息书写相关反应方程式:
(1)磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。回收废旧磷酸亚铁锂电池正极片[含Al、炭黑、LiFePO4(难溶于水和碱)]中各物质的流程如下图所示:
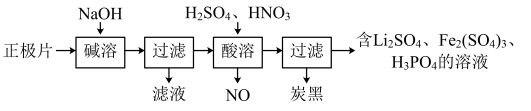
①写出“碱溶”时的离子方程式:________ 。
②写出“酸溶”时的化学方程式:________ 。
③LiFePO4可由Fe2O3、碳粉、LiH2PO4在480℃~900℃时混合共热制得,反应中还有CO生成,写出该反应的化学方程式:________ 。
(2)羟基自由基(电子式为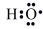 ,本题用·OH表示)有较强的氧化性,常用于污染物的治理。
,本题用·OH表示)有较强的氧化性,常用于污染物的治理。
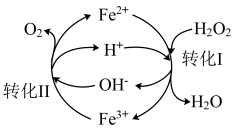
①pH=3时,Fe2+可循环催化H2O2的分解,过程中会产生·OH 中间体,转化过程如右图所示。写出转化Ⅱ的离子方程式:________ 。
②写出酸性条件下,·OH将水中的乙醛氧化成CO2和H2O的离子方程式:________ 。
(1)磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。回收废旧磷酸亚铁锂电池正极片[含Al、炭黑、LiFePO4(难溶于水和碱)]中各物质的流程如下图所示:

①写出“碱溶”时的离子方程式:
②写出“酸溶”时的化学方程式:
③LiFePO4可由Fe2O3、碳粉、LiH2PO4在480℃~900℃时混合共热制得,反应中还有CO生成,写出该反应的化学方程式:
(2)羟基自由基(电子式为
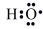 ,本题用·OH表示)有较强的氧化性,常用于污染物的治理。
,本题用·OH表示)有较强的氧化性,常用于污染物的治理。
①pH=3时,Fe2+可循环催化H2O2的分解,过程中会产生·OH 中间体,转化过程如右图所示。写出转化Ⅱ的离子方程式:
②写出酸性条件下,·OH将水中的乙醛氧化成CO2和H2O的离子方程式:
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐1】某化学研究性学习小组用CO还原Fe2O3,并在实验结束后用磁铁吸出生成的黑色粉末X进行探究。
[探究目的] 分析黑色粉末X的组成,并进行相关实验。
[查阅资料]
①CO还原Fe2O3的实验中若温度不同、受热不均时会生成Fe3O4,也能被磁铁吸引。
②Fe3O4+8H+=2Fe3++Fe2++4H2O
③Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O
④3Fe3O4+28HNO3(稀)=9Fe(NO3)3+NO↑+14H2O
[实验探究]
I.定性检验
(1)实验③发生的反应的离子方程式为_____________________________ 。
(2)上述实验说明黑色粉末X中含有_______________________________ 。
II.定量测定
根据下图所示的实验方案进行实验并记录数据:
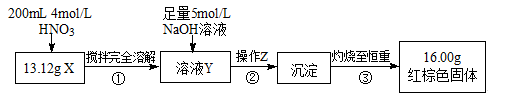
(1)操作Z的名称是_________ 。
(2)通过以上数据,得出13.12g黑色粉末X中各成分的物质的量为_________ 。
(3)若溶液Y的体积仍为200mL,则溶液Y中c(Fe3+)=________ mol/L。
[探究目的] 分析黑色粉末X的组成,并进行相关实验。
[查阅资料]
①CO还原Fe2O3的实验中若温度不同、受热不均时会生成Fe3O4,也能被磁铁吸引。
②Fe3O4+8H+=2Fe3++Fe2++4H2O
③Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O
④3Fe3O4+28HNO3(稀)=9Fe(NO3)3+NO↑+14H2O
[实验探究]
I.定性检验
| 编号 | 实验操作 | 实验现象 |
| ① | 取少量黑色粉末X放入试管1中,注入浓盐酸,微热 | 黑色粉末逐渐溶解,溶液呈黄绿色;有气泡产生 |
| ② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液出现血红色 |
| ③ | 另取少量黑色粉末X放入试管2中,注入足量硫酸铜溶液,振荡,静置 | 有极少量红色物质析出,仍有较多黑色固体未溶解 |
(1)实验③发生的反应的离子方程式为
(2)上述实验说明黑色粉末X中含有
II.定量测定
根据下图所示的实验方案进行实验并记录数据:

(1)操作Z的名称是
(2)通过以上数据,得出13.12g黑色粉末X中各成分的物质的量为
(3)若溶液Y的体积仍为200mL,则溶液Y中c(Fe3+)=
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】 用作印染媒染剂、木材防腐剂、造纸漂白剂,还用于医药、人造纤维、电解、电镀、农药及生产锌盐等,是一种重要的化工原料。工业上采用冷热镀管废料锌灰(主要成分为ZnO、
用作印染媒染剂、木材防腐剂、造纸漂白剂,还用于医药、人造纤维、电解、电镀、农药及生产锌盐等,是一种重要的化工原料。工业上采用冷热镀管废料锌灰(主要成分为ZnO、 ,还含有
,还含有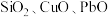 和FeO)制备
和FeO)制备 ,工业流程如图示:
,工业流程如图示:

已知:①CuCl为不溶于水的白色固体
②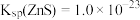 ,
, ,
,
(1)溶浸后过滤得到的滤渣1主要成分是_______ 。
(2)沉铜过程中的离子方程式为_______ 。
(3)①氧化过程若改用高锰酸钾溶液则离子方程式为_______ ;该流程使用 的优点是
的优点是_______ 。
②加入ZnO的目的是_______ 。
(4)该流程中的一系列操作为蒸发浓缩、_______ 、过滤、洗涤、干燥。
(5)取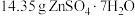 晶体加热至不同温度,剩余固体的质量如表:
晶体加热至不同温度,剩余固体的质量如表:
则该工业流程中加热脱水应该选择的温度为_______ 。
(6)通入 处理该工业废水中的
处理该工业废水中的 ,调节pH=
,调节pH=_______ 时, 恰好沉淀完全(当溶液中被沉淀离子的物质的量浓度小于
恰好沉淀完全(当溶液中被沉淀离子的物质的量浓度小于 时,认为该离子沉淀完全),此时
时,认为该离子沉淀完全),此时 为
为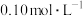 。
。
 用作印染媒染剂、木材防腐剂、造纸漂白剂,还用于医药、人造纤维、电解、电镀、农药及生产锌盐等,是一种重要的化工原料。工业上采用冷热镀管废料锌灰(主要成分为ZnO、
用作印染媒染剂、木材防腐剂、造纸漂白剂,还用于医药、人造纤维、电解、电镀、农药及生产锌盐等,是一种重要的化工原料。工业上采用冷热镀管废料锌灰(主要成分为ZnO、 ,还含有
,还含有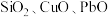 和FeO)制备
和FeO)制备 ,工业流程如图示:
,工业流程如图示:
已知:①CuCl为不溶于水的白色固体
②
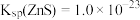 ,
, ,
,
(1)溶浸后过滤得到的滤渣1主要成分是
(2)沉铜过程中的离子方程式为
(3)①氧化过程若改用高锰酸钾溶液则离子方程式为
 的优点是
的优点是②加入ZnO的目的是
(4)该流程中的一系列操作为蒸发浓缩、
(5)取
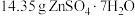 晶体加热至不同温度,剩余固体的质量如表:
晶体加热至不同温度,剩余固体的质量如表:| 温度/℃ | 100 | 250 | 680 | 930 |
| 质量/g | 8.95 | 8.05 | 6.72 | 4.05 |
则该工业流程中加热脱水应该选择的温度为
(6)通入
 处理该工业废水中的
处理该工业废水中的 ,调节pH=
,调节pH= 恰好沉淀完全(当溶液中被沉淀离子的物质的量浓度小于
恰好沉淀完全(当溶液中被沉淀离子的物质的量浓度小于 时,认为该离子沉淀完全),此时
时,认为该离子沉淀完全),此时 为
为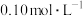 。
。
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐3】某实验小组用浓盐酸和 制取
制取 并探究其化学性质,设计装置如图:
并探究其化学性质,设计装置如图:
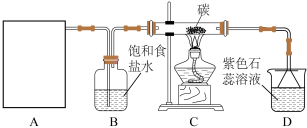
(1)制备 的化学反应离子方程式是
的化学反应离子方程式是_______ ,A是氯气发生装置(省略未画),A装置除了酒精灯、圆底烧瓶外还用到的玻璃仪器有_______
(2)从C装置出来的气体中含有 和HCl,则在C装置中发生的化学反应方程式为
和HCl,则在C装置中发生的化学反应方程式为_______ 。
(3)若装置D中用足量的 溶液吸收多余氯气,试写出相应的离子方程式:
溶液吸收多余氯气,试写出相应的离子方程式:_______ 。
(4)同学们在实验中发现,若用稀盐酸代替浓盐酸与 混合加热没有氯气生成,于是开始探究该条件下不能生成氯气的原因。
混合加热没有氯气生成,于是开始探究该条件下不能生成氯气的原因。
①提出合理假设。
假设1: 的浓度不够大;
的浓度不够大;
假设2:_______ ;
假设3:_______ 。
②设计实验方案,进行实验。在下表中写出实验步骤以及预期现象和结论。_______
限选实验试剂:蒸馏水、浓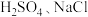 固体、
固体、 固体、稀盐酸、
固体、稀盐酸、 溶液、淀粉-KI溶液。
溶液、淀粉-KI溶液。
 制取
制取 并探究其化学性质,设计装置如图:
并探究其化学性质,设计装置如图:
(1)制备
 的化学反应离子方程式是
的化学反应离子方程式是(2)从C装置出来的气体中含有
 和HCl,则在C装置中发生的化学反应方程式为
和HCl,则在C装置中发生的化学反应方程式为(3)若装置D中用足量的
 溶液吸收多余氯气,试写出相应的离子方程式:
溶液吸收多余氯气,试写出相应的离子方程式:(4)同学们在实验中发现,若用稀盐酸代替浓盐酸与
 混合加热没有氯气生成,于是开始探究该条件下不能生成氯气的原因。
混合加热没有氯气生成,于是开始探究该条件下不能生成氯气的原因。①提出合理假设。
假设1:
 的浓度不够大;
的浓度不够大;假设2:
假设3:
②设计实验方案,进行实验。在下表中写出实验步骤以及预期现象和结论。
限选实验试剂:蒸馏水、浓
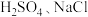 固体、
固体、 固体、稀盐酸、
固体、稀盐酸、 溶液、淀粉-KI溶液。
溶液、淀粉-KI溶液。| 实验步骤 | 预期现象与结论 |
步骤1:取少量1mol/L稀盐酸于试管A中,加入少量 ,_______ ,_______ | _______ |
步骤2:取少量1mol/L稀盐酸于试管B中,加入少量 ,_______ ,_______ | _______ |
您最近一年使用:0次



