铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大。回答下列问题:
(1)已知高炉炼铁过程中会发生如下反应:
FeO(s)+CO(g)=Fe(s)+CO2(g) ΔH1
Fe2O3(s)+ CO(g)=
CO(g)= Fe3O4(s)+
Fe3O4(s)+ CO2(g) ΔH2
CO2(g) ΔH2
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH4
上述总反应在高炉中大致分为三个阶段,各阶段主要成分与温度的关系如图:
1600℃时固体物质的主要成分为_______ ,该温度下测得固体混合物中n(Fe):n(O)=5:1,则FeO被CO还原为Fe的百分率为 _______ (设其它固体杂质中不含Fe、O元素)。
(2)铁系金属常用作CO加氢反应的催化剂。已知某种催化剂可用来催化反应CO(g)+3H2(g)⇌CH4(g)+H2O(g) ΔH<0。在T℃,压强为p时将1molCO和3molH2加入容积为1L的密闭容器中。实验测得CO的体积分数χ(CO)如表:
①前10min内,CO的平均反应速率υ(CO)=_______ (保留两位有效数字)。
②达到平衡时,体系的总压强p与初始压强之比p0,p:p0=_______ ;
③如图是该反应CO的平衡转化率与温度、压强的关系。
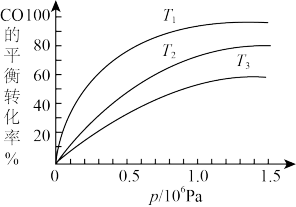
图中温度T1、T2、T3由高到低的顺序是_______ ,理由是 _______ ④45min时,保持容器的温度和体积不变,再加入1molCO和3molH2,再次达到平衡时,CO的平衡转化率 _______ (填“>”、“<”或“=”)30min时CO的平衡转化率。
(1)已知高炉炼铁过程中会发生如下反应:
FeO(s)+CO(g)=Fe(s)+CO2(g) ΔH1
Fe2O3(s)+
 CO(g)=
CO(g)= Fe3O4(s)+
Fe3O4(s)+ CO2(g) ΔH2
CO2(g) ΔH2Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH4
上述总反应在高炉中大致分为三个阶段,各阶段主要成分与温度的关系如图:
| 温度 | 250℃ | 600℃ | 1000℃ | 2000℃ |
| 主要成分 | Fe2O3 | Fe3O4 | FeO | Fe |
1600℃时固体物质的主要成分为
(2)铁系金属常用作CO加氢反应的催化剂。已知某种催化剂可用来催化反应CO(g)+3H2(g)⇌CH4(g)+H2O(g) ΔH<0。在T℃,压强为p时将1molCO和3molH2加入容积为1L的密闭容器中。实验测得CO的体积分数χ(CO)如表:
| t/min | 0 | 10 | 20 | 30 | 35 |
| χ(CO) | 0.25 | 0.20 | 0.17 | 0.15 | 0.15 |
①前10min内,CO的平均反应速率υ(CO)=
②达到平衡时,体系的总压强p与初始压强之比p0,p:p0=
③如图是该反应CO的平衡转化率与温度、压强的关系。

图中温度T1、T2、T3由高到低的顺序是
更新时间:2022/11/11 08:43:56
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】工业上在Cu-ZnO催化下利用CO2发生如下反应Ⅰ生产甲醇,同时伴有反应Ⅱ发生。
Ⅰ.

Ⅱ.
在温度T时,在容积不变的密闭容器中,充入
 和
和
 ,起始压强为p kPa,10min达平衡时生成
,起始压强为p kPa,10min达平衡时生成
 ,测得压强为
,测得压强为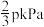 。
。
(1)当以下数值不变时,不能说明该反应达到平衡的是___________(填序号)。
(2)已知反应Ⅰ的正反应速率方程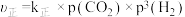 ,逆反应速率方程为
,逆反应速率方程为 ,其中
,其中 、
、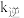 分别为正逆反应速率常数。达到平衡后,若加入高效催化剂,
分别为正逆反应速率常数。达到平衡后,若加入高效催化剂, 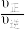 将
将___________ (填“增大”、“减小”或“不变”);若升高温度,
___________ (填“增大”、“减小”或“不变”)。
(3)平衡时 的物质的量为
的物质的量为___________ ,温度T时反应Ⅱ的化学平衡常数为___________ ,若反应速率用单位时间内分压变化表示,则10min内反应Ⅰ的平均反应速率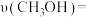
___________ 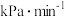 。
。
(4)在温度T时,若向加入催化剂的密闭容器中充入
 、
、
 、
、
 和
和
 ,此时反应Ⅱ的
,此时反应Ⅱ的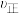
___________ 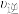 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
Ⅰ.


Ⅱ.

在温度T时,在容积不变的密闭容器中,充入

 和
和
 ,起始压强为p kPa,10min达平衡时生成
,起始压强为p kPa,10min达平衡时生成
 ,测得压强为
,测得压强为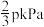 。
。(1)当以下数值不变时,不能说明该反应达到平衡的是___________(填序号)。
| A.气体密度 | B. 百分含量 百分含量 |
C. 与 与 体积比 体积比 | D. 的体积分数 的体积分数 |
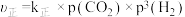 ,逆反应速率方程为
,逆反应速率方程为 ,其中
,其中 、
、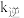 分别为正逆反应速率常数。达到平衡后,若加入高效催化剂,
分别为正逆反应速率常数。达到平衡后,若加入高效催化剂, 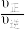 将
将
(3)平衡时
 的物质的量为
的物质的量为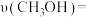
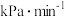 。
。(4)在温度T时,若向加入催化剂的密闭容器中充入

 、
、
 、
、
 和
和
 ,此时反应Ⅱ的
,此时反应Ⅱ的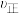
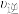 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】回答下列问题
(1)下表中的数据表示破坏1 mol化学键需消耗的能量(即键能,单位为kJ·mol-1):
根据键能数据计算以下反应的反应热△H:CH4(g)+4F2(g)= CF4(g)+4HF(g) △H=___________ 。
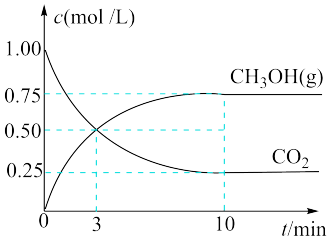
(2)在一定条件下将CO2与H2混合转化为甲醇CH3OH是一种新型脱碳技术,这一反应同时生成气态H2O,实现了绿色环保、节能减排、废物利用等目的。在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的物质的量浓度随时间的变化如图所示。
①该反应方程式为___________
②0~10 min内,氢气的平均反应速率为___________ ;
③平衡后,CO2的转化率为___________ ,H2的体积分数为___________ ,H2O的物质的量为___________
④10 min后,向该容器中再充入1 mol CO2和3 mol H2的瞬间V逆___________ (填“增大”、“减小”或“不变”,下同),则再次达到平衡时CH3OH(g)的体积分数___________
⑤刚开始时容器内的压强:平衡时容器内的压强为___________
(1)下表中的数据表示破坏1 mol化学键需消耗的能量(即键能,单位为kJ·mol-1):
| 化学键 | C—H | C—F | H—F | F—F |
| 键能 | 414 | 489 | 565 | 158 |
(2)在一定条件下将CO2与H2混合转化为甲醇CH3OH是一种新型脱碳技术,这一反应同时生成气态H2O,实现了绿色环保、节能减排、废物利用等目的。在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的物质的量浓度随时间的变化如图所示。

①该反应方程式为
②0~10 min内,氢气的平均反应速率为
③平衡后,CO2的转化率为
④10 min后,向该容器中再充入1 mol CO2和3 mol H2的瞬间V逆
⑤刚开始时容器内的压强:平衡时容器内的压强为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】请回答下列问题:
(1)以 为原料加氢可以合成甲醇
为原料加氢可以合成甲醇 ,一般认为可通过如下两个步骤来实现:
,一般认为可通过如下两个步骤来实现:
①

②
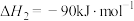
若反应①为慢反应,下列示意图中能体现上述反应能量变化的是___________(填标号)。
(2)恒容条件下,反应 达到平衡,下列措施中能使平衡体系中
达到平衡,下列措施中能使平衡体系中 增大且加快化学反应速率的是___________(填字母)。
增大且加快化学反应速率的是___________(填字母)。
(3)在体积为1L的恒容密闭容器中,充入1mol 和2mol
和2mol ,一定条件下发生反应:
,一定条件下发生反应: ,测得
,测得 浓度随时间的变化如表所示:
浓度随时间的变化如表所示:
测得该条件下平衡时体系的压强为P,求该反应的
___________ 。
(4)在催化剂存在的条件下进行以下两个竞争反应:
①

②

将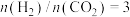 的混合气体充入体积为VL的密闭容器中,相同时间内测得温度与转化率、产物选择性的关系如图所示。
的混合气体充入体积为VL的密闭容器中,相同时间内测得温度与转化率、产物选择性的关系如图所示。 选择性
选择性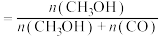 。
。
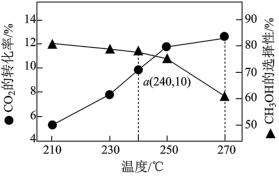
①270℃以后 转化率随温度升高而增大的原因可能是①
转化率随温度升高而增大的原因可能是①___________ 或②___________ 。
②有利于提高 选择性的反应条件可以是
选择性的反应条件可以是___________ (填标号)。
A.升高温度 B.使用更合适的催化剂 C.增大压强 D.原料气中掺入适量的CO
(1)以
 为原料加氢可以合成甲醇
为原料加氢可以合成甲醇 ,一般认为可通过如下两个步骤来实现:
,一般认为可通过如下两个步骤来实现:①


②

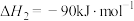
若反应①为慢反应,下列示意图中能体现上述反应能量变化的是___________(填标号)。
A.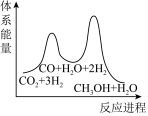 | B.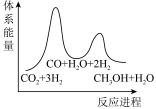 |
C.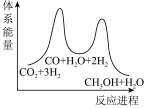 | D.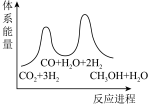 |
(2)恒容条件下,反应
 达到平衡,下列措施中能使平衡体系中
达到平衡,下列措施中能使平衡体系中 增大且加快化学反应速率的是___________(填字母)。
增大且加快化学反应速率的是___________(填字母)。| A.升高温度 | B.充入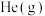 ,使体系压强增大 ,使体系压强增大 |
C.再充入1mol | D.将 从体系中分离出去 从体系中分离出去 |
(3)在体积为1L的恒容密闭容器中,充入1mol
 和2mol
和2mol ,一定条件下发生反应:
,一定条件下发生反应: ,测得
,测得 浓度随时间的变化如表所示:
浓度随时间的变化如表所示:| 时间/min | 0 | 3 | 5 | 10 | 15 |
浓度/( ) ) | 0 | 0.3 | 0.45 | 0.5 | 0.5 |

(4)在催化剂存在的条件下进行以下两个竞争反应:
①


②


将
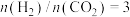 的混合气体充入体积为VL的密闭容器中,相同时间内测得温度与转化率、产物选择性的关系如图所示。
的混合气体充入体积为VL的密闭容器中,相同时间内测得温度与转化率、产物选择性的关系如图所示。 选择性
选择性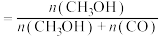 。
。
①270℃以后
 转化率随温度升高而增大的原因可能是①
转化率随温度升高而增大的原因可能是①②有利于提高
 选择性的反应条件可以是
选择性的反应条件可以是A.升高温度 B.使用更合适的催化剂 C.增大压强 D.原料气中掺入适量的CO
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】工业上以煤和水为原料通过一系列转化可变为清洁能源氢气或工业原料甲醇。
I.已知①C(s)+O2(g)=CO2(g) ΔH1
②2H2(g)+O2(g)=2H2O(l) ΔH2
③H2O(l)=H2O(g) ΔH3
则碳与水蒸气反应C(s)+2H2O(g) CO2(g)+2H2(g)的ΔH=
CO2(g)+2H2(g)的ΔH=___________ 。
II.乙醛蒸气在一定条件下可发生反应:CH3CHO(g) CH4(g)+CO(g) ΔH>0。
CH4(g)+CO(g) ΔH>0。
(1)上述反应正反应速率的表达式为v=kcn(CH3CHO)(k为速率常数,与温度、催化剂有关),测得反应速率与浓度的关系如表所示:
①上述速率表达式中,n=___________ 。
②下列有关说法正确的是___________ (填字母)。
A.升高温度,k增大;加催化剂,k减小
B.升高温度,k减小;加催化剂,k增大
C.降低温度,k减小;加催化剂,k增大
D.降低温度,k增大;加催化剂,k减小。
(2)在一定温度下,向某恒容密闭容器中充入1molCH3CHO(g),在一定条件下反应达到平衡,平衡转化率为a。
①下列情况表明上述反应达到平衡状态的是___________ (填字母)。
A.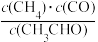 保持不变
保持不变
B.混合气体的密度保持不变
C.混合气体的压强保持不变
D.CH4的消耗速率等于CH3CHO的生成速率
②反应达到平衡后,升高温度,容器内压强增大,原因是___________ (从平衡移动角度考虑)。
③若改为恒压密闭容器,其他条件不变,平衡时CH3CHO的转化率为b,则a___________ b(填“>”“=”或“<”)。
(3)一定温度下,向某密闭容器中充入适量CH3CHO(g),经过相同时间时测得CH3CHO的转化率与压强的关系如图所示。
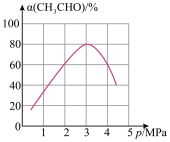
①p>3MPa时,增大压强,CH3CHO的转化率降低,其原因是___________ 。
②当压强为4MPa时,该反应的平衡常数Kp=___________ MPa(用各物质分压计算的平衡常数为Kp,分压=总压×物质的量分数)。
I.已知①C(s)+O2(g)=CO2(g) ΔH1
②2H2(g)+O2(g)=2H2O(l) ΔH2
③H2O(l)=H2O(g) ΔH3
则碳与水蒸气反应C(s)+2H2O(g)
 CO2(g)+2H2(g)的ΔH=
CO2(g)+2H2(g)的ΔH=II.乙醛蒸气在一定条件下可发生反应:CH3CHO(g)
 CH4(g)+CO(g) ΔH>0。
CH4(g)+CO(g) ΔH>0。(1)上述反应正反应速率的表达式为v=kcn(CH3CHO)(k为速率常数,与温度、催化剂有关),测得反应速率与浓度的关系如表所示:
| c(CH3CHO)/(mol·L-1) | 0.1 | 0.2 | 0.3 | 0.4 |
| r/(mol·L-1·s-1) | 0.02 | 0.08 | 0.18 | 0.32 |
①上述速率表达式中,n=
②下列有关说法正确的是
A.升高温度,k增大;加催化剂,k减小
B.升高温度,k减小;加催化剂,k增大
C.降低温度,k减小;加催化剂,k增大
D.降低温度,k增大;加催化剂,k减小。
(2)在一定温度下,向某恒容密闭容器中充入1molCH3CHO(g),在一定条件下反应达到平衡,平衡转化率为a。
①下列情况表明上述反应达到平衡状态的是
A.
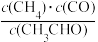 保持不变
保持不变B.混合气体的密度保持不变
C.混合气体的压强保持不变
D.CH4的消耗速率等于CH3CHO的生成速率
②反应达到平衡后,升高温度,容器内压强增大,原因是
③若改为恒压密闭容器,其他条件不变,平衡时CH3CHO的转化率为b,则a
(3)一定温度下,向某密闭容器中充入适量CH3CHO(g),经过相同时间时测得CH3CHO的转化率与压强的关系如图所示。

①p>3MPa时,增大压强,CH3CHO的转化率降低,其原因是
②当压强为4MPa时,该反应的平衡常数Kp=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】研究含氮元素物质的反应对生产、生活、科研等方面具有重要的意义。
(1)发射“神舟十三”号的火箭推进剂为液态四氧化二氮和液态偏二甲肼(C2H8N2)。
已知:①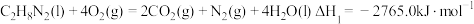
②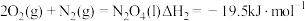
③
则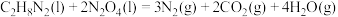 的
的 为
为_______ 。
(2)碘蒸气存在能大幅度提高 的分解速率,反应历程为
的分解速率,反应历程为
第一步: (快反应)
(快反应)
第二步: (慢反应)
(慢反应)
第三步: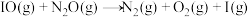 (快反应)
(快反应)
实验表明,含碘时 分解速率方程
分解速率方程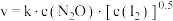 (k为速率常数)。下列表述正确的是_______(填字母)。
(k为速率常数)。下列表述正确的是_______(填字母)。
(3)为避免汽车尾气中的氮氧化合物对大气的污染,需给汽车安装尾气净化装置。在净化装置中 和
和 发生反应:
发生反应: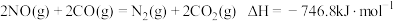 。实验测得:
。实验测得: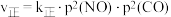 ,
,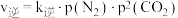 。其中
。其中 分别为正、逆反应速率常数,只与温度有关;p为气体分压(分压=物质的量分数×总压)。
分别为正、逆反应速率常数,只与温度有关;p为气体分压(分压=物质的量分数×总压)。
①达到平衡后,仅升高温度, 增大的倍数
增大的倍数_______ (填“大于”“小于”或“等于”) 增大的倍数。
增大的倍数。
②一定温度下在刚性密闭容器中充入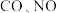 和
和 的物质的量之比为2∶2∶1,压强为
的物质的量之比为2∶2∶1,压强为 。达平衡时压强为
。达平衡时压强为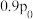 ,则
,则
_______ 。
(4)我国科技人员计算了在一定温度范围内下列反应的平衡常数 :
:
ⅰ.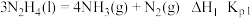
ⅱ.
绘制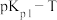 和
和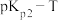 的线性关系如图所示(已知:
的线性关系如图所示(已知: ):
):
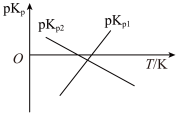
①由图可知,
_______ (填“>”或“<”)0。
②反应;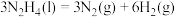 的
的
_______ (用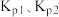 表示);该反应的
表示);该反应的
_______ (填“>”或“<”)0,写出推理过程:_______ 。
(1)发射“神舟十三”号的火箭推进剂为液态四氧化二氮和液态偏二甲肼(C2H8N2)。
已知:①
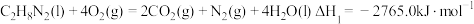
②
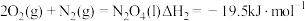
③

则
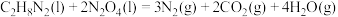 的
的 为
为(2)碘蒸气存在能大幅度提高
 的分解速率,反应历程为
的分解速率,反应历程为第一步:
 (快反应)
(快反应)第二步:
 (慢反应)
(慢反应)第三步:
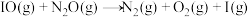 (快反应)
(快反应)实验表明,含碘时
 分解速率方程
分解速率方程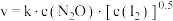 (k为速率常数)。下列表述正确的是_______(填字母)。
(k为速率常数)。下列表述正确的是_______(填字母)。A. 分解反应中,k值与碘蒸气浓度大小有关 分解反应中,k值与碘蒸气浓度大小有关 |
B.v(第二步的逆反应)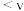 (第三步反应) (第三步反应) |
C. 为反应的催化剂 为反应的催化剂 |
| D.第二步活化能比第三步大 |
 和
和 发生反应:
发生反应: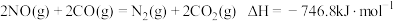 。实验测得:
。实验测得: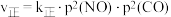 ,
,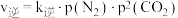 。其中
。其中 分别为正、逆反应速率常数,只与温度有关;p为气体分压(分压=物质的量分数×总压)。
分别为正、逆反应速率常数,只与温度有关;p为气体分压(分压=物质的量分数×总压)。①达到平衡后,仅升高温度,
 增大的倍数
增大的倍数 增大的倍数。
增大的倍数。②一定温度下在刚性密闭容器中充入
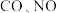 和
和 的物质的量之比为2∶2∶1,压强为
的物质的量之比为2∶2∶1,压强为 。达平衡时压强为
。达平衡时压强为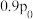 ,则
,则
(4)我国科技人员计算了在一定温度范围内下列反应的平衡常数
 :
:ⅰ.
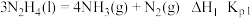
ⅱ.

绘制
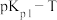 和
和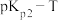 的线性关系如图所示(已知:
的线性关系如图所示(已知: ):
):
①由图可知,

②反应;
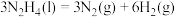 的
的
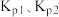 表示);该反应的
表示);该反应的
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】二甲醚(CH3OCH3)被称为21世纪的新型燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:
(1)该工艺的总反应为3CO(g)+3H2(g) CH3OCH3(g)+CO2(g) ΔH=
CH3OCH3(g)+CO2(g) ΔH=_________ ,化学平衡常数K=______________ (用含K1、K2、K3的代数式表示)。
(2)某温度下,将8.0molH2和4.0molCO充入容积为2L的密闭容器中,发生反应:4H2(g)+2CO(g) CH3OCH3(g)+H2O(g),10 分钟后反应达平衡,测得二甲醚的体积分数为25%,则用H2表示的反应速率为
CH3OCH3(g)+H2O(g),10 分钟后反应达平衡,测得二甲醚的体积分数为25%,则用H2表示的反应速率为_________ ,CO的转化率为________ 。
(3)下列措施中,能提高CH3OCH3产率的有________ 。
A.分离出二甲醚 B.降低温度 C.改用高效催化剂 D.增大压强
(4)该工艺中反应③的发生提高了CH3OCH3的产率,原因是________________ 。
(1)该工艺的总反应为3CO(g)+3H2(g)
 CH3OCH3(g)+CO2(g) ΔH=
CH3OCH3(g)+CO2(g) ΔH=化学反应方程式 | 化学平衡常数 | |
①CO(g)+2H2(g) | ΔH1=-99 kJ•mol-1 | K1 |
②2CH3OH(g) | ΔH2=-24 kJ•mol-1 | K2 |
③CO(g)+H2O(g) | ΔH3=-41 kJ•mol-1 | K3 |
(2)某温度下,将8.0molH2和4.0molCO充入容积为2L的密闭容器中,发生反应:4H2(g)+2CO(g)
 CH3OCH3(g)+H2O(g),10 分钟后反应达平衡,测得二甲醚的体积分数为25%,则用H2表示的反应速率为
CH3OCH3(g)+H2O(g),10 分钟后反应达平衡,测得二甲醚的体积分数为25%,则用H2表示的反应速率为(3)下列措施中,能提高CH3OCH3产率的有
A.分离出二甲醚 B.降低温度 C.改用高效催化剂 D.增大压强
(4)该工艺中反应③的发生提高了CH3OCH3的产率,原因是
您最近一年使用:0次



