研究化学反应速率与平衡原理有助于学科思维的提升。
(1)已知焓变与熵变有如下关系:△G=ΔH-TΔS,某反应当△G<0时自发,△G>0不自发。今有A、B、C、D四个反应的焓变、熵变数据如下:
①在任何温度下都能自发进行的反应是_______ (选填ABCD序号,下同);
②任何温度下都不能自发进行的反应是_______ 。
(2)利用图所示装置,可测定盐酸与碳酸钙反应生成CO2的反应速率。请根据要求填空:
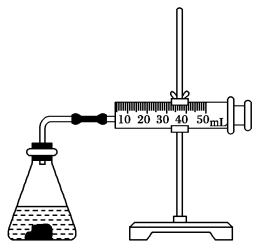
①连接仪器、检查装置气密后,在锥形瓶中加入5 g碳酸钙,迅速加入20 mL 1 mol·L-1盐酸,塞紧瓶塞。
②每隔10 s观测注射器中气体的体积,并以mL·s-1为反应速率的单位,计算每10 s内的反应速率。数据处理的结果见下表:
表格中的“?”处应填的数据是_______ ;从反应速率随时间变化的数据可知,本实验中反应速率与_______ 和_______ 有关。
(3)反应速率(v)和反应物浓度(c)的关系可以用实验方法测定。如化学反应 的正反应速率可表示为
的正反应速率可表示为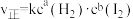 ,式中k为常数,a、b的值可用下表数据确定。据表中数据可推出a=
,式中k为常数,a、b的值可用下表数据确定。据表中数据可推出a=_______ 、b=_______ 。
(4)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),K为化学平衡常数,K和温度的关系如下表:
CO(g)+H2O(g),K为化学平衡常数,K和温度的关系如下表:
根据以上信息推断:
①该反应为_______ 热反应;
②达到平衡后,在其他条件不变情况下加入干燥剂无水氯化钙,氢气的转化率将_______ ;
③1000℃,某时刻CO2、H2、CO、H2O的物质的量分别为0.2mol、0.8mol、0.4mol、0.4mol,此时V正_______ V逆(填“>”、“<”或“=”)。
(5)在3种不同条件下,分别向容积为2 L的恒容密闭容器中充入2 mol A和1 mol B,发生反应:2A(g)+B(g) 2D(g) ΔH=Q kJ·mol-1。相关条件和数据见下表。回答:
2D(g) ΔH=Q kJ·mol-1。相关条件和数据见下表。回答:
①K1、K2和K3三者的关系为_______ ;
②实验Ⅱ改变的条件可能是:_______ ;
③分别达平衡后,实验Ⅰ与实验Ⅲ容器内的压强大小关系是:Ⅰ_______ Ⅲ(选填“大于”、“小于”、“等于”);
④实验Ⅲ达平衡后,恒温下再向容器中通入1 mol A和1 mol D,平衡将_______ (选填“朝正向移动”、“朝逆向移动”、“不移动”)。
(1)已知焓变与熵变有如下关系:△G=ΔH-TΔS,某反应当△G<0时自发,△G>0不自发。今有A、B、C、D四个反应的焓变、熵变数据如下:
| 反应 | A | B | C | D |
| ΔH/(kJ·mol-1) | 10.5 | 1.80 | -126 | -11.7 |
| ΔS/(J·mol-1·K-1) | 30.0 | -113.0 | 84.0 | -105.0 |
②任何温度下都不能自发进行的反应是
(2)利用图所示装置,可测定盐酸与碳酸钙反应生成CO2的反应速率。请根据要求填空:

①连接仪器、检查装置气密后,在锥形瓶中加入5 g碳酸钙,迅速加入20 mL 1 mol·L-1盐酸,塞紧瓶塞。
②每隔10 s观测注射器中气体的体积,并以mL·s-1为反应速率的单位,计算每10 s内的反应速率。数据处理的结果见下表:
| 时间/s | 10 | 20 | 30 | 40 | 50 | 60 |
| 气体体积/mL | 4 | 14 | 25 | 38 | 47 | 55 |
| 反应速率/(mL·s-1) | 0.4 | 1.0 | 1.1 | ? | 0.9 | 0.8 |
(3)反应速率(v)和反应物浓度(c)的关系可以用实验方法测定。如化学反应
 的正反应速率可表示为
的正反应速率可表示为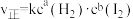 ,式中k为常数,a、b的值可用下表数据确定。据表中数据可推出a=
,式中k为常数,a、b的值可用下表数据确定。据表中数据可推出a=| c(H2)/(mol·L-1) | c(I2)/(mol·L-1) | v/(mol·L-1·s-1) |
| 0.5 | 4.0 | 1.0k |
| 1.0 | 4.0 | 2.0k |
 CO(g)+H2O(g),K为化学平衡常数,K和温度的关系如下表:
CO(g)+H2O(g),K为化学平衡常数,K和温度的关系如下表:| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
①该反应为
②达到平衡后,在其他条件不变情况下加入干燥剂无水氯化钙,氢气的转化率将
③1000℃,某时刻CO2、H2、CO、H2O的物质的量分别为0.2mol、0.8mol、0.4mol、0.4mol,此时V正
(5)在3种不同条件下,分别向容积为2 L的恒容密闭容器中充入2 mol A和1 mol B,发生反应:2A(g)+B(g)
 2D(g) ΔH=Q kJ·mol-1。相关条件和数据见下表。回答:
2D(g) ΔH=Q kJ·mol-1。相关条件和数据见下表。回答:| 实验编号 | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
| 反应温度/℃ | 700 | 700 | 750 |
| 达平衡时间/min | 40 | 5 | 30 |
| n(D)平衡/mol | 1.5 | 1.5 | 1 |
| 化学平衡常数 | K1 | K2 | K3 |
②实验Ⅱ改变的条件可能是:
③分别达平衡后,实验Ⅰ与实验Ⅲ容器内的压强大小关系是:Ⅰ
④实验Ⅲ达平衡后,恒温下再向容器中通入1 mol A和1 mol D,平衡将
更新时间:2022-11-05 17:42:07
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】反应 Sn +H2SO4=SnSO4+H2↑的能量变化趋势,如图所示:
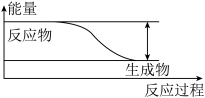
(1)该反应为____________ 反应(填“吸热”或“放热”)。
(2)若要使该反应的反应速率加快,下列措施可行的是___________ (填字母)。
A.改锡片为锡粉 B.加入少量醋酸钠固体 C.滴加少量 CuSO4 D.将稀硫酸改为 98%的浓硫酸
(3)若将上述反应设计成原电池,石墨棒为原电池某一极材料,则石墨棒为__________ 极(填“正”或“负”)。石墨棒上产生的现象为_______________ ,该极上发生的电极反应为_______________ ,稀硫酸的作用是传导离子、_______________ ,原电池工作时溶液中的 移向
移向_____________ 极移动(填正或负)。
(4)实验后同学们经过充分讨论,认为符合某些要求的化学反应都可以通过原电池来实现。下列化学反应在理论上可以设计成原电池的是______________________ 。
A.C(s)+H2O(g)= CO(g)+H2(g) △H>0
B.NaOH(aq)+HCl(aq)= NaCl(aq)+H2O(l)△H<0
C.2H2(g)+O2(g)= 2H2O(l) △H<0
D.Pb+ PbO2+2H2SO4=2PbSO4+2H2O △H<0
以 KOH 溶液为电解质溶液,在所选反应中选择某个反应设计成原电池,该电池负极反应为:______________ 。

(1)该反应为
(2)若要使该反应的反应速率加快,下列措施可行的是
A.改锡片为锡粉 B.加入少量醋酸钠固体 C.滴加少量 CuSO4 D.将稀硫酸改为 98%的浓硫酸
(3)若将上述反应设计成原电池,石墨棒为原电池某一极材料,则石墨棒为
 移向
移向(4)实验后同学们经过充分讨论,认为符合某些要求的化学反应都可以通过原电池来实现。下列化学反应在理论上可以设计成原电池的是
A.C(s)+H2O(g)= CO(g)+H2(g) △H>0
B.NaOH(aq)+HCl(aq)= NaCl(aq)+H2O(l)△H<0
C.2H2(g)+O2(g)= 2H2O(l) △H<0
D.Pb+ PbO2+2H2SO4=2PbSO4+2H2O △H<0
以 KOH 溶液为电解质溶液,在所选反应中选择某个反应设计成原电池,该电池负极反应为:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】为探究某固体化合物X(含三种短周期元素,150g/mol<M<200g/mol)的组成和性质,设计并完成如下实验:
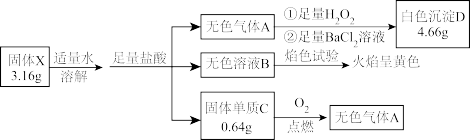
请回答:
(1)白色沉淀D的化学式是_______ 。
(2)组成X的3种元素是_______ (填元素符号)。
(3)固体X的溶液与盐酸反应的离子方程式是_______ 。
(4)为探究外界条件对该化学反应速率的影响,设计以下三组实验:
①表格中实验方案c的V=_______ 。
②设计实验方案a和b的目的是_______ 。

请回答:
(1)白色沉淀D的化学式是
(2)组成X的3种元素是
(3)固体X的溶液与盐酸反应的离子方程式是
(4)为探究外界条件对该化学反应速率的影响,设计以下三组实验:
| 实验方案 | 反应温度/℃ | X的水溶液 | 稀盐酸 |  | ||
 | 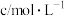 |  | 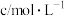 |  | ||
| a | 25 | 5 | 0.1 | 10 | 0.2 | 5 |
| b | 25 | 5 | 0.2 | 5 | 0.4 | 10 |
| c | 35 | 5 | 0.1 | 10 | 0.2 | V |
②设计实验方案a和b的目的是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】已知:草酸与高锰酸钾在酸性条件下能够发生如下反应:2MnO + 5H2C2O4 +6H+ = 2Mn2+ +10 CO2↑+ 8H2O。
+ 5H2C2O4 +6H+ = 2Mn2+ +10 CO2↑+ 8H2O。
(1)现用4 mL 0.001 mol/L KMnO4溶液与2 mL 0.01 mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
①如果研究温度对化学反应速率的影响,使用实验_______ (用I~IV表示,下同)。
②实验III中加入1 mL蒸馏水的目的是_______ 。
③在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想反应速率明显加快的原因还可能是_______ 。
(2)也可以利用KMnO4溶液来测定H2C2O4溶液的浓度。具体做法如下:
①准确配制0.100 mol/L的KMnO4。
②将KMnO4溶液盛放在图_______ (填“甲”或“乙”)滴定管中。

③准确量取25.00mL H2C2O4溶液于锥形瓶中,进行滴定。实验中没有另加指示剂的原因是_______
④记录数据,分析误差:在下列操作中,会使测定的浓度偏大的是_______ 。
A.盛装 KMnO4溶液的滴定管用蒸馏水洗净后未用KMnO4溶液润洗
B.锥形瓶中盛有少量蒸馏水,再加待测液
C.盛装H2C2O4溶液的滴定管用蒸馏水洗净后,未用H2C2O4溶液润洗
D.滴定后观察滴定管读数时,视线高于刻度线
 + 5H2C2O4 +6H+ = 2Mn2+ +10 CO2↑+ 8H2O。
+ 5H2C2O4 +6H+ = 2Mn2+ +10 CO2↑+ 8H2O。(1)现用4 mL 0.001 mol/L KMnO4溶液与2 mL 0.01 mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| I | 2 mL | 20 | |
| II | 2 mL | 30 | |
| III | 1 mL | 20 | 1 mL蒸馏水 |
| IV | A | 20 | B |
②实验III中加入1 mL蒸馏水的目的是
③在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想反应速率明显加快的原因还可能是
(2)也可以利用KMnO4溶液来测定H2C2O4溶液的浓度。具体做法如下:
①准确配制0.100 mol/L的KMnO4。
②将KMnO4溶液盛放在图

③准确量取25.00mL H2C2O4溶液于锥形瓶中,进行滴定。实验中没有另加指示剂的原因是
④记录数据,分析误差:在下列操作中,会使测定的浓度偏大的是
A.盛装 KMnO4溶液的滴定管用蒸馏水洗净后未用KMnO4溶液润洗
B.锥形瓶中盛有少量蒸馏水,再加待测液
C.盛装H2C2O4溶液的滴定管用蒸馏水洗净后,未用H2C2O4溶液润洗
D.滴定后观察滴定管读数时,视线高于刻度线
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】硫化氢的转化是资源利用和环境保护的重要研究课题。
(1)电解法处理硫化氢的装置如图所示:

①阳极的电极反应式为_______ 。
②反应池中发生的离子反应方程式为_______ 。
(2)硫化氢制备羰基硫,其原理为: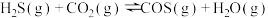
 ,在610K时,将0.10mol
,在610K时,将0.10mol  与0.40mol
与0.40mol 充入2.5L的空钢瓶中,反应平衡后水蒸气的物质的量分数为0.18.
充入2.5L的空钢瓶中,反应平衡后水蒸气的物质的量分数为0.18. 的平衡转化率
的平衡转化率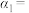
_______ %,若要提高 的平衡转化率,可采取的措施
的平衡转化率,可采取的措施_______ (写出一条即可)。
(3) 气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在
气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在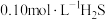 溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与
溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与 关系如图所示(忽略溶液体积的变化、
关系如图所示(忽略溶液体积的变化、 的挥发)。
的挥发)。
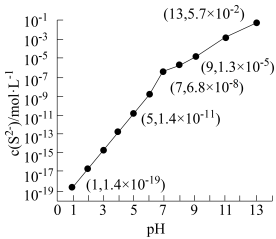
①pH=13时,溶液中的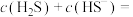
_______ 。
②某溶液含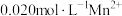 、
、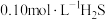 ,当溶液pH=
,当溶液pH=_______ 时, 开始沉淀。[已知:
开始沉淀。[已知: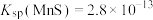 ]。
]。
(1)电解法处理硫化氢的装置如图所示:

①阳极的电极反应式为
②反应池中发生的离子反应方程式为
(2)硫化氢制备羰基硫,其原理为:
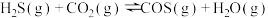
 ,在610K时,将0.10mol
,在610K时,将0.10mol  与0.40mol
与0.40mol 充入2.5L的空钢瓶中,反应平衡后水蒸气的物质的量分数为0.18.
充入2.5L的空钢瓶中,反应平衡后水蒸气的物质的量分数为0.18. 的平衡转化率
的平衡转化率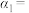
 的平衡转化率,可采取的措施
的平衡转化率,可采取的措施(3)
 气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在
气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在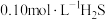 溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与
溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与 关系如图所示(忽略溶液体积的变化、
关系如图所示(忽略溶液体积的变化、 的挥发)。
的挥发)。
①pH=13时,溶液中的
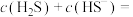
②某溶液含
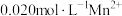 、
、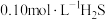 ,当溶液pH=
,当溶液pH= 开始沉淀。[已知:
开始沉淀。[已知: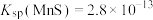 ]。
]。
您最近一年使用:0次
【推荐2】合成氨在生产中具有重要意义。请按要求回答下列问题。
(1)已知反应N2(g)+3H2(g) 2NH3(g) △H<0。向恒温恒容密闭的反应容器中投料1 mol N2、3 mol H2,在不同温度下分别达平衡时,混合气中NH3的物质的量分数随压强变化的曲线如图所示:
2NH3(g) △H<0。向恒温恒容密闭的反应容器中投料1 mol N2、3 mol H2,在不同温度下分别达平衡时,混合气中NH3的物质的量分数随压强变化的曲线如图所示:

①曲线A、B、C对应的温度是由低到高依次是(填代表曲线的字母)_______ 。图中X、Y、Z点的平衡常数大小关系(填“>”“<”或“=”): K(X)__ K(Y)_____ K(Z).
②既能加快化学反应速率有能提高H2的转化率的措施有_______ 。
③Y点对应的H2的转化率是_______ ;若仅将起始投料均加倍,其他条件不变,达新平衡时,则H2的转化率将会(填“升高”、“降低”或“不变”) _______ 。
(2)电解法合成氨因其原料转化率大幅度提高,有望代替传统的工业合成氨工艺。电解法合成氨的两种原理及装置如图甲和图乙所示:
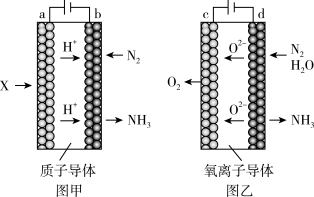
①图甲a电极上的电极反应式为_______ 图乙d电极上的电极反应式为_______ 。
②若图甲和图乙装置的通电时间相同、电流强度相等,电解效率分别为80%和60%,则两种装置中产生氨气的物质的量之比为_______ 。
(1)已知反应N2(g)+3H2(g)
 2NH3(g) △H<0。向恒温恒容密闭的反应容器中投料1 mol N2、3 mol H2,在不同温度下分别达平衡时,混合气中NH3的物质的量分数随压强变化的曲线如图所示:
2NH3(g) △H<0。向恒温恒容密闭的反应容器中投料1 mol N2、3 mol H2,在不同温度下分别达平衡时,混合气中NH3的物质的量分数随压强变化的曲线如图所示:
①曲线A、B、C对应的温度是由低到高依次是(填代表曲线的字母)
②既能加快化学反应速率有能提高H2的转化率的措施有
③Y点对应的H2的转化率是
(2)电解法合成氨因其原料转化率大幅度提高,有望代替传统的工业合成氨工艺。电解法合成氨的两种原理及装置如图甲和图乙所示:

①图甲a电极上的电极反应式为
②若图甲和图乙装置的通电时间相同、电流强度相等,电解效率分别为80%和60%,则两种装置中产生氨气的物质的量之比为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】SO2是产生酸雨的主要原因,研究SO2等大气污染物的治理具有重要的意义。
(1)工业上回收SO2制取硫酸,该过程中涉及的反应如下:
①2SO2(g)+O2(g) 2SO3(g) △H1=-196.6kJ•mol-1
2SO3(g) △H1=-196.6kJ•mol-1
②SO3(g)+H2O(l) H2SO4(aq) △H2=-130.2kJ•mol-1
H2SO4(aq) △H2=-130.2kJ•mol-1
则2SO2(g)+O2(g)+2H2O(l) 2H2SO4(aq) △H=
2H2SO4(aq) △H=____ kJ•mol-1。
(2)工业上根据反应:2CO(g)+SO2(g) S(1)+2CO2(g) △H=-37.0kJ•mol-1,可利用CO处理SO2并回收硫。已知在一定温度下,向甲、乙两个起始体积相同的密闭容器中分别充入2molCO和1molSO2。
S(1)+2CO2(g) △H=-37.0kJ•mol-1,可利用CO处理SO2并回收硫。已知在一定温度下,向甲、乙两个起始体积相同的密闭容器中分别充入2molCO和1molSO2。

一段时间后达到平衡,则SO2的转化率:α(甲)____ α(乙)(填“>”“<"或“=”,下同)、混合气体的平均相对分子质量:M(甲)____ M(乙)。
(3)在容积相等的三个密闭容器中分别按投料比n(CO):n(SO2)=1:1、2:1、3:1投料,发生反应:2CO(g)+SO2(g) S(g)+2CO2(g) △H=+8.0kJ•mol-1,测得SO2的平衡转化率与温度的关系如图所示。
S(g)+2CO2(g) △H=+8.0kJ•mol-1,测得SO2的平衡转化率与温度的关系如图所示。

①曲线III代表的投料比为____ 。
②在密闭容器中按曲线II对应的投料比投料,若初始压强为p0,在a点对应的温度下,该反应的平衡常数Kp=____ (Kp为用分压表示的平衡常数,分压=总压×物质的量分数)。
(1)工业上回收SO2制取硫酸,该过程中涉及的反应如下:
①2SO2(g)+O2(g)
 2SO3(g) △H1=-196.6kJ•mol-1
2SO3(g) △H1=-196.6kJ•mol-1②SO3(g)+H2O(l)
 H2SO4(aq) △H2=-130.2kJ•mol-1
H2SO4(aq) △H2=-130.2kJ•mol-1则2SO2(g)+O2(g)+2H2O(l)
 2H2SO4(aq) △H=
2H2SO4(aq) △H=(2)工业上根据反应:2CO(g)+SO2(g)
 S(1)+2CO2(g) △H=-37.0kJ•mol-1,可利用CO处理SO2并回收硫。已知在一定温度下,向甲、乙两个起始体积相同的密闭容器中分别充入2molCO和1molSO2。
S(1)+2CO2(g) △H=-37.0kJ•mol-1,可利用CO处理SO2并回收硫。已知在一定温度下,向甲、乙两个起始体积相同的密闭容器中分别充入2molCO和1molSO2。
一段时间后达到平衡,则SO2的转化率:α(甲)
(3)在容积相等的三个密闭容器中分别按投料比n(CO):n(SO2)=1:1、2:1、3:1投料,发生反应:2CO(g)+SO2(g)
 S(g)+2CO2(g) △H=+8.0kJ•mol-1,测得SO2的平衡转化率与温度的关系如图所示。
S(g)+2CO2(g) △H=+8.0kJ•mol-1,测得SO2的平衡转化率与温度的关系如图所示。
①曲线III代表的投料比为
②在密闭容器中按曲线II对应的投料比投料,若初始压强为p0,在a点对应的温度下,该反应的平衡常数Kp=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】I.(1)“大象的牙膏”是著名化学实验之一,其实验方法是将浓缩的过氧化氢溶液与肥皂液混合,再滴加少量碘化钾溶液,即可观察到泡沫状物质像喷泉一样喷涌而出。
已知:2H2O2(l)=2H2O(l)+O2(g) △H=-196kJ/mol,活化能Ea=76kJ/mol,若用I-催化时活化能Ea’=57kJ/mol。
①在H2O2溶液中加入KI溶液作催化剂,反应过程中先后发生甲、乙两个反应,实现了I-与IO-之间的转化,请依次写出发生反应的离子方程式,反应甲:______________ ;反应乙:____________ 。
②反应甲为吸热反应,且甲的反应速率小于乙的反应速率,在下图中画出在H2O2溶液中加入KI后,反应过程的能量变化图_______ 。

II.(2)Fe2+与Ag+在溶液中可以发生氧化还原反应。室温时,初始浓度为0.1 mol/LFe(NO3)2溶液中c(Fe3+)随c(Ag+)的变化如图所示:
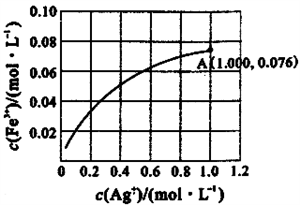
①用离子方程式表示Fe(NO3)2溶液中发生的反应___________________________________ 。
②据A点数据,计算该转化反应的平衡常数为____________________ 。
③用下图的装置,证明上述反应的可逆性。闭合电键K,立即观察到的明显现象是__________________ 。石墨为电池的_____ 极,通过列式计算说明原因_________________ 。

已知:2H2O2(l)=2H2O(l)+O2(g) △H=-196kJ/mol,活化能Ea=76kJ/mol,若用I-催化时活化能Ea’=57kJ/mol。
①在H2O2溶液中加入KI溶液作催化剂,反应过程中先后发生甲、乙两个反应,实现了I-与IO-之间的转化,请依次写出发生反应的离子方程式,反应甲:
②反应甲为吸热反应,且甲的反应速率小于乙的反应速率,在下图中画出在H2O2溶液中加入KI后,反应过程的能量变化图

II.(2)Fe2+与Ag+在溶液中可以发生氧化还原反应。室温时,初始浓度为0.1 mol/LFe(NO3)2溶液中c(Fe3+)随c(Ag+)的变化如图所示:

①用离子方程式表示Fe(NO3)2溶液中发生的反应
②据A点数据,计算该转化反应的平衡常数为
③用下图的装置,证明上述反应的可逆性。闭合电键K,立即观察到的明显现象是

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】合理利用温室气体是当前能源与环境研究的热点。
(1) 催化重整可得到合成气(
催化重整可得到合成气( 和
和 ),其工艺过程涉及如下反应:
),其工艺过程涉及如下反应:
反应i: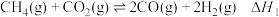
反应ii:

反应iii: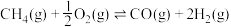
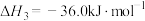
反应iv: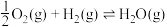
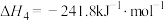
则 =
=_______  。
。
(2)其他条件不变,反应i在不同催化剂(I、II、III)作用下进行相同时间后, 的转化率随反应温度的变化如图所示。
的转化率随反应温度的变化如图所示。

①a点所代表的状态_______ (填“是”、“不是”或“不确定是”)平衡状态。
②b点 的转化率高于c点,原因是
的转化率高于c点,原因是_______ 。
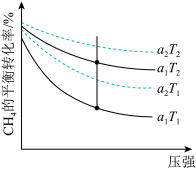
③下图表示初始投料比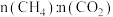 为1:3或1:4(投料比用
为1:3或1:4(投料比用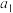 、
、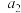 表示),
表示), 的平衡转化率在不同温度(
的平衡转化率在不同温度( 、
、 )下与压强的关系。
)下与压强的关系。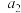 =
=_______ ,判断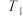 与
与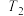 的大小关系,并说明理由:
的大小关系,并说明理由:_______ 。
(3)在一刚性密闭容器中, 和
和 的分压分别为
的分压分别为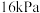 、
、 ,加入
,加入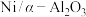 催化剂并加热至
催化剂并加热至 使其发生反应i。
使其发生反应i。
①研究表明 的生成速率
的生成速率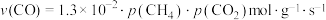 ,某时刻测得
,某时刻测得 ,则
,则 =
=_______  。
。
②达到平衡后测得体系压强是起始时的1.4倍,则该反应的平衡常数 =
=_______  (用平衡分压代替平衡浓度计算)。
(用平衡分压代替平衡浓度计算)。
(1)
 催化重整可得到合成气(
催化重整可得到合成气( 和
和 ),其工艺过程涉及如下反应:
),其工艺过程涉及如下反应:反应i:
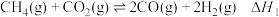
反应ii:


反应iii:
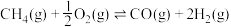
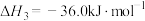
反应iv:
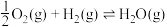
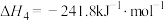
则
 =
= 。
。(2)其他条件不变,反应i在不同催化剂(I、II、III)作用下进行相同时间后,
 的转化率随反应温度的变化如图所示。
的转化率随反应温度的变化如图所示。
①a点所代表的状态
②b点
 的转化率高于c点,原因是
的转化率高于c点,原因是③下图表示初始投料比
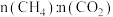 为1:3或1:4(投料比用
为1:3或1:4(投料比用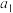 、
、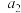 表示),
表示), 的平衡转化率在不同温度(
的平衡转化率在不同温度( 、
、 )下与压强的关系。
)下与压强的关系。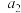 =
=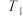 与
与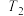 的大小关系,并说明理由:
的大小关系,并说明理由:
(3)在一刚性密闭容器中,
 和
和 的分压分别为
的分压分别为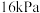 、
、 ,加入
,加入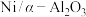 催化剂并加热至
催化剂并加热至 使其发生反应i。
使其发生反应i。①研究表明
 的生成速率
的生成速率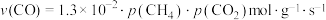 ,某时刻测得
,某时刻测得 ,则
,则 =
= 。
。②达到平衡后测得体系压强是起始时的1.4倍,则该反应的平衡常数
 =
= (用平衡分压代替平衡浓度计算)。
(用平衡分压代替平衡浓度计算)。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】纳米级Cu2O由于具有优良的催化性能而备受关往,下表为制取纳米级Cu2O的三种方法:
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是反应条件不易控制,若控制不当易生成________________ 而使Cu2O产率降低
(2)已知:2Cu(s)+1/2O2(g)=Cu2O(s);△H = -akJ·mol-1
C(s)+1/2O2(g)=CO(g);△H = -bkJ·mol-1
Cu(s)+ 1/2O2(g)=CuO(s);△H = -ckJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H =_________ kJ·mol-1
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如下图,阳极生成Cu2O,其电极反应式为___________________ 。
(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该反应的化学方程式为_________________________ 。
(5)肼又称联氨,易溶于水,是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因___________________ 。
(6)向1L恒容密闭容器中充入0.1molN2H4,在30℃、Ni-Pt催化剂作用下发生反应N2H4(g) ⇌N2(g)+2H2(g),测得混合物体系中,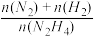 (用y表示)与时间的关系如图所示。0-4min时间内H2的平均生成速率v(H2)=
(用y表示)与时间的关系如图所示。0-4min时间内H2的平均生成速率v(H2)= ____ mol/(L·min);该温度下,反应的平衡常数=___________________ 。
| 方法I | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法,反应为2Cu +H2O Cu2O+H2↑。 Cu2O+H2↑。 |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
(2)已知:2Cu(s)+1/2O2(g)=Cu2O(s);△H = -akJ·mol-1
C(s)+1/2O2(g)=CO(g);△H = -bkJ·mol-1
Cu(s)+ 1/2O2(g)=CuO(s);△H = -ckJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H =
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如下图,阳极生成Cu2O,其电极反应式为

(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该反应的化学方程式为
(5)肼又称联氨,易溶于水,是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因
(6)向1L恒容密闭容器中充入0.1molN2H4,在30℃、Ni-Pt催化剂作用下发生反应N2H4(g) ⇌N2(g)+2H2(g),测得混合物体系中,
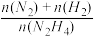 (用y表示)与时间的关系如图所示。0-4min时间内H2的平均生成速率v(H2)=
(用y表示)与时间的关系如图所示。0-4min时间内H2的平均生成速率v(H2)= 
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】甲醇作为一种重要的化工原料,对促进绿色社会的构建具有重要的意义。
(1)在 、
、 ,32g甲醇(
,32g甲醇( )完全燃烧放出的热量为
)完全燃烧放出的热量为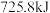 ,则表示甲醇燃烧热的热化学方程式为(已知常温下甲醇为液态)
,则表示甲醇燃烧热的热化学方程式为(已知常温下甲醇为液态)________
(2)在一定条件下可利用甲醇羰基化法制取甲酸甲酯,发生反应: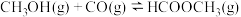 ,该反应在
,该反应在_______ 条件下能自发进行。
(3)向体积为 的密闭容器中充入
的密闭容器中充入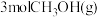 和
和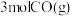 ,测得容器内的压强(
,测得容器内的压强(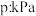 )随时间(
)随时间(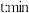 )的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示:
)的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示:

①反应Ⅰ在5min时达到平衡,在此条件下从反应开始到达到平衡时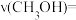
___________ 。
②Ⅲ和Ⅰ相比,2min中改变的反应条件可能是______________ 。
③反应Ⅱ在2min时达到平衡,平衡常数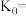
______ 。在温度和体积不变的条件下,在3min时再往容器中加入
 和
和
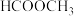 后,平衡
后,平衡______ 移动(填“正向”“逆向”或“不”),若5min时达到平衡状态,在图中画出3min后容器内压强随时间变化的曲线(不需要求出终点坐标)____________ 。
(4) 燃料电池具有启动快、效率高等优点。甲装置为
燃料电池具有启动快、效率高等优点。甲装置为 、
、 、
、 构成的燃料电池,其电极均为Pt电极。装置甲为装置乙充电。装置乙为铅蓄电池,其电池反应为:
构成的燃料电池,其电极均为Pt电极。装置甲为装置乙充电。装置乙为铅蓄电池,其电池反应为: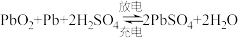
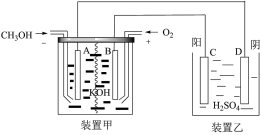
①写出甲装置中负极的电极反应式______________________
②写出乙装置中C极的电极反应式______________________
(1)在
 、
、 ,32g甲醇(
,32g甲醇( )完全燃烧放出的热量为
)完全燃烧放出的热量为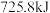 ,则表示甲醇燃烧热的热化学方程式为(已知常温下甲醇为液态)
,则表示甲醇燃烧热的热化学方程式为(已知常温下甲醇为液态)(2)在一定条件下可利用甲醇羰基化法制取甲酸甲酯,发生反应:
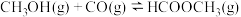 ,该反应在
,该反应在(3)向体积为
 的密闭容器中充入
的密闭容器中充入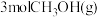 和
和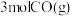 ,测得容器内的压强(
,测得容器内的压强(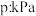 )随时间(
)随时间(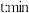 )的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示:
)的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示:
①反应Ⅰ在5min时达到平衡,在此条件下从反应开始到达到平衡时
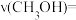
②Ⅲ和Ⅰ相比,2min中改变的反应条件可能是
③反应Ⅱ在2min时达到平衡,平衡常数
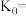

 和
和
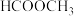 后,平衡
后,平衡(4)
 燃料电池具有启动快、效率高等优点。甲装置为
燃料电池具有启动快、效率高等优点。甲装置为 、
、 、
、 构成的燃料电池,其电极均为Pt电极。装置甲为装置乙充电。装置乙为铅蓄电池,其电池反应为:
构成的燃料电池,其电极均为Pt电极。装置甲为装置乙充电。装置乙为铅蓄电池,其电池反应为: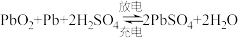

①写出甲装置中负极的电极反应式
②写出乙装置中C极的电极反应式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。甲烷水蒸气催化重整是制备高纯氢的方法之一。
Ⅰ.一种利用太阳能催化该反应的原理如图1所示,以气体分压(单位为kPa)表示的各步反应的平衡常数( )与温度(T)变化关系如图2所示。
)与温度(T)变化关系如图2所示。
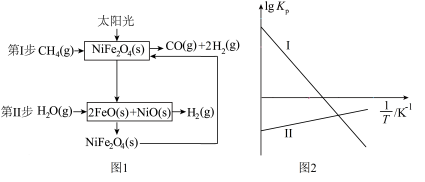
(1)根据图1分析该反应的催化剂为___________ 。
(2)甲烷水蒸气重整制氢反应 的
的
___________ 0(填“>”“<”或“=”),该反应在___________ (填“高温”或“低温”)条件下容易自发进行。
Ⅱ.甲烷水汽重整反应是我国主要的制氢技术,有关反应如下:
反应ⅰ:
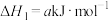 ;
;
反应ⅱ:
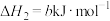 。
。
(3)对于反应ⅰ,下列叙述正确的是___________(填标号)。
(4)一定温度下,向恒容密闭反应器中通入 和
和 ,起始时
,起始时 和
和 的分压分别为
的分压分别为 、
、 ,发生反应ⅰ和反应ⅱ。反应进行
,发生反应ⅰ和反应ⅱ。反应进行 时达到平衡状态,此时
时达到平衡状态,此时 、
、 的分压分别为
的分压分别为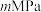 、
、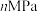 。
。
① 的平衡分压为
的平衡分压为___________ MPa(用含m,n的代数式表示,下同)。
②反应ⅱ的
___________ (用平衡时各物质的分压代替物质的量浓度)。
③复合载氧体可以氧化甲烷制取合成气( 、
、 ),如图为350℃时载氧体的质量与时间的关系[一定条件下有积碳反应发生,反应ⅲ:
),如图为350℃时载氧体的质量与时间的关系[一定条件下有积碳反应发生,反应ⅲ: 或反应ⅳ:
或反应ⅳ: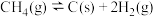 ]。
]。
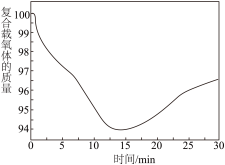
从开始到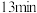 的时候,曲线呈下降趋势的原因主要是甲烷还原载氧体,载氧体失去氧而出现失重的情况;反应在
的时候,曲线呈下降趋势的原因主要是甲烷还原载氧体,载氧体失去氧而出现失重的情况;反应在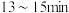 时,出现了一个短暂的小平台,其主要的原因是
时,出现了一个短暂的小平台,其主要的原因是___________ 。
Ⅰ.一种利用太阳能催化该反应的原理如图1所示,以气体分压(单位为kPa)表示的各步反应的平衡常数(
 )与温度(T)变化关系如图2所示。
)与温度(T)变化关系如图2所示。
(1)根据图1分析该反应的催化剂为
(2)甲烷水蒸气重整制氢反应
 的
的
Ⅱ.甲烷水汽重整反应是我国主要的制氢技术,有关反应如下:
反应ⅰ:

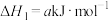 ;
;反应ⅱ:

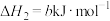 。
。(3)对于反应ⅰ,下列叙述正确的是___________(填标号)。
| A.恒温、恒容条件下,加入水蒸气,活化分子百分数增大,反应速率增大 |
| B.升高温度,活化分子百分数增大,有效碰撞频率增大,反应速率增大 |
C.恒温、恒容条件下,加入惰性气体,压强增大, 的平衡转化率减小 的平衡转化率减小 |
| D.加入合适的催化剂,同时降低反应温度,能实现单位时间内转化率不变 |
 和
和 ,起始时
,起始时 和
和 的分压分别为
的分压分别为 、
、 ,发生反应ⅰ和反应ⅱ。反应进行
,发生反应ⅰ和反应ⅱ。反应进行 时达到平衡状态,此时
时达到平衡状态,此时 、
、 的分压分别为
的分压分别为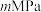 、
、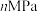 。
。①
 的平衡分压为
的平衡分压为②反应ⅱ的

③复合载氧体可以氧化甲烷制取合成气(
 、
、 ),如图为350℃时载氧体的质量与时间的关系[一定条件下有积碳反应发生,反应ⅲ:
),如图为350℃时载氧体的质量与时间的关系[一定条件下有积碳反应发生,反应ⅲ: 或反应ⅳ:
或反应ⅳ: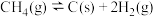 ]。
]。
从开始到
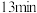 的时候,曲线呈下降趋势的原因主要是甲烷还原载氧体,载氧体失去氧而出现失重的情况;反应在
的时候,曲线呈下降趋势的原因主要是甲烷还原载氧体,载氧体失去氧而出现失重的情况;反应在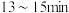 时,出现了一个短暂的小平台,其主要的原因是
时,出现了一个短暂的小平台,其主要的原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】(一)高效利用能源并且减少 的排放,对完成“碳中和”的目标有重要意义。
的排放,对完成“碳中和”的目标有重要意义。
Ⅰ.可用下列方法把 转化成甲醇燃料
转化成甲醇燃料
(1)①
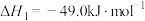
②
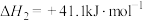
反应①在_______ (选填“高温”、“低温”或“任意温度”)下,易自发进行。
Ⅱ.利用 与
与 合成甲醇涉及的主要反应如下:
合成甲醇涉及的主要反应如下:
a.

b.
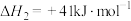
试回答下列问题:
(2)已知
 ,则
,则
_______ 
(3)向刚性容器中充入一定量的 和
和 ,在不同催化剂(Cat.1,Cat.2)下经相同反应时间,
,在不同催化剂(Cat.1,Cat.2)下经相同反应时间, 的转化率和甲醇的选择性[甲醇的选择性
的转化率和甲醇的选择性[甲醇的选择性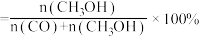 ]随温度的变化如图所示:
]随温度的变化如图所示:_______ Cat.2(填“>”“<”或“=”)。
②在210~270℃间, 的选择性随温度的升高而下降,请写出一条可能原因
的选择性随温度的升高而下降,请写出一条可能原因_______ 。
(4)一定条件下,向刚性容器中充入物质的量之比为1∶3的 和
和 发生上述反应。有利于提高甲醇平衡产率的条件是_______(填标号)。
发生上述反应。有利于提高甲醇平衡产率的条件是_______(填标号)。
(二)2021年我国制氢量位居世界第一,煤的气化是一种重要的制氢途径。回答下列问题:
在一定温度下,向体积固定的密闭容器中加入足量的 和1 mol
和1 mol ,起始压强为0.2MPa时,发生下列反应生成水煤气:
,起始压强为0.2MPa时,发生下列反应生成水煤气:
Ⅰ.
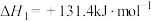
Ⅱ.
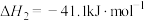
(5)下列说法正确的是________
(6)反应平衡时, 的转化率为50%,CO的物质的量为0.1 mol。此时反应Ⅰ的平衡常数Kp=
的转化率为50%,CO的物质的量为0.1 mol。此时反应Ⅰ的平衡常数Kp=_______ MPa(以分压表示,分压=总压×物质的量分数)。
 的排放,对完成“碳中和”的目标有重要意义。
的排放,对完成“碳中和”的目标有重要意义。Ⅰ.可用下列方法把
 转化成甲醇燃料
转化成甲醇燃料(1)①

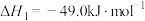
②

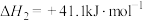
反应①在
Ⅱ.利用
 与
与 合成甲醇涉及的主要反应如下:
合成甲醇涉及的主要反应如下:a.


b.

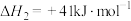
试回答下列问题:
(2)已知

 ,则
,则

(3)向刚性容器中充入一定量的
 和
和 ,在不同催化剂(Cat.1,Cat.2)下经相同反应时间,
,在不同催化剂(Cat.1,Cat.2)下经相同反应时间, 的转化率和甲醇的选择性[甲醇的选择性
的转化率和甲醇的选择性[甲醇的选择性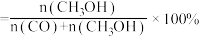 ]随温度的变化如图所示:
]随温度的变化如图所示: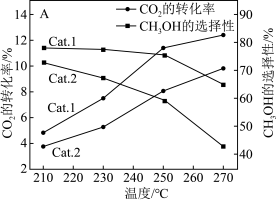
②在210~270℃间,
 的选择性随温度的升高而下降,请写出一条可能原因
的选择性随温度的升高而下降,请写出一条可能原因(4)一定条件下,向刚性容器中充入物质的量之比为1∶3的
 和
和 发生上述反应。有利于提高甲醇平衡产率的条件是_______(填标号)。
发生上述反应。有利于提高甲醇平衡产率的条件是_______(填标号)。| A.高温高压 | B.低温高压 | C.高温低压 | D.低温低压 |
(二)2021年我国制氢量位居世界第一,煤的气化是一种重要的制氢途径。回答下列问题:
在一定温度下,向体积固定的密闭容器中加入足量的
 和1 mol
和1 mol ,起始压强为0.2MPa时,发生下列反应生成水煤气:
,起始压强为0.2MPa时,发生下列反应生成水煤气:Ⅰ.

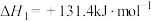
Ⅱ.

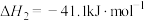
(5)下列说法正确的是________
| A.平衡时向容器中充入惰性气体,反应Ⅰ的平衡逆向移动 |
| B.混合气体的密度保持不变时,说明反应体系已达到平衡 |
| C.将炭块粉碎,可加快反应速率 |
D.平衡时 的体积分数可能大于 的体积分数可能大于 |
 的转化率为50%,CO的物质的量为0.1 mol。此时反应Ⅰ的平衡常数Kp=
的转化率为50%,CO的物质的量为0.1 mol。此时反应Ⅰ的平衡常数Kp=
您最近一年使用:0次



