关于有效碰撞理论,下列说法正确的是
| A.分子间所发生的碰撞均为有效碰撞 |
| B.活化分子具有的能量就是活化能 |
| C.增大压强,活化分子数一定增加,化学反应速率一定加快 |
| D.升高温度可以加快化学反应速率,原因之一是提高了活化分子百分数 |
更新时间:2022-11-08 18:58:32
|
相似题推荐
单选题
|
适中
(0.65)
名校
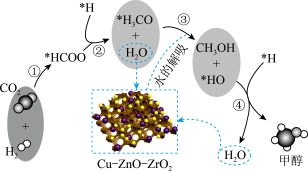
【推荐1】我国科研人员研究了在催化剂上加氢制甲醇过程中水的作用机理,其主反应历程如图所示 。下列说法错误的是
。下列说法错误的是
 。下列说法错误的是
。下列说法错误的是
| A.向该反应体系中加入少量的水能增加甲醇的收率 |
| B.带*标记的物质是该反应历程中的中间产物 |
C.二氧化碳加氢制甲醇的过程中原子利用率达 |
D.第③步的反应式为 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】已知 呈蓝色,
呈蓝色, 呈黄色。在
呈黄色。在 溶液中存在如下平衡
溶液中存在如下平衡
 ,下列叙述正确的是
,下列叙述正确的是
 呈蓝色,
呈蓝色, 呈黄色。在
呈黄色。在 溶液中存在如下平衡
溶液中存在如下平衡
 ,下列叙述正确的是
,下列叙述正确的是A.将 溶液置于冰水中,溶液黄色加深 溶液置于冰水中,溶液黄色加深 |
B.增大 浓度,可提高 浓度,可提高 的平衡转化率 的平衡转化率 |
| C.平衡体系中加入盐酸,活化分子百分数增加,有效碰撞次数增加 |
| D.加水稀释,正反应速率减小的倍数大于逆反应速率减小的倍数,平衡逆向移动 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐3】氯化碘(ICl)是一种卤素互化物,与氢气存在如下反应:2ICl(s)+ H2(g)=2HCl(g)+ I2(s) ΔH=-218 kJ·mol-1,该反应实际上分两步进行:
①H2(g)+ ICl(g)=HI(g)十HCl(g)(慢反应)
②HI(g)+ ICl(s)=I2(s)+ HCl( g)(快反应)
下列说法中正确的是
①H2(g)+ ICl(g)=HI(g)十HCl(g)(慢反应)
②HI(g)+ ICl(s)=I2(s)+ HCl( g)(快反应)
下列说法中正确的是
| A.ICl与水发生非氧化还原反应生成HI |
| B.两步反应的活化能之和等于-218 kJ·mol‑1 |
| C.总反应速率的快慢由反应①决定 |
| D.加入催化剂将影响最终总反应的反应热 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】某温度下,密闭容器中发生反应aX(g) bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y的浓度是原来的1.8倍。则下列叙述中正确的是
bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y的浓度是原来的1.8倍。则下列叙述中正确的是
 bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y的浓度是原来的1.8倍。则下列叙述中正确的是
bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y的浓度是原来的1.8倍。则下列叙述中正确的是| A.可逆反应的化学方程式的化学计量数:a>b+c |
| B.压缩容器的容积时,v(正)增大,v(逆)减小 |
| C.达到新平衡时,物质X的转化率减小 |
| D.达到新平衡时,混合物中Z的质量分数增大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】在催化剂a和催化剂b的作用下,氮气分子参与反应的有关反应历程如图所示。下列说法正确的是
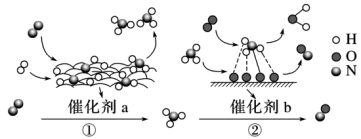

| A.过程①氮气会完全转化为氨气 |
| B.过程②中参加反应的分子,化学键未完全断裂 |
| C.过程①的反应若在恒压条件下充入氩气,反应速率不变 |
| D.温度不变,缩小体积,过程①②的反应速率均增大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐3】一定条件下可合成乙烯:6H2(g)+2CO2(g) ⇌CH2=CH2 (g)+4H2O(g) 已知温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法正确的是
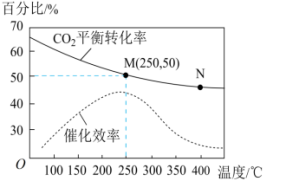
| A.温度不变,若增大压强,ν正增加、ν逆减小 |
| B.升高温度,平衡向逆反应方向移动,催化剂的催化效率降低 |
| C.温度不变,若恒压下向平衡体系中充入惰性气体,平衡不移动 |
| D.若投料比n(H2):n(CO2)=3:1,则图中 M点乙烯的体积分数为7.7% |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】反应aX(g)+bY(g) cZ(g) ∆H<0(放热反应),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示。下列判断正确的是:
cZ(g) ∆H<0(放热反应),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示。下列判断正确的是:

 cZ(g) ∆H<0(放热反应),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示。下列判断正确的是:
cZ(g) ∆H<0(放热反应),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示。下列判断正确的是:
| A.T1<T2,P1<P2,a+b<c | B.T1<T2,P1>P2, a+b<c |
| C.T1>T2,P1>P2, a+b>c | D.T1>T2,P1<P2 ,a+b>c |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】对于可逆反应N2(g) + 3H2(g)  2NH3(g) ΔH < 0。下列研究目的和图示相符的是
2NH3(g) ΔH < 0。下列研究目的和图示相符的是
 2NH3(g) ΔH < 0。下列研究目的和图示相符的是
2NH3(g) ΔH < 0。下列研究目的和图示相符的是 | 选项 | 研究目的 | 图示 |
| A | 温度(T)对反应的温度(T1 > T2) |  |
| B | 压强(p)对平衡常数的影响 |  |
| C | 温度(T)对反应的影响 |  |
| D | 压强(p)对反应的影响(P2 > P1) |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次







