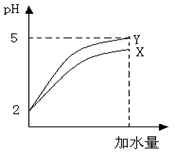
关于电离子平衡CH3COOH CH3COO-+H+的说法中正确的是
CH3COO-+H+的说法中正确的是
 CH3COO-+H+的说法中正确的是
CH3COO-+H+的说法中正确的是| A.加入几滴浓盐酸,平衡逆移动,电离平衡常数Ka变小 |
B.加水稀释 变大 变大 |
| C.加入少量CH3COONa晶体,平衡逆移动,c(CH3COO-)减小 |
| D.加水稀释,平衡正向移动,导电能力增强 |
更新时间:2022-11-03 15:26:20
|
相似题推荐
单选题
|
较易
(0.85)
【推荐1】化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂:HIn(溶液,红色)⇌H+(溶液)+In-(溶液,黄色),浓度为 的下列各溶液,其中能使指示剂显红色的是
的下列各溶液,其中能使指示剂显红色的是
①食醋 ②石灰水 ③食盐水 ④柠檬水 ⑤苏打水 ⑥氨水
 的下列各溶液,其中能使指示剂显红色的是
的下列各溶液,其中能使指示剂显红色的是①食醋 ②石灰水 ③食盐水 ④柠檬水 ⑤苏打水 ⑥氨水
| A.①④ | B.①④⑤ | C.②⑤⑥ | D.②③⑥ |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐2】在20℃1LH2S的饱和溶液中,浓度约为0.1mol·L-1,其电离方程式为:H2S H++HS-,HS-
H++HS-,HS- H++S2-,若使该溶液c(S2-)增大,可采用的措施是
H++S2-,若使该溶液c(S2-)增大,可采用的措施是
 H++HS-,HS-
H++HS-,HS- H++S2-,若使该溶液c(S2-)增大,可采用的措施是
H++S2-,若使该溶液c(S2-)增大,可采用的措施是| A.加入适量NaOH固体 | B.加入适量水 |
| C.通入硫化氢气体 | D.加入适量CuSO4固体 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐1】25℃时,有关弱酸的电离平衡常数如下,则下列有关说法不正确的是
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7K2=5.6×10-11 |
| A.25℃时,若同浓度的醋酸和氢氧化钠等体积混合,所得溶液pH=8,则 |
| B.25℃时,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)相等 |
| C.25℃时,0.1mol/L的各溶液的pH关系pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) |
| D.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】常温下,在新制氯水中滴加NaOH溶液,溶液中由水电离出的c(H+)的对数与滴加的NaOH溶液的体积之间的关系如图所示,下 列推断正确的是


| A.用pH试纸测定E点对应溶液,其pH=3 |
| B.H、F点对应溶液中都存在c(Na+)=c(C1-)+c(ClO-) |
| C.G点对应溶液中: c(Na+)>c(Cl-)>c(ClO-)>c(OH-)>c(H+) |
| D.常温下加水稀释H点对应溶液,溶液的pH增大 |
您最近一年使用:0次