乳酸亚铁晶体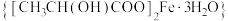 (相对分子质量:288),可由乳酸与
(相对分子质量:288),可由乳酸与 反应制得,它易溶于水,几乎不溶于乙醇,是一种很好的补铁剂,但其水溶液易被氧化,光照可促进氧化。
反应制得,它易溶于水,几乎不溶于乙醇,是一种很好的补铁剂,但其水溶液易被氧化,光照可促进氧化。
Ⅰ.制备碳酸亚铁:装置如图所示。
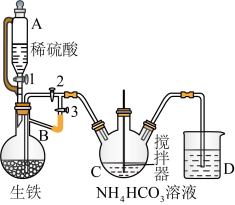
(1)仪器C的名称是_______ 。
(2)该实验使用生铁比纯铁更好,原因为_______ 。
(3)实验操作如下:关闭活塞2,打开活塞1、3,加入适量稀硫酸反应一段时间,其目的是_______ ,然后关闭活塞1,打开活塞2,关闭活塞3,此后,C装置溶液中有沉淀生成,并有大量气泡冒出,则C中发生反应的离子方程式为_______ 。
Ⅱ.制备乳酸亚铁。
(4)向纯净的 固体加入足量乳酸溶液,在75℃下搅拌使之充分反应。该反应的加热方式
固体加入足量乳酸溶液,在75℃下搅拌使之充分反应。该反应的加热方式_______ 。为防止乳酸亚铁变质,在上述体系中还应加入适量_______ 。反应结束后,将所得溶液隔绝空气低温浓缩、降温结晶、过滤、洗涤、干燥,得乳酸亚铁晶体。
Ⅲ.乳酸亚铁晶体纯度的测量。
(5)某同学查阅文献后,用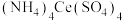 滴定法测定样品中
滴定法测定样品中 的含量并计算样品纯度(反应中
的含量并计算样品纯度(反应中 还原为
还原为 ),他称取6.00 g样品,配制成250.00 mL溶液,取出25.00 mL,用浓度为0.10mol⋅L-1的
),他称取6.00 g样品,配制成250.00 mL溶液,取出25.00 mL,用浓度为0.10mol⋅L-1的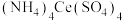 标准溶液滴定至终点,消耗标准液20.00 mL。则产品中乳酸亚铁晶体的纯度为
标准溶液滴定至终点,消耗标准液20.00 mL。则产品中乳酸亚铁晶体的纯度为_______ (保留三位有效数字,以质量分数表示)。
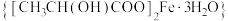 (相对分子质量:288),可由乳酸与
(相对分子质量:288),可由乳酸与 反应制得,它易溶于水,几乎不溶于乙醇,是一种很好的补铁剂,但其水溶液易被氧化,光照可促进氧化。
反应制得,它易溶于水,几乎不溶于乙醇,是一种很好的补铁剂,但其水溶液易被氧化,光照可促进氧化。Ⅰ.制备碳酸亚铁:装置如图所示。

(1)仪器C的名称是
(2)该实验使用生铁比纯铁更好,原因为
(3)实验操作如下:关闭活塞2,打开活塞1、3,加入适量稀硫酸反应一段时间,其目的是
Ⅱ.制备乳酸亚铁。
(4)向纯净的
 固体加入足量乳酸溶液,在75℃下搅拌使之充分反应。该反应的加热方式
固体加入足量乳酸溶液,在75℃下搅拌使之充分反应。该反应的加热方式Ⅲ.乳酸亚铁晶体纯度的测量。
(5)某同学查阅文献后,用
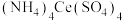 滴定法测定样品中
滴定法测定样品中 的含量并计算样品纯度(反应中
的含量并计算样品纯度(反应中 还原为
还原为 ),他称取6.00 g样品,配制成250.00 mL溶液,取出25.00 mL,用浓度为0.10mol⋅L-1的
),他称取6.00 g样品,配制成250.00 mL溶液,取出25.00 mL,用浓度为0.10mol⋅L-1的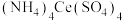 标准溶液滴定至终点,消耗标准液20.00 mL。则产品中乳酸亚铁晶体的纯度为
标准溶液滴定至终点,消耗标准液20.00 mL。则产品中乳酸亚铁晶体的纯度为
更新时间:2022-12-07 16:37:25
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】以镍黄铁矿为原料制备 的工艺流程如下:
的工艺流程如下:
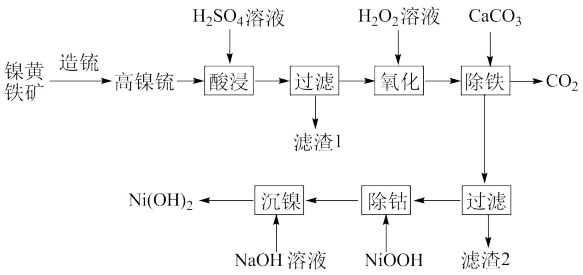
已知:①高镍锍的主要成分为 、
、 、
、 、
、 及
及 、
、 、
、 、
、 ;
;
②氧化性: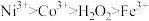 ;
;
③ 。
。
回答下列问题:
(1)为了提高镍元素的浸出率,在“酸浸”时可采取的措施有:①适当升高温度;②搅拌;③___ 等
(2)“过滤”时滤渣1的主要成分是___________ 。
(3)结合化学用语解释“除铁”的原理是___________ 。
(4)“沉镍”后需过滤、洗涤,证明沉淀已洗涤干净的方法是___________ 。若“沉镍”后的滤液中c(Ni2+) ,则滤液的
,则滤液的
___________ (该操作在常温下进行)。
(5)“除钴”时,发生反应的离子方程式为___________ 。
(6)测定 样品的纯度:取
样品的纯度:取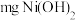 样品完全溶于稀硫酸,加入
样品完全溶于稀硫酸,加入 的
的 溶液,使
溶液,使 完全反应,煮沸,加入几滴
完全反应,煮沸,加入几滴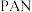 作指示剂,趁热用
作指示剂,趁热用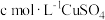 溶液滴定过量的
溶液滴定过量的 ,当滴定至溶液呈紫红色时,达到滴定终点,消耗
,当滴定至溶液呈紫红色时,达到滴定终点,消耗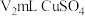 溶液(假设杂质不参与反应),则该
溶液(假设杂质不参与反应),则该 样品的纯度为
样品的纯度为___________ %(已知: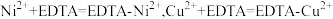 )。如果滴定管用蒸馏水洗涤后未用待装溶液润洗,则测定结果
)。如果滴定管用蒸馏水洗涤后未用待装溶液润洗,则测定结果_______ (填“偏高”“偏低”或“无影响”)。
 的工艺流程如下:
的工艺流程如下:
已知:①高镍锍的主要成分为
 、
、 、
、 、
、 及
及 、
、 、
、 、
、 ;
;②氧化性:
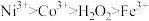 ;
;③
 。
。回答下列问题:
(1)为了提高镍元素的浸出率,在“酸浸”时可采取的措施有:①适当升高温度;②搅拌;③
(2)“过滤”时滤渣1的主要成分是
(3)结合化学用语解释“除铁”的原理是
(4)“沉镍”后需过滤、洗涤,证明沉淀已洗涤干净的方法是
 ,则滤液的
,则滤液的
(5)“除钴”时,发生反应的离子方程式为
(6)测定
 样品的纯度:取
样品的纯度:取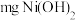 样品完全溶于稀硫酸,加入
样品完全溶于稀硫酸,加入 的
的 溶液,使
溶液,使 完全反应,煮沸,加入几滴
完全反应,煮沸,加入几滴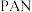 作指示剂,趁热用
作指示剂,趁热用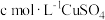 溶液滴定过量的
溶液滴定过量的 ,当滴定至溶液呈紫红色时,达到滴定终点,消耗
,当滴定至溶液呈紫红色时,达到滴定终点,消耗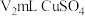 溶液(假设杂质不参与反应),则该
溶液(假设杂质不参与反应),则该 样品的纯度为
样品的纯度为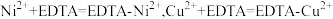 )。如果滴定管用蒸馏水洗涤后未用待装溶液润洗,则测定结果
)。如果滴定管用蒸馏水洗涤后未用待装溶液润洗,则测定结果
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】硫代硫酸钠(Na2S2O3)俗称保险粉,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等。实验室可通过如下反应制取:2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2。
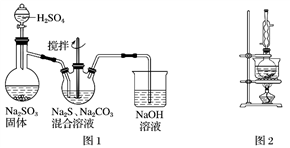
(1)用图1所示装置制取Na2S2O3,其中NaOH溶液的作用是________________________ 。如将分液漏斗中的H2SO4改成浓盐酸,则三颈烧瓶内除生成Na2S2O3外,还有________ (填化学式)杂质生成。
(2)为测定所得保险粉样品中Na2S2O3·5H2O的质量分数,可用标准碘溶液进行滴定,反应方程式为2Na2S2O3+I2===2NaI+Na2S4O6。
①利用KIO3、KI和HCl可配制标准碘溶液。写出配制时所发生反应的离子方程式:_______________________________________________________________________ 。
②准确称取一定质量的Na2S2O3·5H2O样品于锥形瓶中,加水溶解,并滴加________ 作指示剂,用所配制的标准碘溶液滴定。滴定时所用的玻璃仪器除锥形瓶外,还有________ 。
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果________ (填“偏高”、“偏低”或“不变”)。
(3)本实验对Na2S的纯度要求较高,利用图2所示的装置可将工业级的Na2S提纯。已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精。提纯步骤如下,请填写实验操作。
①将已称量好的工业Na2S放入圆底烧瓶中,并加入一定质量的酒精和少量水;
②按图2所示组装所需仪器,向冷凝管中通入冷却水,水浴加热;
③待________________ 时,停止加热,将烧瓶取下;
④____________________________________________________________________ ;
⑤____________________________________________________________________ ;
⑥将所得固体洗涤、干燥,得到Na2S·9H2O晶体。

(1)用图1所示装置制取Na2S2O3,其中NaOH溶液的作用是
(2)为测定所得保险粉样品中Na2S2O3·5H2O的质量分数,可用标准碘溶液进行滴定,反应方程式为2Na2S2O3+I2===2NaI+Na2S4O6。
①利用KIO3、KI和HCl可配制标准碘溶液。写出配制时所发生反应的离子方程式:
②准确称取一定质量的Na2S2O3·5H2O样品于锥形瓶中,加水溶解,并滴加
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果
(3)本实验对Na2S的纯度要求较高,利用图2所示的装置可将工业级的Na2S提纯。已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精。提纯步骤如下,请填写实验操作。
①将已称量好的工业Na2S放入圆底烧瓶中,并加入一定质量的酒精和少量水;
②按图2所示组装所需仪器,向冷凝管中通入冷却水,水浴加热;
③待
④
⑤
⑥将所得固体洗涤、干燥,得到Na2S·9H2O晶体。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】某课外活动小组设计如下装置制备 ,并探究
,并探究 的性质(夹持仪器已省略),已知:
的性质(夹持仪器已省略),已知: 极易溶于水并与水反应生成HClO;
极易溶于水并与水反应生成HClO; 的沸点为3.8℃,42℃以上分解为
的沸点为3.8℃,42℃以上分解为 和
和 ;实验中向B中通入
;实验中向B中通入 和空气要控制一定的比例。
和空气要控制一定的比例。
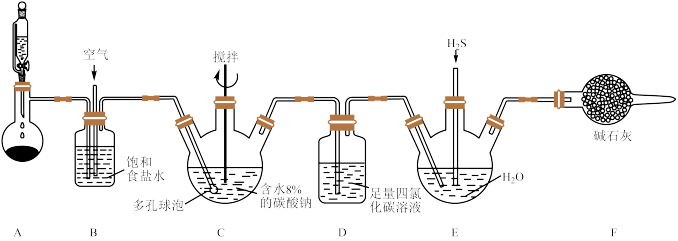
请回答下列问题:
(1)装置A圆底烧瓶中盛装的药品可以是___________ (写一种即可)。
(2)装置B的作用是___________ ;多孔球泡的作用是___________ 。
(3)装置C需要放在冷水中,其目的是___________ 。
(4)装置C中反应除了生成 外,还生成了两种盐,请写出其化学方程式
外,还生成了两种盐,请写出其化学方程式___________ 。
(5)实验中观察到E中溶液变浑浊,则E中发生反应的化学方程式为___________ ;请设计实验验证E中通入的 不足:
不足:___________ ;测定E中过量的 与水反应生成的HClO的浓度的操作是:取20.00mLE中清液于锥形瓶中,并加入10.00mL0.800mol/L的
与水反应生成的HClO的浓度的操作是:取20.00mLE中清液于锥形瓶中,并加入10.00mL0.800mol/L的 溶液,充分反应后,用0.0500mol/L的
溶液,充分反应后,用0.0500mol/L的 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液的体积为28.00mL(该条件下
溶液的体积为28.00mL(该条件下 不氧化
不氧化 ),则E中生成的次氯酸的浓度为
),则E中生成的次氯酸的浓度为___________ mol/L。
 ,并探究
,并探究 的性质(夹持仪器已省略),已知:
的性质(夹持仪器已省略),已知: 极易溶于水并与水反应生成HClO;
极易溶于水并与水反应生成HClO; 的沸点为3.8℃,42℃以上分解为
的沸点为3.8℃,42℃以上分解为 和
和 ;实验中向B中通入
;实验中向B中通入 和空气要控制一定的比例。
和空气要控制一定的比例。
请回答下列问题:
(1)装置A圆底烧瓶中盛装的药品可以是
(2)装置B的作用是
(3)装置C需要放在冷水中,其目的是
(4)装置C中反应除了生成
 外,还生成了两种盐,请写出其化学方程式
外,还生成了两种盐,请写出其化学方程式(5)实验中观察到E中溶液变浑浊,则E中发生反应的化学方程式为
 不足:
不足: 与水反应生成的HClO的浓度的操作是:取20.00mLE中清液于锥形瓶中,并加入10.00mL0.800mol/L的
与水反应生成的HClO的浓度的操作是:取20.00mLE中清液于锥形瓶中,并加入10.00mL0.800mol/L的 溶液,充分反应后,用0.0500mol/L的
溶液,充分反应后,用0.0500mol/L的 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液的体积为28.00mL(该条件下
溶液的体积为28.00mL(该条件下 不氧化
不氧化 ),则E中生成的次氯酸的浓度为
),则E中生成的次氯酸的浓度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】TiCl4是制备钛及其化合物的重要中间体,可利用下列装置在实验室制备TiCl4 (夹持装置略去)。 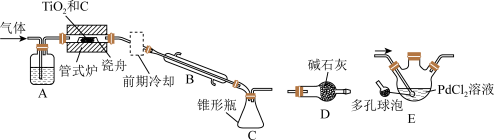
已知:① 溶液捕获CO时生成Pd单质;
溶液捕获CO时生成Pd单质;
② 能溶于有机溶剂,遇水会水解生成难溶于水的物质;
能溶于有机溶剂,遇水会水解生成难溶于水的物质; 难溶于水。
难溶于水。
回答下列问题:
(1)检查装置气密性后,A装置中加入的药品为_______ ,管式炉中加入 和C,先通入
和C,先通入 其目的是
其目的是_______ ;一段时间后,加热管式炉,改通 ,对C处逸出的气体用D、E装置进行后续处理。D中碱石灰的作用是
,对C处逸出的气体用D、E装置进行后续处理。D中碱石灰的作用是_______ ,E中反应的化学方程式为_______ 。
(2)实验过程中,产生的高温气体在进入装置B之前要进行“前期冷却”,原因是_______ 。制得的 中常含有少量
中常含有少量 ,从混合液体中分离出
,从混合液体中分离出 的操作名称为
的操作名称为_______ 。
(3) 是制取航天航空工业材料——钛合金的重要原料。某钛合金的元素还有Al和Si等,已知在常温下,钛是一种耐强酸强碱的金属,请设计实验检验其中的Si元素:
是制取航天航空工业材料——钛合金的重要原料。某钛合金的元素还有Al和Si等,已知在常温下,钛是一种耐强酸强碱的金属,请设计实验检验其中的Si元素:_______ 。
(4)用 水解法制备纳米
水解法制备纳米 的工艺流程见下图,成功的控制水解速率是制备纳米
的工艺流程见下图,成功的控制水解速率是制备纳米 的前提。
的前提。

已知: 难溶于冷水,在热水中易水解;
难溶于冷水,在热水中易水解; 的水解是由水解、电离、水解三步进行(如下):
的水解是由水解、电离、水解三步进行(如下):
①水解:
②电离: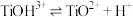
③水解: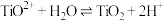
其中①为快反应,对②、③反应的影响是_______ ,加入硫酸铵的目的是_______ 。

已知:①
 溶液捕获CO时生成Pd单质;
溶液捕获CO时生成Pd单质;②
 能溶于有机溶剂,遇水会水解生成难溶于水的物质;
能溶于有机溶剂,遇水会水解生成难溶于水的物质; 难溶于水。
难溶于水。回答下列问题:
(1)检查装置气密性后,A装置中加入的药品为
 和C,先通入
和C,先通入 其目的是
其目的是 ,对C处逸出的气体用D、E装置进行后续处理。D中碱石灰的作用是
,对C处逸出的气体用D、E装置进行后续处理。D中碱石灰的作用是(2)实验过程中,产生的高温气体在进入装置B之前要进行“前期冷却”,原因是
 中常含有少量
中常含有少量 ,从混合液体中分离出
,从混合液体中分离出 的操作名称为
的操作名称为(3)
 是制取航天航空工业材料——钛合金的重要原料。某钛合金的元素还有Al和Si等,已知在常温下,钛是一种耐强酸强碱的金属,请设计实验检验其中的Si元素:
是制取航天航空工业材料——钛合金的重要原料。某钛合金的元素还有Al和Si等,已知在常温下,钛是一种耐强酸强碱的金属,请设计实验检验其中的Si元素:(4)用
 水解法制备纳米
水解法制备纳米 的工艺流程见下图,成功的控制水解速率是制备纳米
的工艺流程见下图,成功的控制水解速率是制备纳米 的前提。
的前提。
已知:
 难溶于冷水,在热水中易水解;
难溶于冷水,在热水中易水解; 的水解是由水解、电离、水解三步进行(如下):
的水解是由水解、电离、水解三步进行(如下):①水解:

②电离:
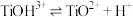
③水解:
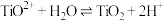
其中①为快反应,对②、③反应的影响是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】硼、镁及其化合物在工农业生产中应用广泛。已知:硼镁矿主要成分为 ,硼砂的化学式为
,硼砂的化学式为 ,利用硼镁矿制取金属镁及粗硼的工艺流程如图,请回答下列有关问题:
,利用硼镁矿制取金属镁及粗硼的工艺流程如图,请回答下列有关问题:
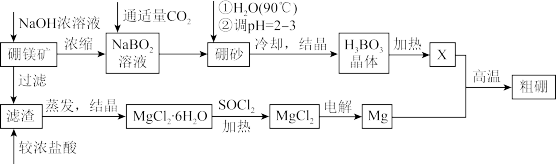
(1)滤渣的主要成分为___________ ,X为 晶体加热脱水的产物,其与Mg反应制取粗硼的化学方程式为
晶体加热脱水的产物,其与Mg反应制取粗硼的化学方程式为___________ 。
(2) 是一种一元弱酸,也可写作
是一种一元弱酸,也可写作 ,它与水作用时结合水电离的
,它与水作用时结合水电离的 而呈酸性,这一变化的离子方程式为
而呈酸性,这一变化的离子方程式为___________ 。以硼酸为原料可制得硼氢化钠( ),它是有机合成中的重要还原剂,其电子式为
),它是有机合成中的重要还原剂,其电子式为___________ 。
(3)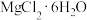 在
在 氛围中加热的化学方程式为
氛围中加热的化学方程式为___________ 。
(4)制得的粗硼在一定条件下可生成 ,
, 加热分解可以得到纯净的单质硼。现将
加热分解可以得到纯净的单质硼。现将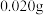 粗硼制成的
粗硼制成的 完全分解,生成的
完全分解,生成的 用
用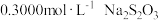 (
( 为弱酸)溶液滴定至终点,消耗
为弱酸)溶液滴定至终点,消耗 溶液
溶液 。该粗硼样品的纯度为
。该粗硼样品的纯度为___________ (提示: )。
)。
 ,硼砂的化学式为
,硼砂的化学式为 ,利用硼镁矿制取金属镁及粗硼的工艺流程如图,请回答下列有关问题:
,利用硼镁矿制取金属镁及粗硼的工艺流程如图,请回答下列有关问题:
(1)滤渣的主要成分为
 晶体加热脱水的产物,其与Mg反应制取粗硼的化学方程式为
晶体加热脱水的产物,其与Mg反应制取粗硼的化学方程式为(2)
 是一种一元弱酸,也可写作
是一种一元弱酸,也可写作 ,它与水作用时结合水电离的
,它与水作用时结合水电离的 而呈酸性,这一变化的离子方程式为
而呈酸性,这一变化的离子方程式为 ),它是有机合成中的重要还原剂,其电子式为
),它是有机合成中的重要还原剂,其电子式为(3)
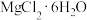 在
在 氛围中加热的化学方程式为
氛围中加热的化学方程式为(4)制得的粗硼在一定条件下可生成
 ,
, 加热分解可以得到纯净的单质硼。现将
加热分解可以得到纯净的单质硼。现将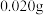 粗硼制成的
粗硼制成的 完全分解,生成的
完全分解,生成的 用
用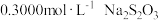 (
( 为弱酸)溶液滴定至终点,消耗
为弱酸)溶液滴定至终点,消耗 溶液
溶液 。该粗硼样品的纯度为
。该粗硼样品的纯度为 )。
)。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】环己烯(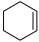 )是重要的化工原料,实验室环己醇(
)是重要的化工原料,实验室环己醇(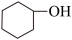 )可在
)可在 催化下制备环己烯。
催化下制备环己烯。
如图所示,将环己醇加入试管A中,再加入
 固体,缓慢加热,在试管C内收集到环己烯粗品。
固体,缓慢加热,在试管C内收集到环己烯粗品。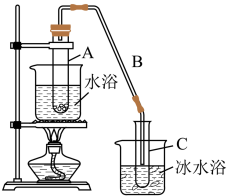
密度( | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
 ,而不选浓硫酸的可能原因是
,而不选浓硫酸的可能原因是(2)实验时水浴温度应高于
(3)环己烯粗品中含少量环己醇和HCl等物质。加入饱和食盐水除去HCl,经振荡、静置、分层后,产品在
Ⅱ.环己烯含量测定
向a g环己烯样品中加入b mol
 ,充分反应后,剩余的
,充分反应后,剩余的 与足量KI溶液反应,用c
与足量KI溶液反应,用c 标准溶液滴定,终点时消耗 V mL。(已知:
标准溶液滴定,终点时消耗 V mL。(已知: )
)(4)样品中环己烯的质量分数为
 标准溶液部分被氧化,会导致测定结果
标准溶液部分被氧化,会导致测定结果
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】黄铜矿(主要成分为CuFeS2,还含有少量的SiO2和Al2O3)是制取铜及其化合物的主要原料之一,还可用于制备绿矾(化学式为FeSO4·7H2O)。
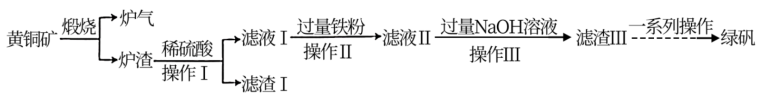
(1)黄铜矿“煅烧”时发生的反应为8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2,若CuFeS2中Fe的化合价为+2价,则该反应中被还原的元素是
8Cu+4FeO+2Fe2O3+16SO2,若CuFeS2中Fe的化合价为+2价,则该反应中被还原的元素是___________ (填元素符号)。
(2)“滤渣I”的主要成分为___________ ,“滤渣III”的主要成分为___________ 。(填化学式)
(3)“滤液II”中含有的金属阳离子有___________ (填离子符号)。
(4)上述“煅烧”过程会产生“炉气”(主要成分为SO2)。下列对“炉气”的处理方案中合理的是___________(填标号)。
(5)“操作I”的名称为___________ 。
(6)由“滤渣III”制备绿矾的过程中需要用到的试剂有铁粉和稀硫酸,则“一系列操作”为___________ 。

(1)黄铜矿“煅烧”时发生的反应为8CuFeS2+21O2
 8Cu+4FeO+2Fe2O3+16SO2,若CuFeS2中Fe的化合价为+2价,则该反应中被还原的元素是
8Cu+4FeO+2Fe2O3+16SO2,若CuFeS2中Fe的化合价为+2价,则该反应中被还原的元素是(2)“滤渣I”的主要成分为
(3)“滤液II”中含有的金属阳离子有
(4)上述“煅烧”过程会产生“炉气”(主要成分为SO2)。下列对“炉气”的处理方案中合理的是___________(填标号)。
| A.高空排放 | B.用于制备硫酸 |
| C.用纯碱溶液吸收制Na2SO3 | D.用浓硫酸吸收 |
(6)由“滤渣III”制备绿矾的过程中需要用到的试剂有铁粉和稀硫酸,则“一系列操作”为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
I.[查阅资料]
(1)Na2S2O3·5H2O是无色透明晶体,易溶于水。其稀溶液与BaCl2溶液混合无沉淀生成。
(2)向Na2CO3和Na2S混合液中通入SO2可制得Na2S2O3,所得产品中常含有少量Na2SO3和Na2SO4。
(3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl。
Ⅱ.[制备产品]
实验装置如图所示(省略夹持装置)
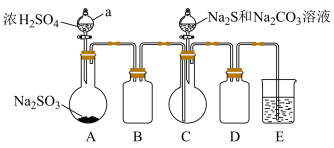
实验步骤:
(1)检查装置气密性,按图示加入试剂。仪器a的名称是____ ;E中的试剂是___ (选填下列字母编号)。
A.稀H2SO4B.NaOH溶液 C.饱和NaHSO3溶液
(2)先向C中烧瓶加入Na2S和Na2CO3混合溶液,再向A中烧瓶滴加浓H2SO4。
(3)待Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合液,滤液经____ (填写操作名称)、结晶、过滤、洗涤、干燥、得到产品。
Ⅲ.[探究与反思]
(1)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,_____ ,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(2)为减少装置C中生成的Na2SO4的量,在不改变原有装置的基础上对原有实验步骤(2)进行了改进,改进后的操作是_______ 。
(3)Na2S2O3·5H2O的溶解度随温度升高显著增大,所得产品通过_____ 方法提纯。
I.[查阅资料]
(1)Na2S2O3·5H2O是无色透明晶体,易溶于水。其稀溶液与BaCl2溶液混合无沉淀生成。
(2)向Na2CO3和Na2S混合液中通入SO2可制得Na2S2O3,所得产品中常含有少量Na2SO3和Na2SO4。
(3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl。
Ⅱ.[制备产品]
实验装置如图所示(省略夹持装置)

实验步骤:
(1)检查装置气密性,按图示加入试剂。仪器a的名称是
A.稀H2SO4B.NaOH溶液 C.饱和NaHSO3溶液
(2)先向C中烧瓶加入Na2S和Na2CO3混合溶液,再向A中烧瓶滴加浓H2SO4。
(3)待Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合液,滤液经
Ⅲ.[探究与反思]
(1)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,
(2)为减少装置C中生成的Na2SO4的量,在不改变原有装置的基础上对原有实验步骤(2)进行了改进,改进后的操作是
(3)Na2S2O3·5H2O的溶解度随温度升高显著增大,所得产品通过
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】生活中常用一定浓度的过氧乙酸(CH3COOOH)溶液作消毒液。某化学小组对过氧乙酸的制备和性质进行如图探究(夹持、加热及搅拌装置均未画出)。
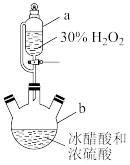
I.在磁力搅拌作用下,向仪器b中加入一定量的冰醋酸和浓硫酸,打开开关K,缓缓滴入适量30%的H2O2溶液,控制温度在20~30℃。
已知:过氧乙酸的氧化性强于高锰酸钾的。
(1)仪器b的名称为___ 。
(2)仪器a与分液漏斗相比,其优点是____ 。
(3)控制温度在20~30℃的目的是____ 。
Ⅱ.过氧乙酸样品中常含有残留的H2O2。样品中过氧乙酸的浓度为c0mol·L-1时,发生如下反应:
①CH3COOOH+2I-+2H+=CH3COOH+I2+H2O;
②H2O2+2I-+2H+=I2+2H2O;
③2S2O +I2=2I-+S4O
+I2=2I-+S4O 。
。
ⅰ.取V0mL待测液并用硫酸酸化,再用c1mol·L-1的KMnO4标准溶液滴定待测液至溶液呈粉红色,消耗V1mLKMnO4标准溶液。
ii.另取V2mL(V2≠V0)待测液,加入过量的KI溶液和几滴淀粉,并用硫酸酸化,再用c2mol·L-1的Na2S2O3标准溶液滴定,达到滴定终点时消耗V3mLNa2S2O3标准溶液。
(4)i中发生反应的离子方程式为___ 。ii中用Na2S2O3标准溶液进行滴定时,达到滴定终点的标志是___ ,过氧乙酸的浓度c0mol·L-1=___ mol·L-1(用含V0、c1、V1、c2、V2、V3的代数式表示)。

I.在磁力搅拌作用下,向仪器b中加入一定量的冰醋酸和浓硫酸,打开开关K,缓缓滴入适量30%的H2O2溶液,控制温度在20~30℃。
已知:过氧乙酸的氧化性强于高锰酸钾的。
(1)仪器b的名称为
(2)仪器a与分液漏斗相比,其优点是
(3)控制温度在20~30℃的目的是
Ⅱ.过氧乙酸样品中常含有残留的H2O2。样品中过氧乙酸的浓度为c0mol·L-1时,发生如下反应:
①CH3COOOH+2I-+2H+=CH3COOH+I2+H2O;
②H2O2+2I-+2H+=I2+2H2O;
③2S2O
 +I2=2I-+S4O
+I2=2I-+S4O 。
。ⅰ.取V0mL待测液并用硫酸酸化,再用c1mol·L-1的KMnO4标准溶液滴定待测液至溶液呈粉红色,消耗V1mLKMnO4标准溶液。
ii.另取V2mL(V2≠V0)待测液,加入过量的KI溶液和几滴淀粉,并用硫酸酸化,再用c2mol·L-1的Na2S2O3标准溶液滴定,达到滴定终点时消耗V3mLNa2S2O3标准溶液。
(4)i中发生反应的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】铝是现今人类生产生活中使用广泛性仅次于铁的重要金属。工业上常以“铝钒土矿”为原料来冶炼金属铝。已知:“铝钒土矿”的主要成分是Al2O3(其中含有Fe2O3、SiO2等杂质)。为了检测某“铝钒土矿”样中Al2O3的含量,进行了如下实验过程:
①取矿样10.0 g加入过量稀盐酸溶解(假定其他未知成分的杂质都不溶于盐酸,也不与盐酸反应),过滤弃去不溶残渣。
②将滤液稀释并在250 mL容量瓶中定容后,取25.0 mL逐滴滴加2.0 mol·L-1的NaOH溶液,得到如图所示的变化关系。

请根据有关数据回答下列问题:
(1)写出滴加NaOH溶液24~30 mL时发生反应的离子方程式:___________ 。
(2)最后所得不溶于NaOH溶液的沉淀的化学式为___________ ,其物质的量为___________ 。
(3)该“铝钒土矿”样中Al2O3的质量分数为___________ 。
(4)工业上制取金属铝的化学反应原理可表示为2Al2O3 4Al+3O2↑。用10.0 t “铝钒土矿”样提纯所得的Al2O3(提纯过程的损耗忽略不计)进行电解,理论上最多可制得金属铝
4Al+3O2↑。用10.0 t “铝钒土矿”样提纯所得的Al2O3(提纯过程的损耗忽略不计)进行电解,理论上最多可制得金属铝___________ t。
①取矿样10.0 g加入过量稀盐酸溶解(假定其他未知成分的杂质都不溶于盐酸,也不与盐酸反应),过滤弃去不溶残渣。
②将滤液稀释并在250 mL容量瓶中定容后,取25.0 mL逐滴滴加2.0 mol·L-1的NaOH溶液,得到如图所示的变化关系。

请根据有关数据回答下列问题:
(1)写出滴加NaOH溶液24~30 mL时发生反应的离子方程式:
(2)最后所得不溶于NaOH溶液的沉淀的化学式为
(3)该“铝钒土矿”样中Al2O3的质量分数为
(4)工业上制取金属铝的化学反应原理可表示为2Al2O3
 4Al+3O2↑。用10.0 t “铝钒土矿”样提纯所得的Al2O3(提纯过程的损耗忽略不计)进行电解,理论上最多可制得金属铝
4Al+3O2↑。用10.0 t “铝钒土矿”样提纯所得的Al2O3(提纯过程的损耗忽略不计)进行电解,理论上最多可制得金属铝
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】ZrO2是重要的耐高温材料,可用作陶瓷遮光剂和良好的催化剂。天然锆石的主要成分是ZrSiO4,另外还常含有Fe、Al、Cu的氧化物等杂质。工业上以天然锆石为原料制备ZrO2的工艺流程如图:
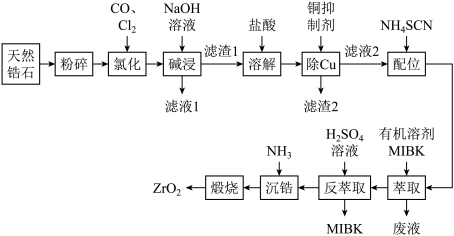
已知:(i)加热氯化过程中ZrSiO4生成ZrCl4、SiCl4等;ZrCl4易溶于水,400℃时升华;
(ii)常用的铜抑制剂为NaCN,它可与重金属离子生成沉淀,如Cu(CN)2。
(iii)“配合”生成的Fe(SCN)3难溶于MIBK(甲基异丁基酮,密度小于水),Zr(SCN)4在水中的溶解度小于在MIBK中的溶解度。
(1)“氯化”过程中,ZrSiO4发生反应的化学方程式为____ ,若“氯化”温度过高会导致ZrCl4产率降低,原因是____ 。
(2)溶解时,加入盐酸量不宜过多的原因为____ 。
(3)流程中“萃取”与“反萃取”可以分离铁、富集锆,简述“萃取”的原理:____ 。
(4)为提高反萃取率,本实验分三次反萃取。请简述反萃取的操作过程:取一定体积萃取后的MIBK溶液加入分液漏斗中____ 得到Zr(SO4)2溶液。
(可选择试剂:约100mL1mol/LH2SO4溶液、约100mL3mol/LH2SO4溶液)
(5)用EDTA可快速测定反萃取液中锆的含量,其操作步骤如下:
①用移液管吸取10.00mL酸浸液于250mL锥形瓶中,加入约100mL水;
②以6mol•L-1的盐酸调节溶液pH在0~0.3,加入0.2g盐酸羟胺,加热煮沸;
③加入2滴二甲酚橙指示剂,趁热用0.02000mol•L-1EDTA标准溶液进行滴定,EDTA与ZrO2+按1︰1的比例进行螯合消耗EDTA14.30mL;
④至溶液由紫红色突变为亮黄色且30s保持不变色,即为终点。
根据相关数据,计算酸浸液中锆的含量(以ZrO2计)为____ mg•mL-1(保留两位小数)。

已知:(i)加热氯化过程中ZrSiO4生成ZrCl4、SiCl4等;ZrCl4易溶于水,400℃时升华;
(ii)常用的铜抑制剂为NaCN,它可与重金属离子生成沉淀,如Cu(CN)2。
(iii)“配合”生成的Fe(SCN)3难溶于MIBK(甲基异丁基酮,密度小于水),Zr(SCN)4在水中的溶解度小于在MIBK中的溶解度。
(1)“氯化”过程中,ZrSiO4发生反应的化学方程式为
(2)溶解时,加入盐酸量不宜过多的原因为
(3)流程中“萃取”与“反萃取”可以分离铁、富集锆,简述“萃取”的原理:
(4)为提高反萃取率,本实验分三次反萃取。请简述反萃取的操作过程:取一定体积萃取后的MIBK溶液加入分液漏斗中
(可选择试剂:约100mL1mol/LH2SO4溶液、约100mL3mol/LH2SO4溶液)
(5)用EDTA可快速测定反萃取液中锆的含量,其操作步骤如下:
①用移液管吸取10.00mL酸浸液于250mL锥形瓶中,加入约100mL水;
②以6mol•L-1的盐酸调节溶液pH在0~0.3,加入0.2g盐酸羟胺,加热煮沸;
③加入2滴二甲酚橙指示剂,趁热用0.02000mol•L-1EDTA标准溶液进行滴定,EDTA与ZrO2+按1︰1的比例进行螯合消耗EDTA14.30mL;
④至溶液由紫红色突变为亮黄色且30s保持不变色,即为终点。
根据相关数据,计算酸浸液中锆的含量(以ZrO2计)为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】“速力菲”(主要成分:琥珀酸亚铁)是一种常见的补铁药物。某兴趣小组为了测定“速力菲”药片中铁元素的含量,设计如下实验(假设反应过程无铁元素损耗):

请回答下列问题:
(1)研细的目的是___________ 。
(2)加入盐酸后溶液为淡黄色,说明“速力菲”中的Fe2+已部分被氧化。通常在服用“速力菲”同时服用维生素C,说明维生素C具有___________ (填“氧化性”或“还原性”)。
(3)设计实验证明淡黄色溶液中是否含有Fe2+___________ 。
(4)淡黄色溶液中加入氯水,发生反应的离子方程式为___________ 。
(5)Fe(OH)2沉淀也易被O2氧化,写出该反应的化学方程式___________ 。
(6)“速力菲”药片中铁元素的含量为___________ (用含有a、b的式子表示)。

请回答下列问题:
(1)研细的目的是
(2)加入盐酸后溶液为淡黄色,说明“速力菲”中的Fe2+已部分被氧化。通常在服用“速力菲”同时服用维生素C,说明维生素C具有
(3)设计实验证明淡黄色溶液中是否含有Fe2+
(4)淡黄色溶液中加入氯水,发生反应的离子方程式为
(5)Fe(OH)2沉淀也易被O2氧化,写出该反应的化学方程式
(6)“速力菲”药片中铁元素的含量为
您最近一年使用:0次

 )
)

