ZrO2是重要的耐高温材料,可用作陶瓷遮光剂和良好的催化剂。天然锆石的主要成分是ZrSiO4,另外还常含有Fe、Al、Cu的氧化物等杂质。工业上以天然锆石为原料制备ZrO2的工艺流程如图:
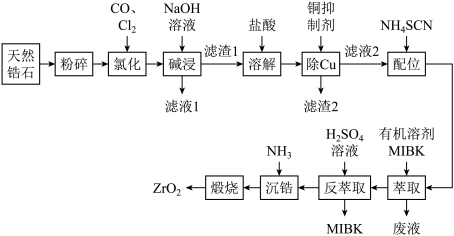
已知:(i)加热氯化过程中ZrSiO4生成ZrCl4、SiCl4等;ZrCl4易溶于水,400℃时升华;
(ii)常用的铜抑制剂为NaCN,它可与重金属离子生成沉淀,如Cu(CN)2。
(iii)“配合”生成的Fe(SCN)3难溶于MIBK(甲基异丁基酮,密度小于水),Zr(SCN)4在水中的溶解度小于在MIBK中的溶解度。
(1)“氯化”过程中,ZrSiO4发生反应的化学方程式为____ ,若“氯化”温度过高会导致ZrCl4产率降低,原因是____ 。
(2)溶解时,加入盐酸量不宜过多的原因为____ 。
(3)流程中“萃取”与“反萃取”可以分离铁、富集锆,简述“萃取”的原理:____ 。
(4)为提高反萃取率,本实验分三次反萃取。请简述反萃取的操作过程:取一定体积萃取后的MIBK溶液加入分液漏斗中____ 得到Zr(SO4)2溶液。
(可选择试剂:约100mL1mol/LH2SO4溶液、约100mL3mol/LH2SO4溶液)
(5)用EDTA可快速测定反萃取液中锆的含量,其操作步骤如下:
①用移液管吸取10.00mL酸浸液于250mL锥形瓶中,加入约100mL水;
②以6mol•L-1的盐酸调节溶液pH在0~0.3,加入0.2g盐酸羟胺,加热煮沸;
③加入2滴二甲酚橙指示剂,趁热用0.02000mol•L-1EDTA标准溶液进行滴定,EDTA与ZrO2+按1︰1的比例进行螯合消耗EDTA14.30mL;
④至溶液由紫红色突变为亮黄色且30s保持不变色,即为终点。
根据相关数据,计算酸浸液中锆的含量(以ZrO2计)为____ mg•mL-1(保留两位小数)。

已知:(i)加热氯化过程中ZrSiO4生成ZrCl4、SiCl4等;ZrCl4易溶于水,400℃时升华;
(ii)常用的铜抑制剂为NaCN,它可与重金属离子生成沉淀,如Cu(CN)2。
(iii)“配合”生成的Fe(SCN)3难溶于MIBK(甲基异丁基酮,密度小于水),Zr(SCN)4在水中的溶解度小于在MIBK中的溶解度。
(1)“氯化”过程中,ZrSiO4发生反应的化学方程式为
(2)溶解时,加入盐酸量不宜过多的原因为
(3)流程中“萃取”与“反萃取”可以分离铁、富集锆,简述“萃取”的原理:
(4)为提高反萃取率,本实验分三次反萃取。请简述反萃取的操作过程:取一定体积萃取后的MIBK溶液加入分液漏斗中
(可选择试剂:约100mL1mol/LH2SO4溶液、约100mL3mol/LH2SO4溶液)
(5)用EDTA可快速测定反萃取液中锆的含量,其操作步骤如下:
①用移液管吸取10.00mL酸浸液于250mL锥形瓶中,加入约100mL水;
②以6mol•L-1的盐酸调节溶液pH在0~0.3,加入0.2g盐酸羟胺,加热煮沸;
③加入2滴二甲酚橙指示剂,趁热用0.02000mol•L-1EDTA标准溶液进行滴定,EDTA与ZrO2+按1︰1的比例进行螯合消耗EDTA14.30mL;
④至溶液由紫红色突变为亮黄色且30s保持不变色,即为终点。
根据相关数据,计算酸浸液中锆的含量(以ZrO2计)为
更新时间:2022-10-18 16:35:25
|
相似题推荐
【推荐1】Co3O4在磁性材料、电化学领域应用广泛,实验室中可以用CoCO3或CoC2O4煅烧后制得。利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的流程如图所示:
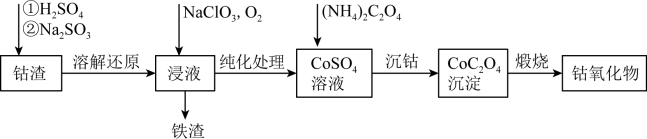
已知:Ksp[Co(OH)2]=1.6×10-15,Ksp(CoC2O4)=6.3×10-8,CoCO3煅烧300°C~600°C生成Co3O4,1100°C以上生成Co2O3。
(1)“溶解还原”过程中Co(OH)3发生反应的离子方程式为___________ 。
(2)“沉钴”时,不能用Na2C2O4溶液代替(NH4)C2O4溶液,原因是_______ 。
(3)为测定草酸钻样品中草酸钴晶体(CoC2O4·2H2O)的质量分数进行如下实验:
①取草酸钴(CoC2O4·2H2O)样品3.050g,加入100.00mL0.1000mol/L酸性KMnO4溶液,加热(该条件下Co2+不被氧化)。
②充分反应后将溶液冷却至室温,加入250mL容量瓶中,定容。
③取25.00mL溶液,用0.1000mol/LFeSO4溶液滴定,消耗FeSO4溶液18.00mL。
计算样品中草酸钴晶体(CoC2O4·2H2O)的质量分数:___________ (写出计算过程)。

已知:Ksp[Co(OH)2]=1.6×10-15,Ksp(CoC2O4)=6.3×10-8,CoCO3煅烧300°C~600°C生成Co3O4,1100°C以上生成Co2O3。
(1)“溶解还原”过程中Co(OH)3发生反应的离子方程式为
(2)“沉钴”时,不能用Na2C2O4溶液代替(NH4)C2O4溶液,原因是
(3)为测定草酸钻样品中草酸钴晶体(CoC2O4·2H2O)的质量分数进行如下实验:
①取草酸钴(CoC2O4·2H2O)样品3.050g,加入100.00mL0.1000mol/L酸性KMnO4溶液,加热(该条件下Co2+不被氧化)。
②充分反应后将溶液冷却至室温,加入250mL容量瓶中,定容。
③取25.00mL溶液,用0.1000mol/LFeSO4溶液滴定,消耗FeSO4溶液18.00mL。
计算样品中草酸钴晶体(CoC2O4·2H2O)的质量分数:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】(1)固体正盐A, 可以发生如右图所示反应,其中E、I为中学常见的两强酸,则:
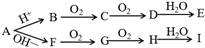
①A为_____________ ;
②F G的化学方程式为
G的化学方程式为______________________ ;
③Fe与少量I的稀溶液反应的离子方程式______________________________________ 。
④若CO2气体中混有少量C,欲除去C时,最好选用_______ 试剂;
(2)铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等。回答下列问题:
① 铅是碳的同族元素,比碳多4个电子层。铅在元素周期表的位置为第_____ 周期,第____ 族;
② PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为________________ ;
③ PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为______________ ;
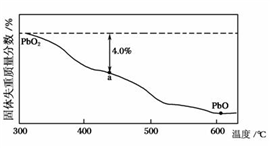
④ PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重4.0% (即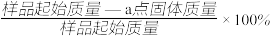 )的残留固体。若a点固体组成表示为PbOx或mPbO2·nPbO,计算x的值和m :n的值x=
)的残留固体。若a点固体组成表示为PbOx或mPbO2·nPbO,计算x的值和m :n的值x=_______ ;m :n=________ 。

①A为
②F
 G的化学方程式为
G的化学方程式为③Fe与少量I的稀溶液反应的离子方程式
④若CO2气体中混有少量C,欲除去C时,最好选用
(2)铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等。回答下列问题:
① 铅是碳的同族元素,比碳多4个电子层。铅在元素周期表的位置为第
② PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为
③ PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为
④ PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重4.0% (即
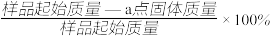 )的残留固体。若a点固体组成表示为PbOx或mPbO2·nPbO,计算x的值和m :n的值x=
)的残留固体。若a点固体组成表示为PbOx或mPbO2·nPbO,计算x的值和m :n的值x=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】物质的大小会对其性质有极大影响。
(1)纳米金:具有高电子密度、介电特性和催化作用。纳米金的制法:将0.01%的 溶液煮沸,迅速加入1%的柠檬酸钠(
溶液煮沸,迅速加入1%的柠檬酸钠( )溶液,持续煮沸7~10分钟。制备时溶液会因为加入的柠檬酸钠的量不同而产生不同的颜色,如下表所示。
)溶液,持续煮沸7~10分钟。制备时溶液会因为加入的柠檬酸钠的量不同而产生不同的颜色,如下表所示。
资料: 的溶液呈黄色,其酸性比柠檬酸强。
的溶液呈黄色,其酸性比柠檬酸强。
①在制备过程中,存在如下反应,已知产物 是柠檬酸脱去一个羧基得到的,核磁共振氢谱显示其有4组峰。请补全并配平下面的反应方程式(要写出
是柠檬酸脱去一个羧基得到的,核磁共振氢谱显示其有4组峰。请补全并配平下面的反应方程式(要写出 的结构简式)
的结构简式) _______ 。
 □
□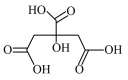 →□_______+□_______(
→□_______+□_______( )+□
)+□ +□HCl
+□HCl
②柠檬酸钠的作用是_______ ,如果一段时间后的液体仍为黄色,则可以_______ (填操作)来检验是否生成纳米金。
(2)微米水:可以高效诱导分子的还原反应,且不需要任何的外加还原剂或外加电荷。科学家使用上述方法制取纳米金时,引入了不加柠檬酸的对照组。令人惊奇的是对照组也发生了反应,他经过猜想与论证,最终将目光锁定在水身上,用如下装置(如图1所示)进行验证。

①使用丙酮酸( )来验证,通过检验由丙酮酸生成的产物
)来验证,通过检验由丙酮酸生成的产物_______ ,证明猜想成立。
②发现随着丙酮酸浓度的增加,还原效率会迅速降低,图2与图3中丙酮酸浓度均为10mol/L。

还原效率会随着雾化气体压强的增大而增大的原因是_______ 。
③为探究还原反应的具体过程,继续设计实验:向水中加入一种指示剂R,这种指示剂正常状态下不显色,R在遇到一定浓度的 与还原剂后会显示红色荧光,过程可以表示为:R(无色)
与还原剂后会显示红色荧光,过程可以表示为:R(无色) (红色荧光)。加入R后观测到的现象如图4所示。
(红色荧光)。加入R后观测到的现象如图4所示。

结合图4和上述实验,你可以得出什么推论?_______ 。
(3)综合上述内容,你对物质有了哪些更深入的认识?_______ 。
(1)纳米金:具有高电子密度、介电特性和催化作用。纳米金的制法:将0.01%的
 溶液煮沸,迅速加入1%的柠檬酸钠(
溶液煮沸,迅速加入1%的柠檬酸钠( )溶液,持续煮沸7~10分钟。制备时溶液会因为加入的柠檬酸钠的量不同而产生不同的颜色,如下表所示。
)溶液,持续煮沸7~10分钟。制备时溶液会因为加入的柠檬酸钠的量不同而产生不同的颜色,如下表所示。| 纳米金颗粒大小(nm) | 颜色 |
| 2~5 | 黄 |
| 10~20 | 红 |
| 30~80 | 紫 |
 的溶液呈黄色,其酸性比柠檬酸强。
的溶液呈黄色,其酸性比柠檬酸强。①在制备过程中,存在如下反应,已知产物
 是柠檬酸脱去一个羧基得到的,核磁共振氢谱显示其有4组峰。请补全并配平下面的反应方程式(要写出
是柠檬酸脱去一个羧基得到的,核磁共振氢谱显示其有4组峰。请补全并配平下面的反应方程式(要写出 的结构简式)
的结构简式) 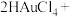 □
□ →□_______+□_______(
→□_______+□_______( )+□
)+□ +□HCl
+□HCl②柠檬酸钠的作用是
(2)微米水:可以高效诱导分子的还原反应,且不需要任何的外加还原剂或外加电荷。科学家使用上述方法制取纳米金时,引入了不加柠檬酸的对照组。令人惊奇的是对照组也发生了反应,他经过猜想与论证,最终将目光锁定在水身上,用如下装置(如图1所示)进行验证。

①使用丙酮酸(
 )来验证,通过检验由丙酮酸生成的产物
)来验证,通过检验由丙酮酸生成的产物②发现随着丙酮酸浓度的增加,还原效率会迅速降低,图2与图3中丙酮酸浓度均为10mol/L。

还原效率会随着雾化气体压强的增大而增大的原因是
③为探究还原反应的具体过程,继续设计实验:向水中加入一种指示剂R,这种指示剂正常状态下不显色,R在遇到一定浓度的
 与还原剂后会显示红色荧光,过程可以表示为:R(无色)
与还原剂后会显示红色荧光,过程可以表示为:R(无色) (红色荧光)。加入R后观测到的现象如图4所示。
(红色荧光)。加入R后观测到的现象如图4所示。
结合图4和上述实验,你可以得出什么推论?
(3)综合上述内容,你对物质有了哪些更深入的认识?
您最近一年使用:0次
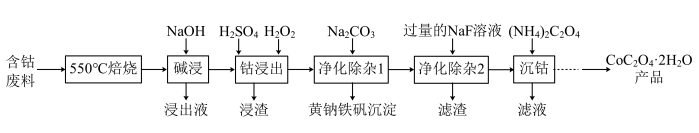
【推荐1】用含钴废料(主要成分为Co2O3,含少量Fe2O3、A12O3、CaO、MgO、碳及有机物等)制备草酸钴晶体(CoC2O4·2H2O)的工艺流程如图所示:
已知:ⅰ.金属钴与铁具有相似的化学性质
ⅱ.黄钠铁矾的化学式为Na2Fe6(SO4)4(OH)12
ⅲ.Ksp(MgF2)=6.25×10-9,Ksp(CaF2)=2.25×10-11
回答下列问题:
(1)550℃焙烧的目的是___________ 。
(2)“钴浸出”过程中,主要反应的离子方程式是___________ 。
(3)“净化除杂1”为生成黄钠铁矾沉淀,需加入Na2CO3溶液调节pH为2.5~3.0,控制pH在此范围的原因是___________ 。
(4)常温下,在“净化除杂2”中加入NaF溶液可除去Ca2+、Mg2+,当两者沉淀完全时,F-的浓度至少为___________ mol∙L-1(离子浓度小于1.0×10-5mol∙L-1即为该离子沉淀完全)。
(5)草酸钴晶体在空气中受热可得到Co3O4,该反应的化学方程式为___________ 。
(6)一种掺钴催化剂的晶胞如图所示,则该晶体沿z轴的投影图为___________ (填序号),设阿伏加德罗常数的值为NA,晶胞的密度为ρ ,则晶胞参数为
,则晶胞参数为___________ nm(用含ρ、NA的代数式表示)。


已知:ⅰ.金属钴与铁具有相似的化学性质
ⅱ.黄钠铁矾的化学式为Na2Fe6(SO4)4(OH)12
ⅲ.Ksp(MgF2)=6.25×10-9,Ksp(CaF2)=2.25×10-11
回答下列问题:
(1)550℃焙烧的目的是
(2)“钴浸出”过程中,主要反应的离子方程式是
(3)“净化除杂1”为生成黄钠铁矾沉淀,需加入Na2CO3溶液调节pH为2.5~3.0,控制pH在此范围的原因是
(4)常温下,在“净化除杂2”中加入NaF溶液可除去Ca2+、Mg2+,当两者沉淀完全时,F-的浓度至少为
(5)草酸钴晶体在空气中受热可得到Co3O4,该反应的化学方程式为
(6)一种掺钴催化剂的晶胞如图所示,则该晶体沿z轴的投影图为
 ,则晶胞参数为
,则晶胞参数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】地球上的氮元素对动植物有重要作用,其中氨的合成与应用是当前的研究热点。
(1)人工固氮最主要的方法是Haber-Bosch法。通常用以铁为主的催化剂在400~500℃和10~30MPa的条件下,由氮气和氢气直接合成氨。写出反应的化学方程式___ 。
(2)如图所示为实验装置模拟工业生产制备少量硝酸。

①实验室制取氨气的化学方程式是___ ;检验氨气的方法为___ 。
②实验时先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到700℃以上,由此可知该反应是___ 反应(填“吸热”或“放热”),反应的化学方程式是____ 。
③B中试剂为____ ,NaOH溶液的作用是___ 。
④控制氨气和氧气的比例是制备硝酸的关键。当比例不合适时,A中不仅有红棕色气体产生,还伴有白烟。红棕色气体的化学式是__ ,白烟的化学式是___ 。欲使氨气尽可能完全转化为硝酸,理论上n(NH3):n(O2)的最佳比例为___ 。
(3)某氨氮废水资源化利用和处理的流程如图所示(部分物质已略去)。
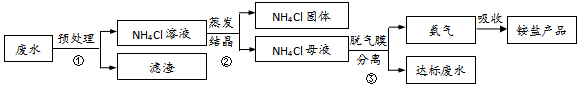
①预处理过程中需要去除硫酸根,可选用的试剂是___ 。
②蒸发结晶过程中不宜温度过高,其原因是___ (用化学方程式表示)。
③在脱气膜分离过程中,调控膜内pH可以分离出NH3,NH3再与吸收液反应得到铵盐产品。请写出调节pH分离得到NH3的离子方程式____ 。
④上述流程中,包含过滤的分离操作是___ (填序号)。
(1)人工固氮最主要的方法是Haber-Bosch法。通常用以铁为主的催化剂在400~500℃和10~30MPa的条件下,由氮气和氢气直接合成氨。写出反应的化学方程式
(2)如图所示为实验装置模拟工业生产制备少量硝酸。

①实验室制取氨气的化学方程式是
②实验时先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到700℃以上,由此可知该反应是
③B中试剂为
④控制氨气和氧气的比例是制备硝酸的关键。当比例不合适时,A中不仅有红棕色气体产生,还伴有白烟。红棕色气体的化学式是
(3)某氨氮废水资源化利用和处理的流程如图所示(部分物质已略去)。

①预处理过程中需要去除硫酸根,可选用的试剂是
②蒸发结晶过程中不宜温度过高,其原因是
③在脱气膜分离过程中,调控膜内pH可以分离出NH3,NH3再与吸收液反应得到铵盐产品。请写出调节pH分离得到NH3的离子方程式
④上述流程中,包含过滤的分离操作是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】海洋植物如海带、海藻中含有丰富的碘元素,主要以碘化物形式存在。有一化学课外小组用海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(以让碘化物充分溶解在水中),得到海带灰悬浊液,然后按以下实验流程提取单质碘:
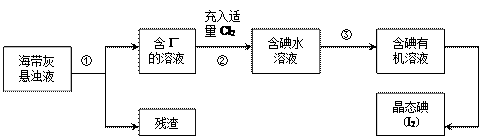
(1)灼烧海带时需要用到的实验仪器是__________________ (从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.铁架台(带铁圈) E.酒精灯 F.干燥器
(2)指出提取碘的过程中有关的实验操作名称:①___________ ,③___________ 。
(3)过程②中充入适量Cl2的目的是______________________ ,反应的离子方程式为_________________________________ 。
(4)操作③中所用的有机试剂可以是___________ (只填一种),简述选择其理由_________________________________ 。
(5)操作过程③可以分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50 mL碘水和15 mL有机溶剂(你所选的)加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层液体;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
H.静置、分层。
a.上述G步操作的目的是:_________________________________ ;
b.最后碘的有机溶液是通过___________ 获得(填“漏斗上口”或“漏斗下口”)。
(6)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:___________________ 。
(7)从含碘的有机溶液中提取碘和回收有机溶液,还需要经过蒸馏,观察下图所示实验装置,指出其错误之处并加以改正________________________________________________ 。 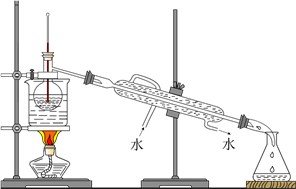
(8)进行上述蒸馏操作时,使用水浴的原因是________________ ,最后晶态碘在__________ 里聚集。

(1)灼烧海带时需要用到的实验仪器是
A.烧杯 B.坩埚 C.表面皿 D.铁架台(带铁圈) E.酒精灯 F.干燥器
(2)指出提取碘的过程中有关的实验操作名称:①
(3)过程②中充入适量Cl2的目的是
(4)操作③中所用的有机试剂可以是
(5)操作过程③可以分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50 mL碘水和15 mL有机溶剂(你所选的)加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层液体;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
H.静置、分层。
a.上述G步操作的目的是:
b.最后碘的有机溶液是通过
(6)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:
(7)从含碘的有机溶液中提取碘和回收有机溶液,还需要经过蒸馏,观察下图所示实验装置,指出其错误之处并加以改正

(8)进行上述蒸馏操作时,使用水浴的原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】在化学活动周中,某校兴趣小组的同学在老师指导下探究铁元素相关物质的性质。回答下列问题:
(1)实验室现有一瓶 饱和溶液,甲同学向
饱和溶液,甲同学向 沸水中逐滴加入
沸水中逐滴加入 饱和溶液,煮沸至液体呈红褐色,停止加热,写出此过程中的离子方程式
饱和溶液,煮沸至液体呈红褐色,停止加热,写出此过程中的离子方程式_______ 。为了证明制得的红褐色液体属于胶体,可以使用的方法是_______ ;乙同学将少量钠单质投入氯化铁溶液中制得铁单质,请评价这一实验方案的可行性_______ (若可行,请写出发生反应的离子方程式,若不可行,请说明理由)。
(2)丙同学意图用干燥、纯净的一氧化碳还原氧化铁。实验装置如图,其中装置 是实验室用草酸
是实验室用草酸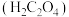 和浓硫酸加热制取一氧化碳的气体发生装置,反应的化学方程式是:
和浓硫酸加热制取一氧化碳的气体发生装置,反应的化学方程式是:
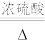
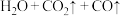 。
。
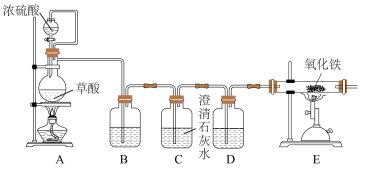
①装置B中盛放的药品为_______ ,装置D的作用为_______ 。
②在实验开始前,应先打开装置_______ (选填“A”或“E”)中的加热装置。写出装置 中发生反应的化学方程式并用双线桥法标出电子转移
中发生反应的化学方程式并用双线桥法标出电子转移_______ ,其中氧化产物与还原产物的质量比为_______ 。
③该装置的主要缺陷是_______ 。
(1)实验室现有一瓶
 饱和溶液,甲同学向
饱和溶液,甲同学向 沸水中逐滴加入
沸水中逐滴加入 饱和溶液,煮沸至液体呈红褐色,停止加热,写出此过程中的离子方程式
饱和溶液,煮沸至液体呈红褐色,停止加热,写出此过程中的离子方程式(2)丙同学意图用干燥、纯净的一氧化碳还原氧化铁。实验装置如图,其中装置
 是实验室用草酸
是实验室用草酸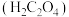 和浓硫酸加热制取一氧化碳的气体发生装置,反应的化学方程式是:
和浓硫酸加热制取一氧化碳的气体发生装置,反应的化学方程式是:
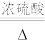
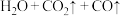 。
。
①装置B中盛放的药品为
②在实验开始前,应先打开装置
 中发生反应的化学方程式并用双线桥法标出电子转移
中发生反应的化学方程式并用双线桥法标出电子转移③该装置的主要缺陷是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】酸性蚀刻液的主要成分是H2O2/HCl,腐蚀铜后的废液中主要含有CuCl2、HCl。一种以废铝屑为主要原料回收酸性蚀刻废液中的铜并生产AlCl3的工艺流程如下:
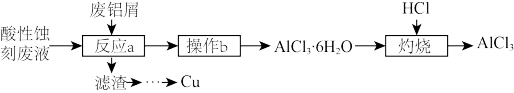
回答下列问题:
(1)在实验室,“反应a”过程需远离火源,其原因是_______ (用文字叙述)。
(2)“操作b”包括_______ 、过滤、洗涤,其中过滤需要用到的玻璃仪器有_______ 、烧杯。
(3)实验室可用食盐与浓硫酸在微热条件下反应制取HCl气体。
①HCl气体的发生装置应选择装置_______ (填字母,下同),用水吸收多余的HCl气体时,应该选择装置_______ ,其原因是_______ 。
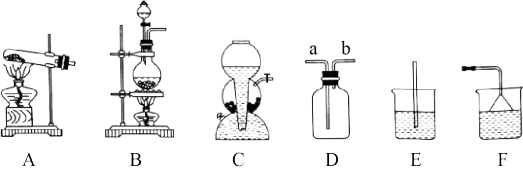
②写出制备HCl反应的化学方程式:_______ ,该反应利用了浓H2SO4的性质是_______ (填“脱水性”“氧化性”或“难挥发性”)
(4)“灼烧”时,若在无HCl的气氛中反应,最终是否生成 给出判断并说明理由:
给出判断并说明理由:_______ 。
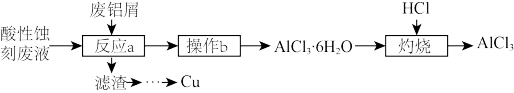
回答下列问题:
(1)在实验室,“反应a”过程需远离火源,其原因是
(2)“操作b”包括
(3)实验室可用食盐与浓硫酸在微热条件下反应制取HCl气体。
①HCl气体的发生装置应选择装置

②写出制备HCl反应的化学方程式:
(4)“灼烧”时,若在无HCl的气氛中反应,最终是否生成
 给出判断并说明理由:
给出判断并说明理由:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如图:
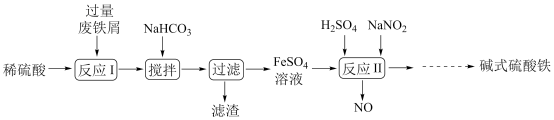
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如表:
请回答下列问题:
(1)写出反应I中发生氧化还原反应的离子方程式___________ 。
(2)“滤渣”的主要成分是___________ (填化学式),加入适量NaHCO3的目的是调节pH在___________ 范围内。
(3)反应II中加入NaNO2的离子方程式为___________ ,在实际生产中,可以同时通入O2以减少NaNO2的用量,若参与反应的O2有5.6L(标况),则理论上相当于节约NaNO2(Mr=69)用量___________ g。
(4)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:取25.00mL溶液,稀释到250mL,准确量取20.00mL于带塞锥形瓶中,加入足量H2O2,调节pH<2,加热除去过量H2O2;加入过量KI充分反应后,加入淀粉溶液做指示剂再用0.01000mol/LNa2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。已知: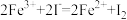 ,
,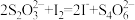 。滴定终点的现象为
。滴定终点的现象为___________ 。则溶液中铁元素的总含量为___________ g/L。若滴定前,读数时尖嘴处有气泡,滴定后气泡消失则最后滴定结果将___________ 。(填“偏高”、“偏低”或“无影响”)

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.0 | 5.9 | 3.7 |
| 完全沉淀 | 3.5 | 8.4 | 4.7 |
(1)写出反应I中发生氧化还原反应的离子方程式
(2)“滤渣”的主要成分是
(3)反应II中加入NaNO2的离子方程式为
(4)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:取25.00mL溶液,稀释到250mL,准确量取20.00mL于带塞锥形瓶中,加入足量H2O2,调节pH<2,加热除去过量H2O2;加入过量KI充分反应后,加入淀粉溶液做指示剂再用0.01000mol/LNa2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。已知:
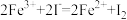 ,
,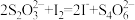 。滴定终点的现象为
。滴定终点的现象为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】某学习兴趣小组为测定某葡萄酒中SO2的含量,设计了如图所示的装置:
(1)C中通入SO2发生反应的化学方程式为___ 。
(2)通过计算求出该葡萄酒中SO2的含量(以g·L-1为单位,即每升葡萄酒中含有SO2的质量)___ 。(写出计算过程)
(3)该测定结果比实际值偏高,可能的原因是____ 。针对此原因提出一条改进措施:___ 。
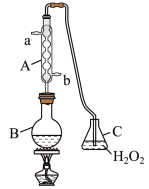
(1)C中通入SO2发生反应的化学方程式为
(2)通过计算求出该葡萄酒中SO2的含量(以g·L-1为单位,即每升葡萄酒中含有SO2的质量)
(3)该测定结果比实际值偏高,可能的原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】为测定某氟化稀土样品中氟元素的质量分数,某化学兴趣小组进行了如下实验。利用高氯酸(高沸点酸)将样品中的氟元素转化为氟化氢(低沸点酸)蒸出,再滴定测量。实验装置如图所示。
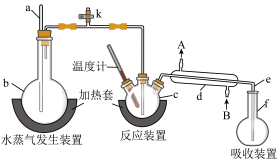
(1)a 的作用是_____ ,仪器 d 中冷凝水的方向为_____ 进_____ 出。(填 A 或 B)
(2)检查装置气密性:_____ (填操作),关闭 k,微热 c,导管 e 末端有气泡冒出;停止加热,导管e 内有一段稳定的水柱,说明装置气密性良好。
(3)c 中加入一定体积高氯酸和 m g 氟化稀土样品,f中盛有滴加酚酞的NaOH 溶液。加热 b、c,使b 中产生的水蒸气进入 c。
①下列物质可代替高氯酸的是_____ (填序号)。
A.硝酸 B.盐酸 C.硫酸 D.磷酸
②实验中除有HF 气体外,可能还有少量 SiF4(易水解)气体生成。若有 SiF4生成,实验结果将_____ (填“偏高”“偏低”或“不受影响”)。
③若观察到 f 中溶液红色褪去,需_____ (填操作),否则会使 实验结果偏低。
(4)向馏出液中加入 V1 mL c1mol·L-1La(NO3)3溶液,得到 LaF3沉淀(不考虑其他沉淀的生成),再用 c2mol·L-1 EDTA 标准溶液滴定剩余 La3+(La3+与 EDTA 按 1∶1 配合),消耗 EDTA 标准溶液 V2 mL,则氟化稀土样品中氟的质量分数为_____ 。

(1)a 的作用是
(2)检查装置气密性:
(3)c 中加入一定体积高氯酸和 m g 氟化稀土样品,f中盛有滴加酚酞的NaOH 溶液。加热 b、c,使b 中产生的水蒸气进入 c。
①下列物质可代替高氯酸的是
A.硝酸 B.盐酸 C.硫酸 D.磷酸
②实验中除有HF 气体外,可能还有少量 SiF4(易水解)气体生成。若有 SiF4生成,实验结果将
③若观察到 f 中溶液红色褪去,需
(4)向馏出液中加入 V1 mL c1mol·L-1La(NO3)3溶液,得到 LaF3沉淀(不考虑其他沉淀的生成),再用 c2mol·L-1 EDTA 标准溶液滴定剩余 La3+(La3+与 EDTA 按 1∶1 配合),消耗 EDTA 标准溶液 V2 mL,则氟化稀土样品中氟的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】实验室制备环己烯的流程如下:
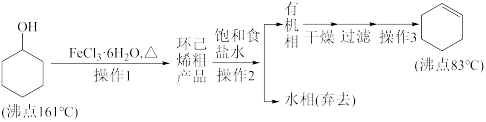
回答下列问题:
(1)除去原料环己醇中的苯酚,可先加入_______ 溶液,再进行后续操作。
(2)操作1的装置如图所示(加热和夹持装置已略去)。
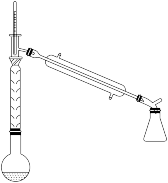
①收集环己烯粗产品时温度计的温度为_______ ℃左右;
②烧瓶中主反应的化学方程式为_______ 。
(3)①操作2的名称是_______ 。
②饱和食盐水的主要作用是降低环己烯的溶解度和_______ 。
(4)为测定环己烯的纯度,向10.00g环己烯样品中加入 ,充分反应后,剩余的
,充分反应后,剩余的 与足量KI作用生成
与足量KI作用生成 ,用
,用 的
的 标准溶液滴定,重复以上操作三次,平均消耗
标准溶液滴定,重复以上操作三次,平均消耗 标准溶液20.00mL。已知:
标准溶液20.00mL。已知: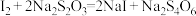 。
。
①写出环己烯与 的化学反应方程式
的化学反应方程式_______ 。
②样品中环己烯的质量分数为_______ 。
③下列情况会导致测定结果偏高的是_______ (填字母)。
a.样品中含有苯酚杂质
b. 标准溶液部分被氧化
标准溶液部分被氧化
c.在测定过程中部分环己烯挥发

回答下列问题:
(1)除去原料环己醇中的苯酚,可先加入
(2)操作1的装置如图所示(加热和夹持装置已略去)。

①收集环己烯粗产品时温度计的温度为
②烧瓶中主反应的化学方程式为
(3)①操作2的名称是
②饱和食盐水的主要作用是降低环己烯的溶解度和
(4)为测定环己烯的纯度,向10.00g环己烯样品中加入
 ,充分反应后,剩余的
,充分反应后,剩余的 与足量KI作用生成
与足量KI作用生成 ,用
,用 的
的 标准溶液滴定,重复以上操作三次,平均消耗
标准溶液滴定,重复以上操作三次,平均消耗 标准溶液20.00mL。已知:
标准溶液20.00mL。已知: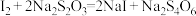 。
。①写出环己烯与
 的化学反应方程式
的化学反应方程式②样品中环己烯的质量分数为
③下列情况会导致测定结果偏高的是
a.样品中含有苯酚杂质
b.
 标准溶液部分被氧化
标准溶液部分被氧化c.在测定过程中部分环己烯挥发
您最近一年使用:0次



