一种用铝土矿和硫铁矿烧渣(配料中含Al2O3、Fe2O3、FeO及SiO2等)为原料制备无机高分子絮凝剂聚合碱式氯化铝铁的流程如下:
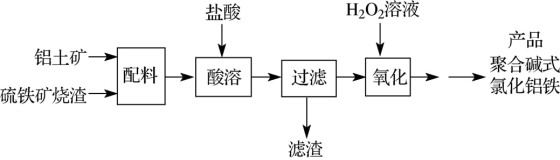
(1)“酸溶”时Fe2O3被溶解的化学方程式为_________ 。
(2)过滤操作所需的玻璃仪器除了烧杯、玻璃棒,还有_________ 。
(3)滤渣的成分为_________ (填化学式)。
(4)“氧化”反应的离子方程式为_________ 。

(1)“酸溶”时Fe2O3被溶解的化学方程式为
(2)过滤操作所需的玻璃仪器除了烧杯、玻璃棒,还有
(3)滤渣的成分为
(4)“氧化”反应的离子方程式为
更新时间:2022-12-05 16:01:42
|
相似题推荐
解答题-无机推断题
|
容易
(0.94)
解题方法
【推荐1】某工厂的废水中含有大量的FeSO4和较多的Cu2+。为了减少污染并变废为宝,工厂计划从该废水中回收FeSO4和金属Cu。请根据以下流程图,回答下列问题。
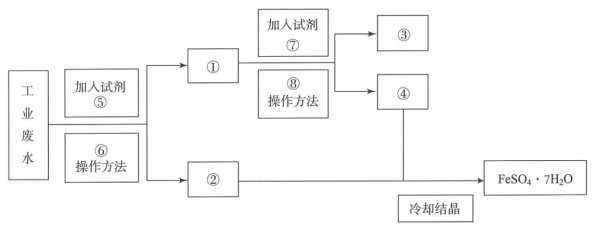
(1)填写下列标号所代表的物质(主要成分化学物质的化学式):①_______ ②_______ ③_______ ④_______ ⑤_______ ⑦_______
(2)写出加入试剂⑤与工业废水反应的离子方程式:_______

(1)填写下列标号所代表的物质(主要成分化学物质的化学式):①
(2)写出加入试剂⑤与工业废水反应的离子方程式:
您最近一年使用:0次
解答题-工业流程题
|
容易
(0.94)
名校
【推荐2】为充分利用资源,变废为宝,实验室里利用废铁屑制取硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]。某兴趣小组以废铁屑制得硫酸亚铁铵后,按下列流程制备二水合草酸亚铁(FeC2O4·2H2O),进一步制备高纯度还原铁粉。

已知:①硫酸亚铁铵晶体在空气中不易被氧化,易溶于水,不溶于乙醇。
②FeC2O4·2H2O难溶于水,150℃开始失结晶水;H2C2O4易溶于水,溶解度随温度升高而增大。
请回答下列问题:
(1)步骤②中,H2C2O4稍过量的主要原因是___________ 。
(2)为了提高步骤③得到的FeC2O4·2H2O的纯度,宜用___________ (填“热水”“冷水”或“无水乙醇”)洗涤,检验洗涤是否干净的操作是___________ 。
(3)实现步骤④必须用到的两种仪器是___________ 。
(供选仪器:a.烧杯;b.坩埚;c.蒸馏烧瓶;d.高温炉;e.表面皿;f.锥形瓶)
(4)为实现步骤⑤,不宜用碳粉还原Fe2O3,理由是___________ 。
(5)硫酸亚铁铵是重要的工业原料,几种物质的溶解性如表所示:
(注意:高于73.3℃,FeSO4·7H2O发生分解)
以铁屑(有油污)、硫酸、硫酸铵为原料,补充制取硫酸亚铁铵晶体的实验方案:将铁屑置于锥形瓶中,___________ 低温干燥。[实验中须使用的试剂:铁屑、1.0mol·L-1的Na2CO3溶液、蒸馏水、3.0mol·L-1的H2SO4溶液,饱和(NH4)2SO4溶液、无水乙醇]

已知:①硫酸亚铁铵晶体在空气中不易被氧化,易溶于水,不溶于乙醇。
②FeC2O4·2H2O难溶于水,150℃开始失结晶水;H2C2O4易溶于水,溶解度随温度升高而增大。
请回答下列问题:
(1)步骤②中,H2C2O4稍过量的主要原因是
(2)为了提高步骤③得到的FeC2O4·2H2O的纯度,宜用
(3)实现步骤④必须用到的两种仪器是
(供选仪器:a.烧杯;b.坩埚;c.蒸馏烧瓶;d.高温炉;e.表面皿;f.锥形瓶)
(4)为实现步骤⑤,不宜用碳粉还原Fe2O3,理由是
(5)硫酸亚铁铵是重要的工业原料,几种物质的溶解性如表所示:
| 温度/℃ 物质溶解度/g | 10 | 20 | 30 | 40 | 50 | 60 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4·7H2O | 40.0 | 48.0 | 60.0 | 73.3 | — | — |
| (NH4)2Fe(SO4)2·6H2O | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
以铁屑(有油污)、硫酸、硫酸铵为原料,补充制取硫酸亚铁铵晶体的实验方案:将铁屑置于锥形瓶中,
您最近一年使用:0次
解答题-工业流程题
|
容易
(0.94)
解题方法
【推荐3】绿矾( )可用作局部收敛剂及补血剂。某工厂产生的烧渣(主要含
)可用作局部收敛剂及补血剂。某工厂产生的烧渣(主要含 、FeO,还有一定量的
、FeO,还有一定量的 )可用于制绿矾晶体,其工艺流程如下:
)可用于制绿矾晶体,其工艺流程如下:
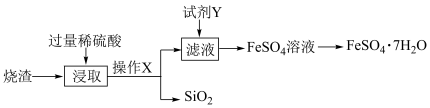
查阅资料: 不溶于水,也不与稀硫酸反应。
不溶于水,也不与稀硫酸反应。
(1)操作X的名称为________ 。
(2)“浸取”步骤中,反应的离子方程式分别为________ 、________ 。
(3)试剂Y的作用是将 转化为
转化为 。
。
①若试剂Y是 ,转化原理用离子方程式表示为
,转化原理用离子方程式表示为 ,
, 属于
属于________ (填“氧化产物”或“还原产物”)。
②若试剂Y是Fe,转化原理用离子方程式表示为________ ,化工生产中②比①好,从物质利用率角度考虑,其原因是________ 。
(4)加入试剂Y充分反应后,如何证明滤液中已不含 ,写出实验操作和现象:
,写出实验操作和现象:________ 。
 )可用作局部收敛剂及补血剂。某工厂产生的烧渣(主要含
)可用作局部收敛剂及补血剂。某工厂产生的烧渣(主要含 、FeO,还有一定量的
、FeO,还有一定量的 )可用于制绿矾晶体,其工艺流程如下:
)可用于制绿矾晶体,其工艺流程如下:
查阅资料:
 不溶于水,也不与稀硫酸反应。
不溶于水,也不与稀硫酸反应。(1)操作X的名称为
(2)“浸取”步骤中,反应的离子方程式分别为
(3)试剂Y的作用是将
 转化为
转化为 。
。①若试剂Y是
 ,转化原理用离子方程式表示为
,转化原理用离子方程式表示为 ,
, 属于
属于②若试剂Y是Fe,转化原理用离子方程式表示为
(4)加入试剂Y充分反应后,如何证明滤液中已不含
 ,写出实验操作和现象:
,写出实验操作和现象:
您最近一年使用:0次
解答题-实验探究题
|
容易
(0.94)
【推荐1】 可用于制取
可用于制取 和
和 ,实验室制取纯净、干燥的
,实验室制取纯净、干燥的 的装置如下图。
的装置如下图。
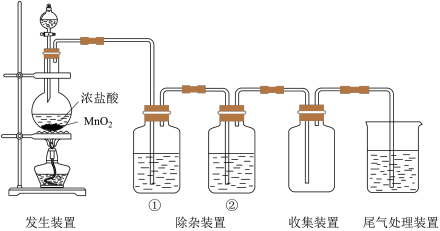
(1)实验室制取 的化学方程式是
的化学方程式是_______ 。
(2)除杂装置①中的试剂是_______ 。
(3)实验室加热 和
和 的固体混合物制取
的固体混合物制取 ,同时生成
,同时生成 ,反应中
,反应中 是催化剂,化学方程式是
是催化剂,化学方程式是_______ 。
 可用于制取
可用于制取 和
和 ,实验室制取纯净、干燥的
,实验室制取纯净、干燥的 的装置如下图。
的装置如下图。
(1)实验室制取
 的化学方程式是
的化学方程式是(2)除杂装置①中的试剂是
(3)实验室加热
 和
和 的固体混合物制取
的固体混合物制取 ,同时生成
,同时生成 ,反应中
,反应中 是催化剂,化学方程式是
是催化剂,化学方程式是
您最近一年使用:0次
解答题-实验探究题
|
容易
(0.94)
【推荐2】写出Fe2O3与Al粉混合物发生铝热反应的化学方程式:___________________ 。为使该铝热反应顺利进行,还需要的辅助试剂有_______________________ 。
实验探究:我们发现教材【实验4—1】的实验,没有要求检验反应产物铁单质的存在。请你说一说本实验结束后检验蒸发皿中沙子里熔渣物里是否含有单质铁的方法_________ 。如果没有检验出金属铁,请你说出可能的原因是什么?或提出如何改进实验的建议:__________________________________ 。(能回答其中一点即可)
实验探究:我们发现教材【实验4—1】的实验,没有要求检验反应产物铁单质的存在。请你说一说本实验结束后检验蒸发皿中沙子里熔渣物里是否含有单质铁的方法
您最近一年使用:0次
解答题-实验探究题
|
容易
(0.94)
名校
解题方法
【推荐3】实验室用如图所示装置制备并收集纯净干燥的氯气,请回答下列问题:

(1)按气流从左到右,装置正确的连接顺序为_______ (填各接口字母,可重复连接)。
(2)烧瓶中发生反应的化学方程式为:_______ 。反应中盐酸体现的性质有_______ 。
(3)仪器A的名称是_______ ,装置D的作用是_______ 。
(4)某研究小组甲模仿侯德榜制备纯碱,反应原理如下: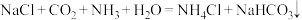 ,即向饱和食盐水中通入足量氨气至饱和,然后通入过量二氧化碳,析出溶解度
,即向饱和食盐水中通入足量氨气至饱和,然后通入过量二氧化碳,析出溶解度_______ (填“较小”或“较大”)的碳酸氢钠。欲得到纯碱,该研究小组将固体过滤、洗涤后,还需进行的操作是_______ (填序号)。
A. B.
B. C.
C. D.
D.

(1)按气流从左到右,装置正确的连接顺序为
(2)烧瓶中发生反应的化学方程式为:
(3)仪器A的名称是
(4)某研究小组甲模仿侯德榜制备纯碱,反应原理如下:
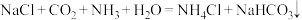 ,即向饱和食盐水中通入足量氨气至饱和,然后通入过量二氧化碳,析出溶解度
,即向饱和食盐水中通入足量氨气至饱和,然后通入过量二氧化碳,析出溶解度A.
 B.
B. C.
C. D.
D.
您最近一年使用:0次
解答题-实验探究题
|
容易
(0.94)
解题方法
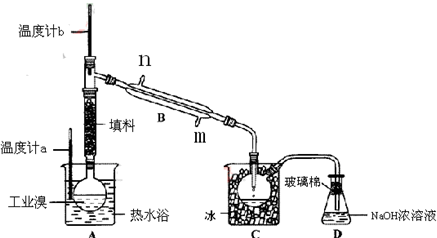
【推荐1】某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性和强挥发性。他们参观生产过程后,绘制了如图装置简图。
请你参与分析讨论:
(1)图中仪器B的名称:_____ ,冷却水从_____ 进,_____ 出。
(2)烧杯A的作用_____________ ,C中冰的作用是_____ 。

请你参与分析讨论:
(1)图中仪器B的名称:
(2)烧杯A的作用
您最近一年使用:0次
解答题-实验探究题
|
容易
(0.94)
名校
【推荐2】FeCl3为黑棕色固体,无水氯化铁在300℃以上升华,遇潮湿空气极易潮解。
(1)甲组同学拟用下列装置制取纯净干燥的氯气。
①装置B的作用是_________
②装置A中发生反应时消耗的氧化剂和还原剂的物质的量之比为__________
(2)乙组同学选用甲组实验中的装置ABC和下列装置制取FeCl3

①乙组同学的实验装置中,依次连接的合理顺序为:a→_____ →_____ →_____ →_____ →_____ →_____
②连好装置,检查装置的气密性,先打开装置A中___________ (填仪器的名称)的活塞,直到______ 再点燃装置F处的酒精灯,目的是_______
③装置D的作用有_______
(3)实验结束后,取少量F中的固体加水溶解,欲对所得产物FeCl3中是否含有FeCl2进行检测,所需试剂是_______
a.KSCN b.H2O2 c.K3[Fe(CN)6] d. .K4[Fe(CN)6]
经检测发现溶液中含有Fe2+,丙同学认为所得产物FeCl3中一定含有FeCl2,丁同学认为不一定,理由是_____
(1)甲组同学拟用下列装置制取纯净干燥的氯气。
①装置B的作用是
②装置A中发生反应时消耗的氧化剂和还原剂的物质的量之比为
(2)乙组同学选用甲组实验中的装置ABC和下列装置制取FeCl3

①乙组同学的实验装置中,依次连接的合理顺序为:a→
②连好装置,检查装置的气密性,先打开装置A中
③装置D的作用有
(3)实验结束后,取少量F中的固体加水溶解,欲对所得产物FeCl3中是否含有FeCl2进行检测,所需试剂是
a.KSCN b.H2O2 c.K3[Fe(CN)6] d. .K4[Fe(CN)6]
经检测发现溶液中含有Fe2+,丙同学认为所得产物FeCl3中一定含有FeCl2,丁同学认为不一定,理由是
您最近一年使用:0次
解答题-实验探究题
|
容易
(0.94)
解题方法
【推荐3】在中国古代,硫酸被炼丹术士称为“绿矾油”。这是因为生产硫酸最古老的方法是以绿矾为原料,在蒸馏釜中煅烧后,釜中逸出刺激性气味的气体,同时有油状液体流出,残留固体呈红棕色。

(1)请写出煅烧绿矾过程中发生反应的化学方程式:
①___________ ;
②___________ 。
(2)化学探究小组的同学用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去),其中b为干燥的试管。下列关于该反应说法正确的是___________。

(1)请写出煅烧绿矾过程中发生反应的化学方程式:
①
②
(2)化学探究小组的同学用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去),其中b为干燥的试管。下列关于该反应说法正确的是___________。
A.若将反应后的气体通入 溶液中,产生的沉淀为 溶液中,产生的沉淀为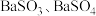 |
B.b中产物用紫色石蕊试液即可检验出其中 和 和 |
C.为检验反应的气态生成物是 ,试管c中应加入的试剂为NaOH溶液 ,试管c中应加入的试剂为NaOH溶液 |
| D.b中所得到的硫酸的质量分数为29.5% |
您最近一年使用:0次



