填空。
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。
已知①2CH4(g)+ 3O2(g) = 2 CO(g)+ 4 H2O(l) △H1 = -1214.6 kJ/mol
②2 CO(g)+ O2(g) =2 CO2(g) ΔH2 = -566 kJ/mol
则反应CH4(g)+2O2(g) = CO2(g)+2H2O(l) 的△H=_______ 。
(2)如图,水槽中试管内有一枚铁钉,放置数天观察:
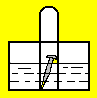
若液面上升,发生_______ 腐蚀(填“析氢”或“吸氧”),负极电极反应式:_______ ,正极电极反应式:_______
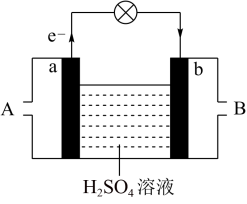
(3)将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。通入CH4的一极,其电极反应式是_______ 。
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。
已知①2CH4(g)+ 3O2(g) = 2 CO(g)+ 4 H2O(l) △H1 = -1214.6 kJ/mol
②2 CO(g)+ O2(g) =2 CO2(g) ΔH2 = -566 kJ/mol
则反应CH4(g)+2O2(g) = CO2(g)+2H2O(l) 的△H=
(2)如图,水槽中试管内有一枚铁钉,放置数天观察:

若液面上升,发生
(3)将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。通入CH4的一极,其电极反应式是
更新时间:2022-12-11 13:14:40
|
相似题推荐
【推荐1】为减少 排放,科学家着眼于能源转换和再利用等问题。回答下列问题:
排放,科学家着眼于能源转换和再利用等问题。回答下列问题:
(1)我国科学家采用酞菁钴(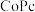 )和锌-氮-碳(
)和锌-氮-碳( )串联催化剂,可有效地将
)串联催化剂,可有效地将 还原为甲烷。模拟装置如图1所示,串联催化剂表面反应历程如图2所示。
还原为甲烷。模拟装置如图1所示,串联催化剂表面反应历程如图2所示。
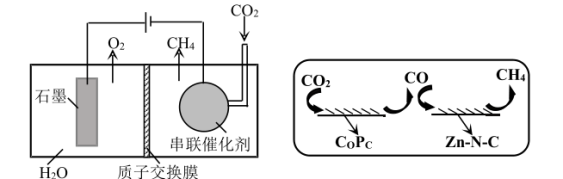
①关于该装置的说法错误的是_______ 。
A.串联催化剂表面发生的反应为: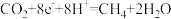
B.该串联催化装置,可将 制备
制备 的过程分解在两种活性位点上进行
的过程分解在两种活性位点上进行
C. 在
在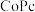 表面被氧化,生成中间产物
表面被氧化,生成中间产物
D.标准状况下,每生成 ,理论上可处理
,理论上可处理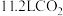
②已知: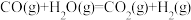 ΔH1=-akJ/mol
ΔH1=-akJ/mol
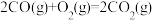 ΔH2=-bkJ/mol
ΔH2=-bkJ/mol
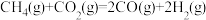 ΔH3=+ckJ/mol(a、b、c均为正值)
ΔH3=+ckJ/mol(a、b、c均为正值)
则反应 的ΔH4=
的ΔH4=_______ kJ/mol (用a、b、c表示)。
(2) 还可制取
还可制取 和水蒸气。将
和水蒸气。将 和
和 充入
充入 恒容密闭容器中,在两种不同催化剂作用下发生反应,相同时间内
恒容密闭容器中,在两种不同催化剂作用下发生反应,相同时间内 的转化率随温度变化曲线如图3所示:
的转化率随温度变化曲线如图3所示:
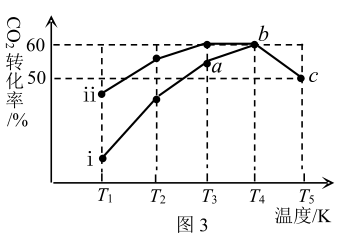
① 点时v正
点时v正_______ v逆 (填“>”“<”“=”)。
②随温度的升高, 的转化率先增大后减小,理由是
的转化率先增大后减小,理由是_______ 。
③已知c点时容器内的压强为P,在T5温度下该反应的平衡常数Kp为_______ (用含P的关系式表示)。
(3)在某催化剂作用下, 和
和 还能发生如下反应:
还能发生如下反应: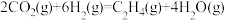 。图4所示为在体积为
。图4所示为在体积为 的恒容容器中,通入
的恒容容器中,通入 和
和 时,测得的温度对
时,测得的温度对 的平衡转化率和催化剂催化效率的影响:
的平衡转化率和催化剂催化效率的影响:
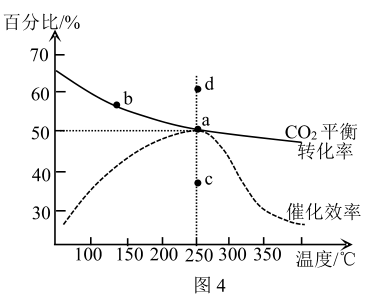
①a、b两点平衡常数的大小关系为:Ka_______ Kb (填“>”“<”)。
②如果不用催化剂,其他条件不变,则250℃时 的平衡转化率位于
的平衡转化率位于_______ 点(填“a”“c”“d”)。
 排放,科学家着眼于能源转换和再利用等问题。回答下列问题:
排放,科学家着眼于能源转换和再利用等问题。回答下列问题:(1)我国科学家采用酞菁钴(
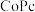 )和锌-氮-碳(
)和锌-氮-碳( )串联催化剂,可有效地将
)串联催化剂,可有效地将 还原为甲烷。模拟装置如图1所示,串联催化剂表面反应历程如图2所示。
还原为甲烷。模拟装置如图1所示,串联催化剂表面反应历程如图2所示。
图1 图2
①关于该装置的说法错误的是
A.串联催化剂表面发生的反应为:
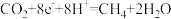
B.该串联催化装置,可将
 制备
制备 的过程分解在两种活性位点上进行
的过程分解在两种活性位点上进行C.
 在
在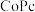 表面被氧化,生成中间产物
表面被氧化,生成中间产物
D.标准状况下,每生成
 ,理论上可处理
,理论上可处理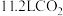
②已知:
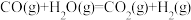 ΔH1=-akJ/mol
ΔH1=-akJ/mol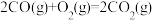 ΔH2=-bkJ/mol
ΔH2=-bkJ/mol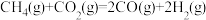 ΔH3=+ckJ/mol(a、b、c均为正值)
ΔH3=+ckJ/mol(a、b、c均为正值)则反应
 的ΔH4=
的ΔH4=(2)
 还可制取
还可制取 和水蒸气。将
和水蒸气。将 和
和 充入
充入 恒容密闭容器中,在两种不同催化剂作用下发生反应,相同时间内
恒容密闭容器中,在两种不同催化剂作用下发生反应,相同时间内 的转化率随温度变化曲线如图3所示:
的转化率随温度变化曲线如图3所示:
①
 点时v正
点时v正②随温度的升高,
 的转化率先增大后减小,理由是
的转化率先增大后减小,理由是③已知c点时容器内的压强为P,在T5温度下该反应的平衡常数Kp为
(3)在某催化剂作用下,
 和
和 还能发生如下反应:
还能发生如下反应: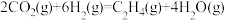 。图4所示为在体积为
。图4所示为在体积为 的恒容容器中,通入
的恒容容器中,通入 和
和 时,测得的温度对
时,测得的温度对 的平衡转化率和催化剂催化效率的影响:
的平衡转化率和催化剂催化效率的影响:
①a、b两点平衡常数的大小关系为:Ka
②如果不用催化剂,其他条件不变,则250℃时
 的平衡转化率位于
的平衡转化率位于
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】Ⅰ.肼(N2H4)又称联氨,常温时是一种可燃性液体,可用作火箭燃料。
①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH4
上述反应热效应之间的关系式为ΔH4=___ 。(用ΔH1、ΔH2、ΔH3表示)
Ⅱ.如图所示,某研究性学习小组利用上述燃烧原理设计一个肼(N2H4)─空气燃料电池(如图甲)并探究某些工业原理,其中乙装置中X为阳离子交换膜(即只允许阳离子通过)。

根据要求回答相关问题:
(1)甲装置中通入___ 气体的一极为正极。
(2)乙装置中石墨电极为___ 极,其电极反应式为__ ;可以用__ 检验该反应产物,电解一段时间后,乙池中的溶液呈__ 性。
(3)图中用丙装置模拟工业中的___ 原理,如果电解后丙装置精铜质量增加3.2g,则理论上甲装置中肼消耗质量为__ g。
①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH4
上述反应热效应之间的关系式为ΔH4=
Ⅱ.如图所示,某研究性学习小组利用上述燃烧原理设计一个肼(N2H4)─空气燃料电池(如图甲)并探究某些工业原理,其中乙装置中X为阳离子交换膜(即只允许阳离子通过)。

根据要求回答相关问题:
(1)甲装置中通入
(2)乙装置中石墨电极为
(3)图中用丙装置模拟工业中的
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】科学处理NOx、SO2等大气污染物,对改善人们的生存环境具有重要的现实意义。
(1)利用甲烷催化还原氮氧化物。已知:
CH4(g) +4NO2(g) =4NO(g)+CO2(g) +2H2O(g);△H=-574kJ•mol-1
CH4(g)+2NO2(g)=N2(g) +CO2(g)+2H2O(g);△H=-867kJ•mol-1
则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=____________________
(2)利用氧化氮氧化物的流程如下:
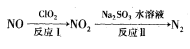
已知反应I的化学方程式为2NO+ClO2+H2O=NO2+HNO3+HCl,若反应I中转移3mol电子,则反应Ⅱ中可生成N2的体积为_____ L(标准状况下)。
(3)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水的电离程度_____ (填“增大”、“减小”或“不变”);请写出Na2SO3溶液中,c(Na+)、c(H2SO3)、c(SO32-)、c(HSO3-)的大小关系:_____ 。
(4)利用Fe2(SO4)3溶液也可处理SO2废气,所得Fe2+溶液有很多重要用途。保存1.8mol•L﹣1的FeSO4溶液时,为防止溶液中Fe2+被氧化,常加入_____ ;为确保溶液中不出现浑浊,应调节溶液的pH不超过_____ 。(常温下,Ksp[Fe(OH) 2]=1.8×10﹣16)
(1)利用甲烷催化还原氮氧化物。已知:
CH4(g) +4NO2(g) =4NO(g)+CO2(g) +2H2O(g);△H=-574kJ•mol-1
CH4(g)+2NO2(g)=N2(g) +CO2(g)+2H2O(g);△H=-867kJ•mol-1
则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=
(2)利用氧化氮氧化物的流程如下:
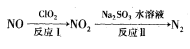
已知反应I的化学方程式为2NO+ClO2+H2O=NO2+HNO3+HCl,若反应I中转移3mol电子,则反应Ⅱ中可生成N2的体积为
(3)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水的电离程度
(4)利用Fe2(SO4)3溶液也可处理SO2废气,所得Fe2+溶液有很多重要用途。保存1.8mol•L﹣1的FeSO4溶液时,为防止溶液中Fe2+被氧化,常加入
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】Ⅰ.传统的定量化学实验受到计量手段的制约而研究范围狭窄、精确度不高,DIS数字化信息系统(由传感器、数据采集器和计算机组成)因为可以准确测量气压、浓度、pH、温度等而在化学实验研究中应用越来越广泛深入。将打磨后的镁条放入锥形瓶中,再将注射器中某浓度的盐酸压入锥形瓶中如图1,通过数字传感器测定实验中密闭容器(气密性良好)内压强与时间的关系如图2所示。
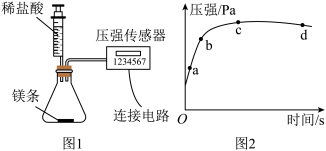
(1)镁条与稀盐酸反应为___________ (填“吸热”或“放热”)反应,图2中a、b、c、d四个点中,产生氢气最快的为___________ 点。
Ⅱ.向恒温恒容的密闭容器中,加入足量的碳和一定量NO,发生反应: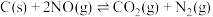 ,数字传感器测得CO2浓度随时间变化如表:
,数字传感器测得CO2浓度随时间变化如表:
(2)下列措施能加快反应速率的是___________。
(3)0~90s用NO来表示反应的平均速率为___________ 。
(4)下列能说明反应达到平衡状态的是___________。
(5)已知合成氨反应中,随温度升高氨的产率会下降。在实际生产中,选定的温度为400℃~500℃,为避免产率太低反应的温度不宜过高,但温度也不宜过低,原因是___________ 。除传统方法外,近几年科学家在研究利用原电池原理进行常温常压下合成氨。一种通过原电池进行合成氨的装置如图,在该装置中,电极a为___________ 极(填“正”或“负”),该电极的电极反应式为___________ 。

(6)合成氨反应可能的微观历程如图所示:
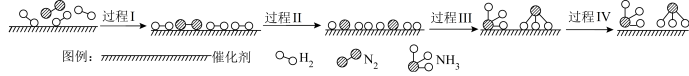
吸附在催化剂表面的物质用*标注。已知过程Ⅲ可以表示为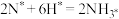 ,则过程Ⅱ可以表示为
,则过程Ⅱ可以表示为___________ 。

(1)镁条与稀盐酸反应为
Ⅱ.向恒温恒容的密闭容器中,加入足量的碳和一定量NO,发生反应:
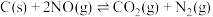 ,数字传感器测得CO2浓度随时间变化如表:
,数字传感器测得CO2浓度随时间变化如表:反应时间/ | 0 | 80 | 90 | 100 | 110 |
 浓度/( 浓度/( ) ) | 0.00 | 0.30 | 0.36 | 0.39 | 0.39 |
| A.及时分离出氮气 | B.升高反应体系温度 |
| C.使用高效催化剂 | D.在体系中通入氦气 |
(4)下列能说明反应达到平衡状态的是___________。
A. |
| B.容器内压强不再改变 |
| C.容器内气体的平均相对分子质量不再改变 |
| D.N2的体积分数不再改变 |

(6)合成氨反应可能的微观历程如图所示:

吸附在催化剂表面的物质用*标注。已知过程Ⅲ可以表示为
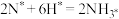 ,则过程Ⅱ可以表示为
,则过程Ⅱ可以表示为
您最近一年使用:0次
【推荐2】Ⅰ.将 CO2转化为有价值的化工原料,正成为科学家们研究的重要领域。回答下列问题:
(1)已知:
①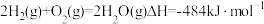
②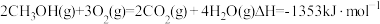
则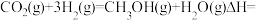
_____ 
(2)在恒压密闭容器中通入 CO2和 H2的混合气体制备甲醇。过程中测得甲醇的时空收率(STY)(表示单位物质的量催化剂表面甲醇的平均生成速率)随温度(T)变化如下表:
在 220°C 和 170 °C 条件下,该反应速率之比: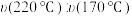
___ 。
(3)CO2催化加氢制甲醇过程中,存在竞争的副反应主要是: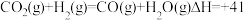
 在恒温密闭容器中,CO2的平衡转化率[α(CO2)%]和甲醇选择性[CH3OH%=
在恒温密闭容器中,CO2的平衡转化率[α(CO2)%]和甲醇选择性[CH3OH%= 随着温度变化关系如图所示。
随着温度变化关系如图所示。
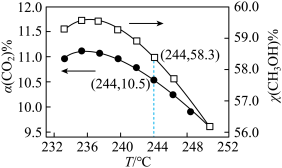
①分析温度高于 236°C 时图中曲线下降的原因_____ 。
②按 1 mol CO2(g)、3 mol H2(g)投料反应,计算 244°C 时反应生成 CH3OH 的物质的量为_____ mol。 (保留两位有效数字)
③在压强为p 的反应条件下,1 mol CO2(g)和 3 mol H2(g)反应并达到平衡状态,CO2平衡转化率为 20%,甲醇选择性为 50%,该温度下主反应的平衡常数 Kp=_____ 。 ( 列出计 算式即可,用平衡分压代替平衡浓度,分压=总压×物质的量分数)
Ⅱ.
(4)工业上也可用 H2还原 CO 电化学法制备甲醇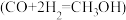 的工作原理如上图所示。电池工作过程中 H+通过质子膜向
的工作原理如上图所示。电池工作过程中 H+通过质子膜向_____ (填“左”或者“右”)移动,通入 CO 的一端发生的电极反应为_____ 。

(1)已知:
①
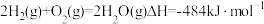
②
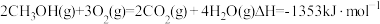
则
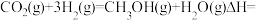

(2)在恒压密闭容器中通入 CO2和 H2的混合气体制备甲醇。过程中测得甲醇的时空收率(STY)(表示单位物质的量催化剂表面甲醇的平均生成速率)随温度(T)变化如下表:
| T/°C | 170 | 180 | 1 90 | 200 | 210 | 220 | 230 |
| STY/[mol/(mol·h)] | 0.10 | 0.15 | 0.20 | 0.25 | 0.28 | 0.20 | 0.15 |
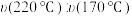
(3)CO2催化加氢制甲醇过程中,存在竞争的副反应主要是:
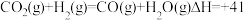
 在恒温密闭容器中,CO2的平衡转化率[α(CO2)%]和甲醇选择性[CH3OH%=
在恒温密闭容器中,CO2的平衡转化率[α(CO2)%]和甲醇选择性[CH3OH%= 随着温度变化关系如图所示。
随着温度变化关系如图所示。
①分析温度高于 236°C 时图中曲线下降的原因
②按 1 mol CO2(g)、3 mol H2(g)投料反应,计算 244°C 时反应生成 CH3OH 的物质的量为
③在压强为p 的反应条件下,1 mol CO2(g)和 3 mol H2(g)反应并达到平衡状态,CO2平衡转化率为 20%,甲醇选择性为 50%,该温度下主反应的平衡常数 Kp=
Ⅱ.
(4)工业上也可用 H2还原 CO 电化学法制备甲醇
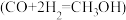 的工作原理如上图所示。电池工作过程中 H+通过质子膜向
的工作原理如上图所示。电池工作过程中 H+通过质子膜向
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】工业上甲醇的合成途径多种多样。现有在实验室中模拟甲醇的合成反应,在2L的密闭容器内以物质的量之比2∶5充入CO和 。在400℃时,发生反应:
。在400℃时,发生反应: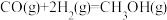 。体系中n(CO)随时间的变化如表:
。体系中n(CO)随时间的变化如表:
(1)如图表示反应中 的变化曲线,其中合理的是
的变化曲线,其中合理的是_______ 。

(2)用 表示
表示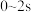 内该反应的平均速率
内该反应的平均速率
_______  。
。
(3)反应在3s时达到平衡,此时 的转化率为
的转化率为_______ 。
(4)能说明该反应已达到平衡状态的是_______ 。
a.
b.容器内压强保持不变
c.断开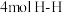 键的同时断开
键的同时断开 键
键
d.容器内气体密度保持不变
e.CO的浓度保持不变
(5) 与
与 的反应可将化学能转化为电能,其工作原理如图所示。图中
的反应可将化学能转化为电能,其工作原理如图所示。图中 从
从_______ (填A或B)通入,b电极附近溶液pH将_______ (填升高、降低或不变),a电极的电极反应式是_______ 。
 。在400℃时,发生反应:
。在400℃时,发生反应: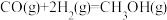 。体系中n(CO)随时间的变化如表:
。体系中n(CO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 5 |
| n(CO)(mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 |
 的变化曲线,其中合理的是
的变化曲线,其中合理的是
(2)用
 表示
表示 内该反应的平均速率
内该反应的平均速率
 。
。(3)反应在3s时达到平衡,此时
 的转化率为
的转化率为(4)能说明该反应已达到平衡状态的是
a.

b.容器内压强保持不变
c.断开
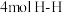 键的同时断开
键的同时断开 键
键d.容器内气体密度保持不变
e.CO的浓度保持不变
(5)
 与
与 的反应可将化学能转化为电能,其工作原理如图所示。图中
的反应可将化学能转化为电能,其工作原理如图所示。图中 从
从
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】I.用50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题
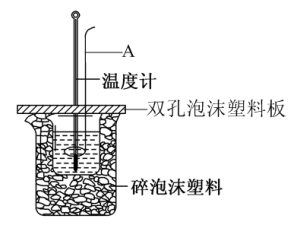
(1)图中仪器A的名称___________
(2)碎泡沫塑料的作用是___________ ,用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得中和热的数值会___________ 57.3kJ/mol(填“大于”、“小于”或“等于”)。
(3)取50mL 0.50mol·L-1NaOH溶液和50mL 0.50mol/L硫酸溶液进行中和测定实验,实验数据如下表:
①近似认为0.50mol·L-1NaOH溶液和0.50mol·L-1硫酸溶液的密度都是1g·cm-3,中和后生成溶液的比热容c=4.18J·g-1·℃-1,则中和热ΔH=___________ 。(取小数点后一位)
②上述实验数值结果与57.3kJ·mol-1有偏差,产生偏差的原因可能是___________ (填字母)。
a. 实验装置保温、隔热效果差
b. 量取NaOH溶液的体积时仰视读数
c. 分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d. 用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
II.(1)煤燃烧的反应热可通过以下两个途径来利用:a.利用煤在充足的空气中直接燃烧产生的反应热;b.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的热化学方程式为:
a. C(s)+O2(g)=CO2(g) ΔH=E1①
b. C(s)+H2O(g)=CO(g)+H2(g) ΔH=E2②
请表达E1、E2、E3、E4之间的关系为E2=___________ 。
(2)如图所示,在常温常压下,1摩尔NO2和1摩尔CO完全反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:___________ 。

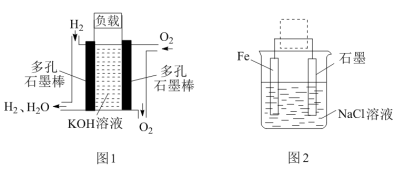
(3)被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点,图1为氢氧燃料电池的结构示意图,试回答下列问题:
①写出该氢氧燃料电池工作时负极的反应式___________ 。
②用图1作为电源连接图2装置,铁电极与图1通氧气的电极相连进行电解,写出电解池的化学方程式:___________ 。
③钢铁生锈现象随处可见,钢铁的电化学腐蚀原理如图2(Fe与石墨用导线相连)所示:写出该电池反应的总反应方程式:___________ 。

(1)图中仪器A的名称
(2)碎泡沫塑料的作用是
(3)取50mL 0.50mol·L-1NaOH溶液和50mL 0.50mol/L硫酸溶液进行中和测定实验,实验数据如下表:
| 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | ||
| H2SO4 | NaOH | 平均值 | ||
| 1 | 26.2 | 26.0 | 26.1 | 29.6 |
| 2 | 27.0 | 27.4 | 27.2 | 30.8 |
| 3 | 25.9 | 25.9 | 25.9 | 29.3 |
| 4 | 26.4 | 26.2 | 26.3 | 31.4 |
①近似认为0.50mol·L-1NaOH溶液和0.50mol·L-1硫酸溶液的密度都是1g·cm-3,中和后生成溶液的比热容c=4.18J·g-1·℃-1,则中和热ΔH=
②上述实验数值结果与57.3kJ·mol-1有偏差,产生偏差的原因可能是
a. 实验装置保温、隔热效果差
b. 量取NaOH溶液的体积时仰视读数
c. 分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d. 用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
II.(1)煤燃烧的反应热可通过以下两个途径来利用:a.利用煤在充足的空气中直接燃烧产生的反应热;b.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的热化学方程式为:
a. C(s)+O2(g)=CO2(g) ΔH=E1①
b. C(s)+H2O(g)=CO(g)+H2(g) ΔH=E2②
H2(g)+ O2(g)=H2O(g) ΔH=E3③
O2(g)=H2O(g) ΔH=E3③
CO(g)+ O2(g)=CO2(g) ΔH=E4④
O2(g)=CO2(g) ΔH=E4④
请表达E1、E2、E3、E4之间的关系为E2=
(2)如图所示,在常温常压下,1摩尔NO2和1摩尔CO完全反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:

(3)被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点,图1为氢氧燃料电池的结构示意图,试回答下列问题:
①写出该氢氧燃料电池工作时负极的反应式
②用图1作为电源连接图2装置,铁电极与图1通氧气的电极相连进行电解,写出电解池的化学方程式:
③钢铁生锈现象随处可见,钢铁的电化学腐蚀原理如图2(Fe与石墨用导线相连)所示:写出该电池反应的总反应方程式:

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】化学是一门以实验为基础的学科。回答下列问题:
Ⅰ.中和反应反应热的测定。
测定50mL 0.50mol/L盐酸和50mL 0.55mol/L NaOH溶液中和反应时放出的热量。
(1)采用稍过量的NaOH溶液的原因是_______ 。
(2)若两种溶液的密度均为 ,反应后生成溶液的比热容
,反应后生成溶液的比热容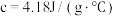 ,反应过程中测得体系温度升高3℃,则该反应放出
,反应过程中测得体系温度升高3℃,则该反应放出_______ kJ热量。
Ⅱ.温度对化学平衡的影响。
(3)在 生成
生成 的反应中,存在如下平衡:
的反应中,存在如下平衡:
 。取两个封装有
。取两个封装有 和
和 混合气体的圆底烧瓶,将它们分别浸在盛有热水、冷水的大烧杯中。片刻后,比较两个烧瓶里气体的颜色,浸在
混合气体的圆底烧瓶,将它们分别浸在盛有热水、冷水的大烧杯中。片刻后,比较两个烧瓶里气体的颜色,浸在_______ (填“热水”或“冷水”)中的颜色更深,产生这一现象的原因是_______ 。
ⅢI.简易原电池反应。
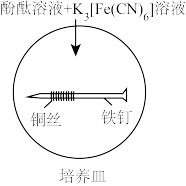
(4)培养皿内装有含NaCl饱和溶液的琼脂,再滴入5~6滴酚酞溶液和 溶液,混合均匀,铁钉用砂纸磨光,缠上铜丝放入培养皿中。一段时间后,可观察到没有缠铜丝的铁钉附近产生
溶液,混合均匀,铁钉用砂纸磨光,缠上铜丝放入培养皿中。一段时间后,可观察到没有缠铜丝的铁钉附近产生_______ 色的_______ (填化学式)沉淀;铜丝周围的现象是_______ ,发生的电极反应式为_______ 。
Ⅰ.中和反应反应热的测定。
测定50mL 0.50mol/L盐酸和50mL 0.55mol/L NaOH溶液中和反应时放出的热量。
(1)采用稍过量的NaOH溶液的原因是
(2)若两种溶液的密度均为
 ,反应后生成溶液的比热容
,反应后生成溶液的比热容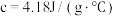 ,反应过程中测得体系温度升高3℃,则该反应放出
,反应过程中测得体系温度升高3℃,则该反应放出Ⅱ.温度对化学平衡的影响。
(3)在
 生成
生成 的反应中,存在如下平衡:
的反应中,存在如下平衡:
 。取两个封装有
。取两个封装有 和
和 混合气体的圆底烧瓶,将它们分别浸在盛有热水、冷水的大烧杯中。片刻后,比较两个烧瓶里气体的颜色,浸在
混合气体的圆底烧瓶,将它们分别浸在盛有热水、冷水的大烧杯中。片刻后,比较两个烧瓶里气体的颜色,浸在ⅢI.简易原电池反应。
(4)培养皿内装有含NaCl饱和溶液的琼脂,再滴入5~6滴酚酞溶液和
 溶液,混合均匀,铁钉用砂纸磨光,缠上铜丝放入培养皿中。一段时间后,可观察到没有缠铜丝的铁钉附近产生
溶液,混合均匀,铁钉用砂纸磨光,缠上铜丝放入培养皿中。一段时间后,可观察到没有缠铜丝的铁钉附近产生
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】研究金属的腐蚀过程及防腐蚀对人们的日常生活有重大意义。完成下列填空:
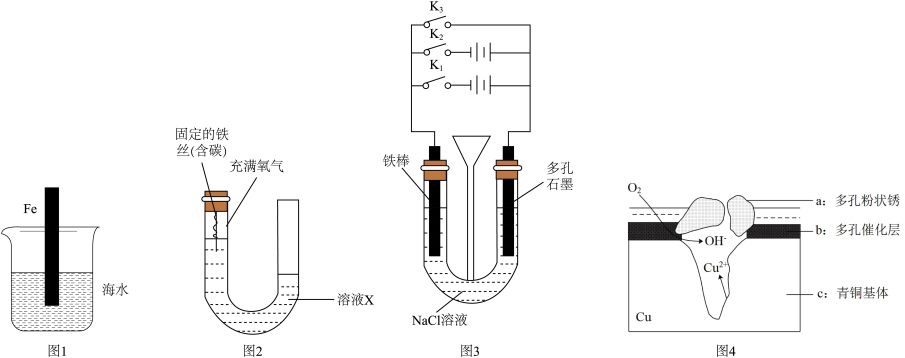
(1)已知:海水的pH约为8.1,图1的腐蚀过程属于___________ (选填“吸氧腐蚀”或“析氢腐蚀”)。图1插入海水中的铁棒(含碳量为10.8%)越靠近烧杯底部发生电化学腐蚀就越___________ (选填“轻微”、“严重”)。该实验说明___________ 因素会影响铁的腐蚀速率。写出腐蚀时正极的电极反应式___________ 。
(2)用图2研究铁的腐蚀过程。预测恒温条件下反应一段时间后,U形管内液面的变化情况。(已知:起始时两管内液面相平,实验过程中铁丝始终不接触溶液,选填“左高右低”、“左低右高”或“相平”)
该组实验的目的是:研究___________ 、___________ 等因素会对铁的腐蚀过程产生影响。
(3)用图3所示装置研究铁的防腐蚀过程:
① 、
、 、
、 只关闭一个,则铁腐蚀的速度最快的是只闭合
只关闭一个,则铁腐蚀的速度最快的是只闭合___________ (填“ ”、“
”、“ ”或“
”或“ ”,下同);
”,下同);
②为减缓铁的腐蚀,应只闭合___________ ,该防护法称为___________ ;
③只闭合 ,石墨电极附近的pH将
,石墨电极附近的pH将___________ (填“变大”、“变小”或“不变”)。
(4)图4为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。
①腐蚀过程中,负极是___________ (填“a”、“b”或“c”)。
②环境中的 扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈
扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈 ,总的离子方程式为
,总的离子方程式为___________ 。
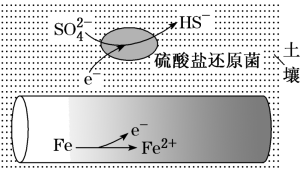
(5)深埋在潮湿土壤中的铁管道,在硫酸盐还原菌作用下,能被硫酸根离子腐蚀,其电化学腐蚀原理下图所示,此腐蚀过程中,正极的电极反应式是___________ 。

(1)已知:海水的pH约为8.1,图1的腐蚀过程属于
(2)用图2研究铁的腐蚀过程。预测恒温条件下反应一段时间后,U形管内液面的变化情况。(已知:起始时两管内液面相平,实验过程中铁丝始终不接触溶液,选填“左高右低”、“左低右高”或“相平”)
| 溶液X | 浓硫酸 | 浓盐酸 | 稀硫酸 |
| 液面情况 |
(3)用图3所示装置研究铁的防腐蚀过程:
①
 、
、 、
、 只关闭一个,则铁腐蚀的速度最快的是只闭合
只关闭一个,则铁腐蚀的速度最快的是只闭合 ”、“
”、“ ”或“
”或“ ”,下同);
”,下同);②为减缓铁的腐蚀,应只闭合
③只闭合
 ,石墨电极附近的pH将
,石墨电极附近的pH将(4)图4为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。
①腐蚀过程中,负极是
②环境中的
 扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈
扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈 ,总的离子方程式为
,总的离子方程式为(5)深埋在潮湿土壤中的铁管道,在硫酸盐还原菌作用下,能被硫酸根离子腐蚀,其电化学腐蚀原理下图所示,此腐蚀过程中,正极的电极反应式是

您最近一年使用:0次



