 和浓盐酸在一定温度下反应,还原产物为黄绿色的易爆物二氧化氯。其变化可以表示为
和浓盐酸在一定温度下反应,还原产物为黄绿色的易爆物二氧化氯。其变化可以表示为 
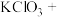
 HCl(浓)→
HCl(浓)→ KCl+
KCl+
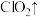 +
+
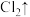 +
+

(1)请配平该化学方程式
(2)浓盐酸在反应中显示出来的性质是
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)该反应中氧化剂与还原剂的物质的量之比为
(4)若改变温度至70℃,发现
 和浓盐酸反应的氧化产物和还原产物均为二氧化氯气体,试写出反应的化学方程式:
和浓盐酸反应的氧化产物和还原产物均为二氧化氯气体,试写出反应的化学方程式:
更新时间:2022-12-20 17:54:40
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】高铁酸钾(K2FeO4)是一种易溶于水,高效的多功能水处理剂。工业上通常先制得高铁酸钠,然后在一定温度下,向高铁酸钠溶液中加入KOH至饱和,从而使高铁酸钾析出。
(1)高铁酸钾与水反应生成O2、Fe(OH)3(胶体)和KOH。
①该反应的离子方程式为_______________________________ 。
②高铁酸钾作为水处理剂起到的作用是______________________________________ 。
(2)①在无水条件下制备高铁酸钠的主要反应为2FeSO4+aNa2O2=2Na2FeO4+bX+2Na2SO4+cO2↑,该反应中物质X的化学式为________ ,b与c的关系是________ 。
②一定温度下,向高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾,原因是___________________________________________________________________ 。
(3)在碱性条件下,由氯化铁、氯气可制备出高铁酸钾,写出该反应的离子方程式:____________________________________________________________________________ 。
(1)高铁酸钾与水反应生成O2、Fe(OH)3(胶体)和KOH。
①该反应的离子方程式为
②高铁酸钾作为水处理剂起到的作用是
(2)①在无水条件下制备高铁酸钠的主要反应为2FeSO4+aNa2O2=2Na2FeO4+bX+2Na2SO4+cO2↑,该反应中物质X的化学式为
②一定温度下,向高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾,原因是
(3)在碱性条件下,由氯化铁、氯气可制备出高铁酸钾,写出该反应的离子方程式:
您最近半年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】铁和铝是两种重要的金属,它们的单质及其化合物有着各自的性质。
(1)现配制100mL0.01 mol•L-1FeCl3溶液,配制过程中需要的玻璃仪器除量筒、胶头滴管、烧杯外,还需要______________ ;
(2)将FeCl3溶液滴入沸水可得到红褐色液体,反应的离子方程式是__________ 。此液体具有的性质是_________ (填写序号字母)。
a.光束通过该液体时形成光亮的“通路”
b.将该液体进行过滤,可得到红褐色固体
c.向该液体中加入AgNO3溶液,无沉淀产生
d.该液体显酸性
(3)“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如溶液中氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强.
①该过程反应的化学方程式为__________ 。
②人们可利用Fe2(SO4)3作强氧化剂溶解铜矿石(Cu2S),然后加入铁屑进一步得到铜,该过程中发生的离子反应方程式如下,请补充完整并配平:____ Cu2S+____ Fe3++ ____ H2O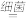
____ Cu2++____ Fe2++____ +____ SO42-
(4)羟胺(NH2OH)是 一种还原剂,用25.0mL0.49mol/L羟胺有酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.50mL 0.020mol/L的KMnO4酸性溶液反应(反应后MnO4-离子变成Mn2+)。则在上述反应中,羟胺的氧化产物中N的化合价是________ 。
(1)现配制100mL0.01 mol•L-1FeCl3溶液,配制过程中需要的玻璃仪器除量筒、胶头滴管、烧杯外,还需要
(2)将FeCl3溶液滴入沸水可得到红褐色液体,反应的离子方程式是
a.光束通过该液体时形成光亮的“通路”
b.将该液体进行过滤,可得到红褐色固体
c.向该液体中加入AgNO3溶液,无沉淀产生
d.该液体显酸性
(3)“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如溶液中氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强.
①该过程反应的化学方程式为
②人们可利用Fe2(SO4)3作强氧化剂溶解铜矿石(Cu2S),然后加入铁屑进一步得到铜,该过程中发生的离子反应方程式如下,请补充完整并配平:
(4)羟胺(NH2OH)是 一种还原剂,用25.0mL0.49mol/L羟胺有酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.50mL 0.020mol/L的KMnO4酸性溶液反应(反应后MnO4-离子变成Mn2+)。则在上述反应中,羟胺的氧化产物中N的化合价是
您最近半年使用:0次
【推荐3】工业上可用以下方法制备粮食储备的强效熏虫剂 PH3。请回答:
(1)磷原子最外层的电子排布式_______ ;同族元素氢化物 RH3的某种性质随R 的核电荷数的变化趋势如图所示:
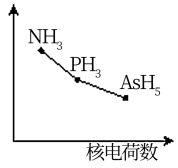
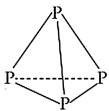
则 Y 轴可表示的氢化物性质可能是_______ ;根据P4的结构,推测其在CS2中的溶解度_______ (填“大于”或“小于”)在水中的溶解度。
(2)配平反应Ⅰ的方程式,并标出电子转移方向和数目______ 。
_______P4+_______NaOH+_______→_______NaH2PO2+_______PH3↑
(3)由工业流程图可以判断H3PO2为_______ (填“一”、“二”或“三”)元酸。
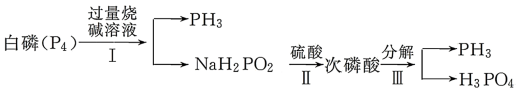
(4)在标准状况下若有 1mol P4参加反应,则整个工业流程中共生成_______ 升 PH3气体(不考虑产物的损失)。
(5)查文献,AlP 遇水蒸气会发生水解反应也产生 PH3,该反应的另一种产物的电离方程式为_______ 。
(1)磷原子最外层的电子排布式

则 Y 轴可表示的氢化物性质可能是

(2)配平反应Ⅰ的方程式,并标出电子转移方向和数目
_______P4+_______NaOH+_______→_______NaH2PO2+_______PH3↑
(3)由工业流程图可以判断H3PO2为
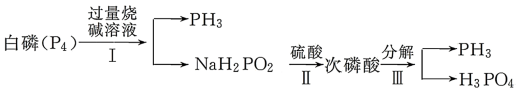
(4)在标准状况下若有 1mol P4参加反应,则整个工业流程中共生成
(5)查文献,AlP 遇水蒸气会发生水解反应也产生 PH3,该反应的另一种产物的电离方程式为
您最近半年使用:0次
填空题
|
适中
(0.65)
【推荐1】根据反应8NH3+3Cl2=6NH4Cl+N2,回答下列问题。
(1)NH3是_____ 剂(填“氧化”或“还原”),在该反应中体现_____ 性(填“氧化”或“还原’);Cl2在该反应中_____ (填”得到“或”失去)电子,发生____ 反应(填“氧化”或“还原”)。
(2)氧化剂与还原剂的分子数之比为_____ 。
(3)当有4个NH3参加反应时,转移的电子个数为____ 。
(4)用双线桥的方法表示该反应的电子转移情况: 8NH3+3Cl2=6NH4Cl+N2____ 。
(5)用单线桥表示此反应中的电子转移情况: 8NH3+3Cl2=6NH4Cl+N2____ 。
(1)NH3是
(2)氧化剂与还原剂的分子数之比为
(3)当有4个NH3参加反应时,转移的电子个数为
(4)用双线桥的方法表示该反应的
(5)用单线桥表示此反应中的
您最近半年使用:0次
【推荐2】(1)配平该反应化学方程式且回答下列问题:__ KMnO4+__ HCl=__ MnCl2+___ KCl+__ Cl2↑+__ H2O
(2)氧化剂是__ ,氧化产物是____ (填化学式)。
(3)若生成71gCl2,被氧化的HCl是__ mol。
(2)氧化剂是
(3)若生成71gCl2,被氧化的HCl是
您最近半年使用:0次
【推荐3】(1)实验室可以用KMnO4制备氯气,反应方程式如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
①该反应的氧化剂是____ ,氧化产物是_____ ,还原产物是____ 。
②当有15.8gKMnO4参加反应时,被氧化的HCl有___ mol,标况下生成Cl2的体积为____ L,有____ mol电子转移。
(2)A的核电荷数为n,A2+和B3-的电子层结构相同,则B原子的质子数是__ 。
(3)在1H216O、2H217O、2H218O、1H35Cl、1H37Cl中,共存在__ 种原子,_ 种元素。
(4)将K(Al2Si3O9)(OH)改写为氧化物形式:____ 。
①该反应的氧化剂是
②当有15.8gKMnO4参加反应时,被氧化的HCl有
(2)A的核电荷数为n,A2+和B3-的电子层结构相同,则B原子的质子数是
(3)在1H216O、2H217O、2H218O、1H35Cl、1H37Cl中,共存在
(4)将K(Al2Si3O9)(OH)改写为氧化物形式:
您最近半年使用:0次



