某炼铜厂湿法炼铜的低铜萃取余液含Co2+、Cu2+、Fe2+、Fe3+、Mn2+、H+、SO ,从该余液中回收金属的工艺流程如图所示。
,从该余液中回收金属的工艺流程如图所示。

已知:室温下,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
回答下列问题:
(1)本流程中多次进行了固液分离,下列仪器中,在实验室进行普通过滤不需要的仪器有______ (填仪器名称)。

(2)“调pH”时,选用CaO浆液代替CaO固体的目的是______ ,调节pH在4.0~4.5,“滤渣I”的成分可能为______ 。
(3)“氧化除Fe、Mn”时,生成MnO2的离子方程式为______ 。
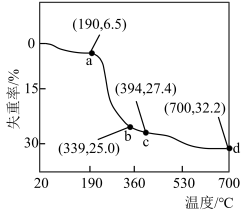
(4)在pH等于7时,进行“沉钴”,生成Co5(CO3)2(OH)6·xH2O的离子方程式为______ 。采用热重分析法测定碱式碳酸钴晶体[Co5(CO3)2(OH)6·xH2O]所含结晶水数,将纯净碱式碳酸钴晶体在空气中加热,加热过程中钴元素无损失,失重率与温度的关系如图所示。已知20~190℃为失去结晶水阶段,则 的值为式为
的值为式为______ ,在 点时剩余固体为氧化物,其化学式为
点时剩余固体为氧化物,其化学式为______ 。
 ,从该余液中回收金属的工艺流程如图所示。
,从该余液中回收金属的工艺流程如图所示。
已知:室温下,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
| 金属离子 | Co2+ | Cu2+ | Fe3+ | Mn2+ |
| 开始沉淀时的pH | 7.8 | 5.5 | 1.8 | 8.3 |
| 完全沉淀时的pH | 9.4 | 6.7 | 2.9 | 10.9 |
(1)本流程中多次进行了固液分离,下列仪器中,在实验室进行普通过滤不需要的仪器有

(2)“调pH”时,选用CaO浆液代替CaO固体的目的是
(3)“氧化除Fe、Mn”时,生成MnO2的离子方程式为
(4)在pH等于7时,进行“沉钴”,生成Co5(CO3)2(OH)6·xH2O的离子方程式为
 的值为式为
的值为式为 点时剩余固体为氧化物,其化学式为
点时剩余固体为氧化物,其化学式为
更新时间:2023-02-10 13:56:24
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】四氯化钛( )极易水解,遇空气中的水蒸气即产生“白烟”,常用作烟幕弹.其熔点为-25℃,沸点为136.4℃.在700℃左右,将氯气通过二氧化钛和炭粉的混合物可生成四氯化钛和一种有毒气体.下图是实验室制备
)极易水解,遇空气中的水蒸气即产生“白烟”,常用作烟幕弹.其熔点为-25℃,沸点为136.4℃.在700℃左右,将氯气通过二氧化钛和炭粉的混合物可生成四氯化钛和一种有毒气体.下图是实验室制备 的部分装置(加热和夹持仪器已略去):
的部分装置(加热和夹持仪器已略去):

(1)仪器b的名称是__________ ,C中反应的化学方程式为________________ .
(2)装置E中碱石灰的作用是____________ .装置F中生成了金属单质和两种酸性物质,装置F中的反应方程式是__________________________________ .
(3)反应结束拆除装置前,除去A中残留氯气的操作是_______________________________ .
(4)利用如图所示装置测定所得 的纯度:取0.4g产品加入烧瓶,向安全漏斗中加入适量蒸馏水,待
的纯度:取0.4g产品加入烧瓶,向安全漏斗中加入适量蒸馏水,待 充分反应后,将烧瓶和安全漏斗中的液体一并转入锥形瓶中,加入含
充分反应后,将烧瓶和安全漏斗中的液体一并转入锥形瓶中,加入含 的溶液,恰好完全反应.
的溶液,恰好完全反应.

①安全漏斗在本实验中的作用除加水外,还有__________________ .
②产品中 的纯度为
的纯度为____________ (用百分数表示).
 )极易水解,遇空气中的水蒸气即产生“白烟”,常用作烟幕弹.其熔点为-25℃,沸点为136.4℃.在700℃左右,将氯气通过二氧化钛和炭粉的混合物可生成四氯化钛和一种有毒气体.下图是实验室制备
)极易水解,遇空气中的水蒸气即产生“白烟”,常用作烟幕弹.其熔点为-25℃,沸点为136.4℃.在700℃左右,将氯气通过二氧化钛和炭粉的混合物可生成四氯化钛和一种有毒气体.下图是实验室制备 的部分装置(加热和夹持仪器已略去):
的部分装置(加热和夹持仪器已略去):
(1)仪器b的名称是
(2)装置E中碱石灰的作用是
(3)反应结束拆除装置前,除去A中残留氯气的操作是
(4)利用如图所示装置测定所得
 的纯度:取0.4g产品加入烧瓶,向安全漏斗中加入适量蒸馏水,待
的纯度:取0.4g产品加入烧瓶,向安全漏斗中加入适量蒸馏水,待 充分反应后,将烧瓶和安全漏斗中的液体一并转入锥形瓶中,加入含
充分反应后,将烧瓶和安全漏斗中的液体一并转入锥形瓶中,加入含 的溶液,恰好完全反应.
的溶液,恰好完全反应.
①安全漏斗在本实验中的作用除加水外,还有
②产品中
 的纯度为
的纯度为
您最近一年使用:0次
【推荐2】化学是人类利用自然资源和应对环境问题的重要科学依据。请回答以下问题:
(1)含硫煤燃烧会产生大气污染物,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示。

请写出该过程中涉及反应的离子方程式:_______ 。
(2)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:

①正(阳)极区发生的电极反应式为_______ 。
②电路中转移1 mol电子需消耗氧气_______ L(在标准状况下)。
(3)开发和利用清洁、高效的新能源已成为人类共同关注的重大课题。
①已知标准状况下11.2 L甲烷完全燃烧生成液态水时放出445 kJ的热量,请写出甲烷燃烧的热化学方程式_______ 。
②煤制合成天然气是煤气化的一种重要方法。其工艺核心是合成过程中的甲烷化。涉及的主要反应有:
反应I CO+3H2⇌CH4+H2O
反应II CO2+4H2⇌CH4+2H2O
在300℃时,容积为2L的密闭容器中进行有关合成天然气实验,相关数据记录如下:
则:a=_______ ;请用CO2表示反应在0~5 min 内的反应速率,v(CO2)=_______ 。
(1)含硫煤燃烧会产生大气污染物,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示。

请写出该过程中涉及反应的离子方程式:
(2)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:

①正(阳)极区发生的电极反应式为
②电路中转移1 mol电子需消耗氧气
(3)开发和利用清洁、高效的新能源已成为人类共同关注的重大课题。
①已知标准状况下11.2 L甲烷完全燃烧生成液态水时放出445 kJ的热量,请写出甲烷燃烧的热化学方程式
②煤制合成天然气是煤气化的一种重要方法。其工艺核心是合成过程中的甲烷化。涉及的主要反应有:
反应I CO+3H2⇌CH4+H2O
反应II CO2+4H2⇌CH4+2H2O
在300℃时,容积为2L的密闭容器中进行有关合成天然气实验,相关数据记录如下:
| CO/mol | CO2/mol | H2/mol | CH4/mol | H2O/mol | |
| 0 min | 4 | 3 | 20 | 0 | 0 |
| 5 min | 2 | 2 | a | 3 | 4 |
则:a=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】以红土镍矿(主要成分为NiO、FeO、Fe2O3、MgO和SiO2等)为原料制备Ni(OH)2的工艺流程如图:
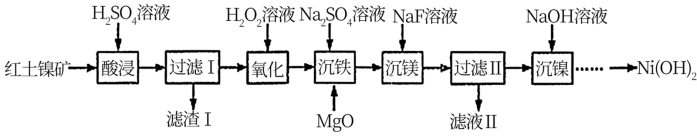
(1)“酸浸”时,加快化学反应速率的措施___ (写一条即可)。滤渣1的成分为___ (填化学式)。
(2)“氧化”时,Fe2+发生反应的离子方程式为___ ,若用NaClO代替H2O2溶液,使0.1molFe2+转化为Fe3+,则需NaClO至少为___ mol。
(3)MgO的作用是调节溶液pH使Fe3+沉淀,根据表中的数据,则调节溶液pH的范围是___ 。
(4)“沉镁”是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是___ 。
(5)“沉镍”后需过滤、洗涤,证明沉淀已洗涤干净的方法是___ 。室温时,若“沉镍”后的滤液c(Ni2+)<1×10-5mol•L-1,则滤液中pH>___ 。(Ksp[Ni(OH)2=1×10-15)

(1)“酸浸”时,加快化学反应速率的措施
(2)“氧化”时,Fe2+发生反应的离子方程式为
(3)MgO的作用是调节溶液pH使Fe3+沉淀,根据表中的数据,则调节溶液pH的范围是
| 金属离子 | Fe2+ | Fe3+ | Mg2+ | Ni2+ |
| 开始沉淀的pH | 6.3 | 1.5 | 8.9 | 6.9 |
| 沉淀完全的pH | 8.3 | 2.8 | 10.9 | 8.9 |
(4)“沉镁”是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是
(5)“沉镍”后需过滤、洗涤,证明沉淀已洗涤干净的方法是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
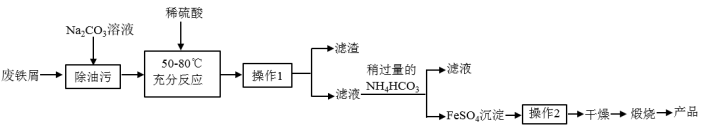
【推荐1】氧化铁是重要的工业颜料,用废铁屑制备它的流程如下:
回答下列问题:
(1)操作1的名称是______ ;操作2的方法为______ 。
(2)生成FeCO3沉淀的同时,还有CO2和H2O生成,写出该反应的离子方程式:______ 。
(3)加入碳酸氢铵后过滤,发现滤液仍然浑浊,可能的原因是______ 。
(4)煅烧时反应的化学方程式为:______ 。
(5)若工业上“灼烧氧化”174.0t FeCO3得到117.6t产品,则该产品中Fe2O3的纯度约为______ (设产品中杂质只有FeO,保留一位小数)。

回答下列问题:
(1)操作1的名称是
(2)生成FeCO3沉淀的同时,还有CO2和H2O生成,写出该反应的离子方程式:
(3)加入碳酸氢铵后过滤,发现滤液仍然浑浊,可能的原因是
(4)煅烧时反应的化学方程式为:
(5)若工业上“灼烧氧化”174.0t FeCO3得到117.6t产品,则该产品中Fe2O3的纯度约为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】海带中含有丰富的碘元素,从海带中提取碘的实验流程如图所示:
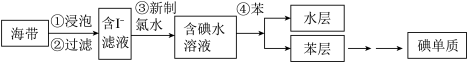
(1)进行步骤②过滤操作时,需要使用的玻璃仪器有_______ 。
(2)写出步骤③所发生反应的离子方程式:_______ 。
(3)步骤④的操作名称是_______ 。该步骤中不能用酒精代替苯的理由是_______ 。
(4)检验提取碘后水层是否仍含碘单质的方法是_______ 。

(1)进行步骤②过滤操作时,需要使用的玻璃仪器有
(2)写出步骤③所发生反应的离子方程式:
(3)步骤④的操作名称是
(4)检验提取碘后水层是否仍含碘单质的方法是
您最近一年使用:0次
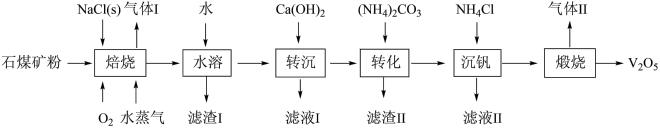
【推荐3】五氧化二钒(V2O5)可用于冶炼钒铁、用作合金添加剂、化工催化剂等。工业上利用石煤矿粉(主要含V2O3及少量Al2O3、SiO2)为原料生产V2O5的工艺流程如下:
①“水溶”、“转沉”、“转化”后,所得含钒物质分别为NaVO3、Ca3(VO4)2、(NH4)3VO4。
②不同pH下,正五价钒在溶液中主要存在形式见下表:
③25℃时,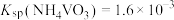 。
。
回答下列问题:
(1)“焙烧”时,V2O3发生反应的化学方程式为_____ 。
(2)“滤渣Ⅰ”的成分为_____ (填化学式,下同),“滤液Ⅰ”中溶质的成分为_____ 。
(3)先“转沉”后“转化”的目的是_____ 。
(4)“滤渣Ⅱ”经高温煅烧后水浸,所得物质可导入到_____ 操作中循环使用。
(5)“沉钒”中析出NH4VO3晶体时,需要加入过量NH4Cl,其原因是_____ (写出两条)。
(6)25℃时,测得“转化”后所得滤液中 ,为使“沉钒”时,钒元素的沉淀率达到98%,应调节溶液中
,为使“沉钒”时,钒元素的沉淀率达到98%,应调节溶液中 至少为
至少为_____  。
。
(7)“煅烧”NH4VO3,制得产品V2O5,但反应体系中,若不及时分离出气体Ⅱ,部分V2O5。会转化成V2O4。已知V2O5转化成V2O4过程中,消耗的氧化剂与还原剂的物质的量之比为3∶2,则V2O5转化成V2O4的化学方程式为_____ 。
①“水溶”、“转沉”、“转化”后,所得含钒物质分别为NaVO3、Ca3(VO4)2、(NH4)3VO4。
②不同pH下,正五价钒在溶液中主要存在形式见下表:
| pH | 4~6 | 6~8 | 8~10 | 10~12 |
| 主要离子 |  |  |  |  |
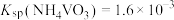 。
。回答下列问题:
(1)“焙烧”时,V2O3发生反应的化学方程式为
(2)“滤渣Ⅰ”的成分为
(3)先“转沉”后“转化”的目的是
(4)“滤渣Ⅱ”经高温煅烧后水浸,所得物质可导入到
(5)“沉钒”中析出NH4VO3晶体时,需要加入过量NH4Cl,其原因是
(6)25℃时,测得“转化”后所得滤液中
 ,为使“沉钒”时,钒元素的沉淀率达到98%,应调节溶液中
,为使“沉钒”时,钒元素的沉淀率达到98%,应调节溶液中 至少为
至少为 。
。(7)“煅烧”NH4VO3,制得产品V2O5,但反应体系中,若不及时分离出气体Ⅱ,部分V2O5。会转化成V2O4。已知V2O5转化成V2O4过程中,消耗的氧化剂与还原剂的物质的量之比为3∶2,则V2O5转化成V2O4的化学方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】实验室以绿矾(FeSO4·7H2O)制备补血剂甘氨酸亚铁[(NH2CH2COO)2Fe],有关物质性质如表所示:实验过程:
Ⅰ.配制含0.10molFeSO4的绿矾溶液。
Ⅱ.制备FeCO3:将配制好的绿矾溶液与200mL1.1mol·L-1NH4HCO3溶液混合,反应结束后过滤并洗涤沉淀。
Ⅲ.制备(NH2CH2COO)2Fe:实验装置如图(夹持和加热仪器已省略),将实验Ⅱ得到的沉淀和含0.20mol甘氨酸的水溶液混合后加入C中,然后利用A中的反应将C中空气排净,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。回答下列问题:

(1)仪器E的名称是__________ 。
(2)实验I中:实验室配制绿矾溶液需要无氧蒸馏水,制备无氧蒸馏水的简易方法是______ 。
(3)确认C中空气排尽的实验现象是__________ 。
(4)加入柠檬酸溶液一方面可调节溶液的pH促进FeCO3溶解,另一个作用是__________ 。
(5)洗涤实验Ⅲ中得到的沉淀,所选用的最佳洗涤试剂是_________ (填序号)。
A.热水 B.乙醇溶液 C.柠檬酸溶液
(6)若产品的质量为17.34g,则产率为________ %。
物质 | 性质 |
| 甘氨酸(NH2CH2COOH) | 易溶于水,微溶于乙醇,两性化合物 |
| 柠檬酸 | 易溶于水和乙醇,有强酸性和还原性 |
| 甘氨酸亚铁 | 易溶于水,难溶于乙醇 |
Ⅱ.制备FeCO3:将配制好的绿矾溶液与200mL1.1mol·L-1NH4HCO3溶液混合,反应结束后过滤并洗涤沉淀。
Ⅲ.制备(NH2CH2COO)2Fe:实验装置如图(夹持和加热仪器已省略),将实验Ⅱ得到的沉淀和含0.20mol甘氨酸的水溶液混合后加入C中,然后利用A中的反应将C中空气排净,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。回答下列问题:

(1)仪器E的名称是
(2)实验I中:实验室配制绿矾溶液需要无氧蒸馏水,制备无氧蒸馏水的简易方法是
(3)确认C中空气排尽的实验现象是
(4)加入柠檬酸溶液一方面可调节溶液的pH促进FeCO3溶解,另一个作用是
(5)洗涤实验Ⅲ中得到的沉淀,所选用的最佳洗涤试剂是
A.热水 B.乙醇溶液 C.柠檬酸溶液
(6)若产品的质量为17.34g,则产率为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】氨基甲酸铵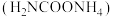 是一种易分解、易水解的白色固体,易溶于水,难溶于
是一种易分解、易水解的白色固体,易溶于水,难溶于 ,某研究小组用如图所示的实验装置制备氨基甲酸铵。
,某研究小组用如图所示的实验装置制备氨基甲酸铵。
反应原理:
实验室可选用下列装置制备氨基甲酸铵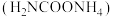 。
。
回答下列问题:

(1)仪器A的名称是___________ ,其中加入的固体可___________ (填名称);按气流方向连接各仪器:a→___________ →j k←___________ ←b(用接口字母表示连接顺序)。
(2)装置Ⅱ的优点是___________ 。
(3)装置Ⅵ中,采用冰水浴的原因为___________ ;当 液体中产生较多晶体悬浮物时即停止反应,
液体中产生较多晶体悬浮物时即停止反应,___________ (填操作名称)得到粗产品。为了将所得粗产品干燥,可采取的方法是___________ (填标号)
A.蒸馏 B.高压加热烘干 C.真空微热烘干
(4)某同学认为这套装置制得的氨基甲酸铵易变质,同时不符合绿色化学理念,改进了装置,具体做法是___________ ,其作用为___________ 。
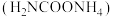 是一种易分解、易水解的白色固体,易溶于水,难溶于
是一种易分解、易水解的白色固体,易溶于水,难溶于 ,某研究小组用如图所示的实验装置制备氨基甲酸铵。
,某研究小组用如图所示的实验装置制备氨基甲酸铵。反应原理:

实验室可选用下列装置制备氨基甲酸铵
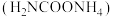 。
。回答下列问题:

(1)仪器A的名称是
(2)装置Ⅱ的优点是
(3)装置Ⅵ中,采用冰水浴的原因为
 液体中产生较多晶体悬浮物时即停止反应,
液体中产生较多晶体悬浮物时即停止反应,A.蒸馏 B.高压加热烘干 C.真空微热烘干
(4)某同学认为这套装置制得的氨基甲酸铵易变质,同时不符合绿色化学理念,改进了装置,具体做法是
您最近一年使用:0次
【推荐3】某工厂废金属屑中主要成分为Cu、Fe和Al(含有少量Al2O3和Fe2O3),某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。

请回答:
(1)胆矾的化学式为___________________ 。
(2)溶液E为绿色溶液,则试剂X是______________ 。
(3)步骤I,首先加入温热NaOH溶液,作用是_________ ;-段时间后,再分批加入常温NaOH溶液,原因是___________ 。
(4)在步骤Ⅱ时,用如图装置制取CO2并通入溶液A中。-段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,可在a和b间加-个盛有饱和_________ 溶液的洗气瓶。

(5)保存FeSO4溶液时,需要滴加少量硫酸溶液,再加入适量_______ (填化学式),防止变质。

请回答:
(1)胆矾的化学式为
(2)溶液E为绿色溶液,则试剂X是
(3)步骤I,首先加入温热NaOH溶液,作用是
(4)在步骤Ⅱ时,用如图装置制取CO2并通入溶液A中。-段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,可在a和b间加-个盛有饱和

(5)保存FeSO4溶液时,需要滴加少量硫酸溶液,再加入适量
您最近一年使用:0次
解答题-有机推断题
|
适中
(0.65)
【推荐1】有机化合物A在生产生活中具有重要的价值,研究其结构及性质具有非常重要的意义。
Ⅰ.测定分子组成
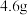 有机化合物A在足量氧气中完全燃烧,生成
有机化合物A在足量氧气中完全燃烧,生成
 和
和
 。
。
(1)该有机化合物的实验式是___________ 。
Ⅱ.确定分子式
该有机化合物的质谱信息如下。

(2)A的相对分子质量是___________ 。
Ⅲ.确定结构简式
有机化合物A的核磁共振氢谱有3组峰,峰面积之比为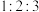 。
。
(3)A的结构简式是___________ 。
Ⅳ.解释性质
(4)有机化合物A能与水互溶的原因是A与水形成分子间氢键。在方框中画出1个A分子中两个不同的原子分别与 形成的氢键(氢键用“∙∙∙”表示)
形成的氢键(氢键用“∙∙∙”表示) _______ 。

Ⅴ.测定某A溶液中A的物质的量浓度(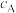 ),步骤如下。
),步骤如下。
①酸性条件下,向
 溶液中加入
溶液中加入
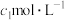
 溶液。A被氧化为B(B比A少2个氢原子,多1个氧原子),
溶液。A被氧化为B(B比A少2个氢原子,多1个氧原子), 被还原为
被还原为 。
。
②充分反应后,向①中加入过量 溶液(
溶液( )。
)。
③向②反应后的溶液中滴加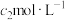
 溶液,达到滴定终点时,消耗的体积为
溶液,达到滴定终点时,消耗的体积为 (
( )。
)。
(5)①中参与反应的A与 的物质的量之比是
的物质的量之比是___________ 。
(6)结合实验数据,得
___________  (用代数式表示)。
(用代数式表示)。
(7)A与B在一定条件下可以发生反应,其化学方程式是___________ 。
Ⅰ.测定分子组成
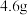 有机化合物A在足量氧气中完全燃烧,生成
有机化合物A在足量氧气中完全燃烧,生成
 和
和
 。
。(1)该有机化合物的实验式是
Ⅱ.确定分子式
该有机化合物的质谱信息如下。

(2)A的相对分子质量是
Ⅲ.确定结构简式
有机化合物A的核磁共振氢谱有3组峰,峰面积之比为
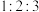 。
。(3)A的结构简式是
Ⅳ.解释性质
(4)有机化合物A能与水互溶的原因是A与水形成分子间氢键。在方框中画出1个A分子中两个不同的原子分别与
 形成的氢键(氢键用“∙∙∙”表示)
形成的氢键(氢键用“∙∙∙”表示) 
Ⅴ.测定某A溶液中A的物质的量浓度(
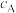 ),步骤如下。
),步骤如下。①酸性条件下,向

 溶液中加入
溶液中加入
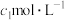
 溶液。A被氧化为B(B比A少2个氢原子,多1个氧原子),
溶液。A被氧化为B(B比A少2个氢原子,多1个氧原子), 被还原为
被还原为 。
。②充分反应后,向①中加入过量
 溶液(
溶液( )。
)。③向②反应后的溶液中滴加
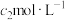
 溶液,达到滴定终点时,消耗的体积为
溶液,达到滴定终点时,消耗的体积为 (
( )。
)。(5)①中参与反应的A与
 的物质的量之比是
的物质的量之比是(6)结合实验数据,得

 (用代数式表示)。
(用代数式表示)。(7)A与B在一定条件下可以发生反应,其化学方程式是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】金属锌和铝的单质及其化合物的化学性质相似。某混合物由A12O3、ZnO、Fe2O3组成,将其分离的工艺流程如下:

回答下列问题:
(1)小苏打的化学式为_______ ,"沉降池”中反应的离子方程式为CO2+OH-= 、
、_____ 、_____ 。
(2)“操作a”为___________ 。
(3)金属m可与“滤渣1”组成铝热试剂,则铝热反应的化学方程式为___________ 。
(4)测定“小苏打溶液”的物质的量浓度。
①稀盐酸配制:取6mol/L的盐酸配制80mL1.5mol/L的稀盐酸,需要用到的最合适的定量仪器及其规格为___________ 。
②物质的量浓度测定:量取25.0mL小苏打溶液置于试管中,逐滴滴加1.5mol/L的稀盐酸,边滴边振荡,直至无气泡产生,消耗稀盐酸10.0mL。“小苏打溶液"的物质的量浓度为___________ 。
③误差分析:用量筒量取6mol/L的盐酸时仰视观察,则测得的“小苏打溶液”的物质的量浓度___________ (填“偏高"“偏低”或“无影响”)。

回答下列问题:
(1)小苏打的化学式为
 、
、(2)“操作a”为
(3)金属m可与“滤渣1”组成铝热试剂,则铝热反应的化学方程式为
(4)测定“小苏打溶液”的物质的量浓度。
①稀盐酸配制:取6mol/L的盐酸配制80mL1.5mol/L的稀盐酸,需要用到的最合适的定量仪器及其规格为
②物质的量浓度测定:量取25.0mL小苏打溶液置于试管中,逐滴滴加1.5mol/L的稀盐酸,边滴边振荡,直至无气泡产生,消耗稀盐酸10.0mL。“小苏打溶液"的物质的量浓度为
③误差分析:用量筒量取6mol/L的盐酸时仰视观察,则测得的“小苏打溶液”的物质的量浓度
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】I、为测定金属钠样品(表面有 Na2O)中钠单质的质量分数,设计了如下实验(反应装置如右图 所示):

①称量 A、B 的总质量
②称取一定质量的钠样品
③将钠样品投入锥形瓶中,迅速塞紧带 U 形干燥管(内含无水 CaCl2干燥 剂)的橡皮塞 有关数据是:称取的金属钠样品质量为 a g,A、B 反应前总质量为 b g,反应后 A、B 的总质量为 c g。 请根据题意回答下列问题:
(1)A 中钠和水反应过程可看到钠熔成闪亮的小球,产生这一现象原因是:_____________
(2)用 a、b、c 表示的钠单质的质量分数为_______________
(3)如果没有 B 装置对实验结果有何影响___________ 。(填“偏大”或“偏小”“不影响”)
II、现用金属钠和空气制备纯度较高的 Na2O2,可利用的装置如下图。回答下列问题:
(提示:Na2O2可以与 H2O、CO2反应)

(4)上述装置Ⅳ中盛放的试剂是_____ ,为完成实验应将装置Ⅳ接在_____ (填写字母号)。
A.I 之前 B. I 和 II 之间 C. II 和 III 之间 D. III 之后
(5)点燃酒精灯后,观察到装置 II 中的现象为_____ 。
(6)装置 II 中 Na 生成 Na2O2的化学反应方程式为_____ 。

①称量 A、B 的总质量
②称取一定质量的钠样品
③将钠样品投入锥形瓶中,迅速塞紧带 U 形干燥管(内含无水 CaCl2干燥 剂)的橡皮塞 有关数据是:称取的金属钠样品质量为 a g,A、B 反应前总质量为 b g,反应后 A、B 的总质量为 c g。 请根据题意回答下列问题:
(1)A 中钠和水反应过程可看到钠熔成闪亮的小球,产生这一现象原因是:
(2)用 a、b、c 表示的钠单质的质量分数为
(3)如果没有 B 装置对实验结果有何影响
II、现用金属钠和空气制备纯度较高的 Na2O2,可利用的装置如下图。回答下列问题:
(提示:Na2O2可以与 H2O、CO2反应)

(4)上述装置Ⅳ中盛放的试剂是
A.I 之前 B. I 和 II 之间 C. II 和 III 之间 D. III 之后
(5)点燃酒精灯后,观察到装置 II 中的现象为
(6)装置 II 中 Na 生成 Na2O2的化学反应方程式为
您最近一年使用:0次



