原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)W原子的核外电子排布式为______ 。
(2)均由X、Y、Z三种元素组成的三种常见物质A、B、C分别属于酸、碱、盐,其化学式依次为______ 、______ 、______ ,推测盐中阴离子的空间构型为______ ,其中心原子杂化方式为______ 。
(3)Z、W两种元素电负性的大小关系为______ ;Y、Z两种元素第一电离能的大小关系为______ 。
(4)CO的结构可表示为C≡O,元素Y的单质Y2的结构也可表示为Y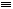 Y。右表是两者的键能数据(单位:kJ·mol-1):
Y。右表是两者的键能数据(单位:kJ·mol-1):
①结合数据说明CO比Y2活泼的原因:______ 。
②意大利罗马大学Fulvio Cacace等人获得了极具研究意义的Y4分子,其结构如图所示,请结合上表数据分析,下列说法中,正确的是______ 。
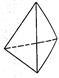
A.Y4为一种新型化合物 B.Y4与Y2互为同素异形体
C.Y4的沸点比P4(白磷)高 D.1 mol Y4气体转变为Y2将放出954.6kJ热量
(1)W原子的核外电子排布式为
(2)均由X、Y、Z三种元素组成的三种常见物质A、B、C分别属于酸、碱、盐,其化学式依次为
(3)Z、W两种元素电负性的大小关系为
(4)CO的结构可表示为C≡O,元素Y的单质Y2的结构也可表示为Y
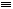 Y。右表是两者的键能数据(单位:kJ·mol-1):
Y。右表是两者的键能数据(单位:kJ·mol-1):| A-B | A=B | A≡B | |
| CO | 357.7 | 798.9 | 1071.9 |
| Y2 | 154.8 | 418.4 | 941.7 |
①结合数据说明CO比Y2活泼的原因:
②意大利罗马大学Fulvio Cacace等人获得了极具研究意义的Y4分子,其结构如图所示,请结合上表数据分析,下列说法中,正确的是

A.Y4为一种新型化合物 B.Y4与Y2互为同素异形体
C.Y4的沸点比P4(白磷)高 D.1 mol Y4气体转变为Y2将放出954.6kJ热量
更新时间:2016-12-09 04:58:32
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】当今,世界多国相继规划了碳达峰、碳中和的时间节点。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。
(1)用CO2合成燃料甲醇(CH3OH)是碳减排的新方向,可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ∆H1=-49.6kJ·mol-1
CH3OH(g)+H2O(g) ∆H1=-49.6kJ·mol-1
反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g) ∆H2=+41.2kJ·mol-1
CO(g)+H2O(g) ∆H2=+41.2kJ·mol-1
反应Ⅲ:CO(g)+2H2(g) CH3OH(g) ∆H3
CH3OH(g) ∆H3
则:反应Ⅲ的∆H3=___________ kJ·mol-1
(2)绝热恒容的条件下,向密闭容器通入CO2和H2进行反应,若只进行反应II:CO2(g)+H2(g) CO(g)+H2O(g),下面能说明反应已达到平衡状态的是___________;
CO(g)+H2O(g),下面能说明反应已达到平衡状态的是___________;
(3)某温度下的密闭容器中,充入1molCO2和3molH2,发生反应Ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。现测得CO2(g)和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g)。现测得CO2(g)和CH3OH(g)的浓度随时间变化如下图所示。
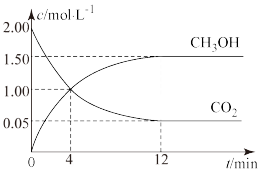
从反应开始到4min时,氢气的平均反应速率v(H2)=___________ ;平衡时,CO2的转化率为___________ 。
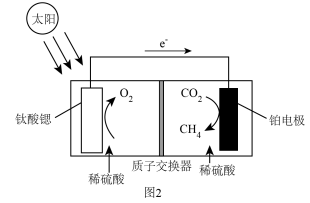
(4)光催化技术具有高效、节能的优点,利用钛酸锶光催化还原CO2有利于实现“碳中和”,其原理如图2所示,写出铂电极的电极反应式___________ 。当有2mol H+___________ (填“从右向左”或“从左向右”)迁移时,电池左侧生成的氧气在标况下的体积为___________ 。
(1)用CO2合成燃料甲醇(CH3OH)是碳减排的新方向,可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ∆H1=-49.6kJ·mol-1
CH3OH(g)+H2O(g) ∆H1=-49.6kJ·mol-1反应Ⅱ:CO2(g)+H2(g)
 CO(g)+H2O(g) ∆H2=+41.2kJ·mol-1
CO(g)+H2O(g) ∆H2=+41.2kJ·mol-1反应Ⅲ:CO(g)+2H2(g)
 CH3OH(g) ∆H3
CH3OH(g) ∆H3则:反应Ⅲ的∆H3=
(2)绝热恒容的条件下,向密闭容器通入CO2和H2进行反应,若只进行反应II:CO2(g)+H2(g)
 CO(g)+H2O(g),下面能说明反应已达到平衡状态的是___________;
CO(g)+H2O(g),下面能说明反应已达到平衡状态的是___________;| A.v(CO)=v(H2O) |
| B.容器内压强不变 |
| C.单位时间内每形成1mol H—H键,同时形成2mol O—H键 |
| D.容器内n(CO)/n(H2O)的值保持不变 |
 CH3OH(g)+H2O(g)。现测得CO2(g)和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g)。现测得CO2(g)和CH3OH(g)的浓度随时间变化如下图所示。
从反应开始到4min时,氢气的平均反应速率v(H2)=
(4)光催化技术具有高效、节能的优点,利用钛酸锶光催化还原CO2有利于实现“碳中和”,其原理如图2所示,写出铂电极的电极反应式

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】在生产生活中氮及其化合物的应用和处理已引起广泛关注。
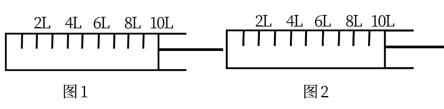
(1)合成氨的反应原理为N2(g)+3H2(g) 2NH3(g) ΔH = -92.4 kJ/mol,如下图所示,将6 mol N2和14 mol H2充入一容积可变的密闭容器中发生反应,反应开始时活塞的位置如图1所示,当反应达到平衡时,活塞位置如图2所示,下列表述能用来判断图2所示状态已达平衡的是
2NH3(g) ΔH = -92.4 kJ/mol,如下图所示,将6 mol N2和14 mol H2充入一容积可变的密闭容器中发生反应,反应开始时活塞的位置如图1所示,当反应达到平衡时,活塞位置如图2所示,下列表述能用来判断图2所示状态已达平衡的是________ ,则该条件下反应的平衡常数为________ 。
A.活塞不再移动 B.容器内气体压强不再改变
C.容器内气体密度不再改变 D.容器内气体的平均分子质量不再改变
(2)研究者通过探索,发现利用反向燃料电池可以在温和的条件下将电解水制氢与氮、氢反应制氨合并(即将电解产生的活性氢作为中间产物直接还原氮气),其工作原理示意图如下:写出阴极电极方程式________ 。
(3)SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+ O2(g)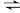 4N2(g)+6H2O(g),
4N2(g)+6H2O(g),
①已知4NH3(g)+ 3O2(g)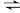 2N2(g)+6H2O(g) ΔH1 = -1269.0 kJ/mol;
2N2(g)+6H2O(g) ΔH1 = -1269.0 kJ/mol;
N2(g)+ O2(g)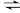 2NO(g) ΔH2 = +180.8 kJ/mol
2NO(g) ΔH2 = +180.8 kJ/mol
则反应4NH3(g)+4NO(g)+ O2(g)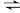 4N2(g)+6H2O(g)的ΔH =
4N2(g)+6H2O(g)的ΔH = ________ 。
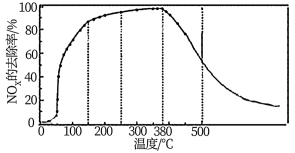
②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应容器中反应10时测得NOx的去除率随反应温度的变化曲线如下图所示,请解释当反应温度高于380℃时NOx的去除率随温度升高先迅速下降后缓慢下降的原因________ 。
③请在下图中画出反应8min时NOx的去除率随温度变化的曲线。___
(1)合成氨的反应原理为N2(g)+3H2(g)
 2NH3(g) ΔH = -92.4 kJ/mol,如下图所示,将6 mol N2和14 mol H2充入一容积可变的密闭容器中发生反应,反应开始时活塞的位置如图1所示,当反应达到平衡时,活塞位置如图2所示,下列表述能用来判断图2所示状态已达平衡的是
2NH3(g) ΔH = -92.4 kJ/mol,如下图所示,将6 mol N2和14 mol H2充入一容积可变的密闭容器中发生反应,反应开始时活塞的位置如图1所示,当反应达到平衡时,活塞位置如图2所示,下列表述能用来判断图2所示状态已达平衡的是
A.活塞不再移动 B.容器内气体压强不再改变
C.容器内气体密度不再改变 D.容器内气体的平均分子质量不再改变
(2)研究者通过探索,发现利用反向燃料电池可以在温和的条件下将电解水制氢与氮、氢反应制氨合并(即将电解产生的活性氢作为中间产物直接还原氮气),其工作原理示意图如下:写出阴极电极方程式

(3)SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+ O2(g)
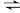 4N2(g)+6H2O(g),
4N2(g)+6H2O(g),①已知4NH3(g)+ 3O2(g)
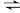 2N2(g)+6H2O(g) ΔH1 = -1269.0 kJ/mol;
2N2(g)+6H2O(g) ΔH1 = -1269.0 kJ/mol;N2(g)+ O2(g)
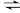 2NO(g) ΔH2 = +180.8 kJ/mol
2NO(g) ΔH2 = +180.8 kJ/mol 则反应4NH3(g)+4NO(g)+ O2(g)
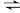 4N2(g)+6H2O(g)的ΔH =
4N2(g)+6H2O(g)的ΔH = ②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应容器中反应10时测得NOx的去除率随反应温度的变化曲线如下图所示,请解释当反应温度高于380℃时NOx的去除率随温度升高先迅速下降后缓慢下降的原因
③请在下图中画出反应8min时NOx的去除率随温度变化的曲线。

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】丙烯是一种重要的化工原料。可由丙烷催化脱氢制备。
主反应:①C3H8(g)=C3H6(g)+H2(g) ΔH1
副反应:②C3H8(g)=C2H4(g)+CH4(g)
③C2H4(g)+H2(g)=C2H6(g)
④C3H8(g)+H2(g)=C2H6(g)+CH4(g)
回答下列问题:
(1)已知:C3H8(g)+ O2(g)=C3H6(g)+H2O(g) ΔH2=-117kJ/mol
O2(g)=C3H6(g)+H2O(g) ΔH2=-117kJ/mol
H2(g)+ O2(g)=H2O(g) ΔH3=-242kJ/mol。反应①的ΔH1=
O2(g)=H2O(g) ΔH3=-242kJ/mol。反应①的ΔH1=___ 。
(2)某温度下,在体积不变的密闭容器内发生反应①,起始总压强为105Pa,平衡时总压增加了20%。则C3H8的转化率为___ ;该反应的平衡常数Kp=___ Pa。若提高C3H8的平衡转化率,可采取的措施有___ (填标号)。
A.增大C3H8的浓度
B.提高温度
C.恒容下通入惰性气体
D.使用高效催化剂
(3)工业生产中常采用恒压下充入高温水蒸气的条件。如图表示常压下反应①C3H8的平衡转化率与温度及水烃比(M)的关系,M2___ 5(填“>”或“<”)。___ 。反应气中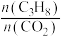 的配比对催化剂活性的影响如表所示。其中C3H6收率最高时
的配比对催化剂活性的影响如表所示。其中C3H6收率最高时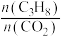 的配比是
的配比是___ 。
主反应:①C3H8(g)=C3H6(g)+H2(g) ΔH1
副反应:②C3H8(g)=C2H4(g)+CH4(g)
③C2H4(g)+H2(g)=C2H6(g)
④C3H8(g)+H2(g)=C2H6(g)+CH4(g)
回答下列问题:
(1)已知:C3H8(g)+
 O2(g)=C3H6(g)+H2O(g) ΔH2=-117kJ/mol
O2(g)=C3H6(g)+H2O(g) ΔH2=-117kJ/molH2(g)+
 O2(g)=H2O(g) ΔH3=-242kJ/mol。反应①的ΔH1=
O2(g)=H2O(g) ΔH3=-242kJ/mol。反应①的ΔH1=(2)某温度下,在体积不变的密闭容器内发生反应①,起始总压强为105Pa,平衡时总压增加了20%。则C3H8的转化率为
A.增大C3H8的浓度
B.提高温度
C.恒容下通入惰性气体
D.使用高效催化剂
(3)工业生产中常采用恒压下充入高温水蒸气的条件。如图表示常压下反应①C3H8的平衡转化率与温度及水烃比(M)的关系,M2
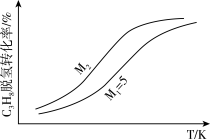
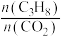 的配比对催化剂活性的影响如表所示。其中C3H6收率最高时
的配比对催化剂活性的影响如表所示。其中C3H6收率最高时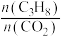 的配比是
的配比是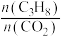 | C3H8转换率(%) | C3H6选择性(%) | C3H6收率(%) |
| 1:1.3 | 14.8 | 85.1 | 12.6 |
| 1:2.4 | 23.2 | 82.8 | |
| 1:3.6 | 22.8 | 83.5 | |
| 1:6.8 | 18.0 | 60.3 | 10.9 |
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】将大气中的氮气活化合成氨是维持地球上生命所必需的转化过程,最近我国成功研制出高效电催化固氮催化剂Mo2N,它的研制成功能有效提高氮肥生产效率。
回答下列问题:
(1)钼(Mo)位于第五周期,与铬同副族,则Mo的价电子排布式为______________ 。
(2)基态氮原子核外电子空间运动状态有____ 种,氮元素所在周期中第一电离能最大的前三种元素依次是____ (按由大到小的顺序写)。
(3)氮元素能形成一系列的化合物,如NH3、HN3(结构式为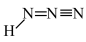 )、H2NCH2COOH等。NH3的分子构型为
)、H2NCH2COOH等。NH3的分子构型为________ ,HN3结构式中间两个氮原子的杂化轨道类型为________ ,1个HN3分子中含______ 个π键;H2NCH2COOH(熔点为182℃)、CH3CH2COOH(熔点为−22℃)的相对分子质量几乎相同,但熔点相差很大,从物质结构的角度分析,导致该现象的主要原因是______ 。
(4)氮与铂元素形成的某种化合物晶胞如图所示,则该化合物的化学式为______ ,若该晶胞的边长为dpm,则晶体的密度为____ g/cm3。
回答下列问题:
(1)钼(Mo)位于第五周期,与铬同副族,则Mo的价电子排布式为
(2)基态氮原子核外电子空间运动状态有
(3)氮元素能形成一系列的化合物,如NH3、HN3(结构式为
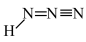 )、H2NCH2COOH等。NH3的分子构型为
)、H2NCH2COOH等。NH3的分子构型为(4)氮与铂元素形成的某种化合物晶胞如图所示,则该化合物的化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】请回答:
(1)路易斯酸碱电子理论认为,凡是能给出电子对的物质叫做碱;凡是能接受电子对的物质叫做酸。则BF3属于_______ (选填“酸”或“碱”),理由是:_______ 。
(2)科学家成功地在高压下将CO2转化为具有类似SiO2的共价晶体,则两种共价晶体的熔点:SiO2_______ CO2(选填“>”或“<”),理由是:_______ 。
(3)金属铯(Cs)位于元素周期表中第六周期第ⅠA族,氯化钠与氯化铯晶体中离子的排列方式如图(a)、(b)所示。造成两种化合物晶体结构不同的原因是_______ 。
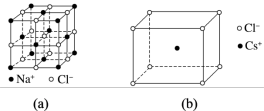
(4)磷化硼晶体的晶胞如图(c)所示。
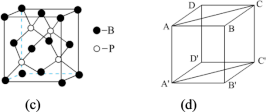
①磷化硼(BP)晶体中“一般共价键”与配位键的数目之比为_______ 。
②根据图(c),图(d)中矩形ACC’A’是沿晶胞对角面取得的截图。晶胞中各原子在矩形ACC’A’的位置为_______ (填标号)。
A. B.
B.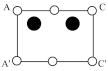 C.
C.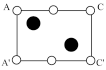 D.
D.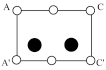
③若最近的B和P的距离为a pm,阿伏加德罗常数的值为NA,晶体的密度为_______ (列出计算表达式,不要求化简)。
(1)路易斯酸碱电子理论认为,凡是能给出电子对的物质叫做碱;凡是能接受电子对的物质叫做酸。则BF3属于
(2)科学家成功地在高压下将CO2转化为具有类似SiO2的共价晶体,则两种共价晶体的熔点:SiO2
(3)金属铯(Cs)位于元素周期表中第六周期第ⅠA族,氯化钠与氯化铯晶体中离子的排列方式如图(a)、(b)所示。造成两种化合物晶体结构不同的原因是

(4)磷化硼晶体的晶胞如图(c)所示。

①磷化硼(BP)晶体中“一般共价键”与配位键的数目之比为
②根据图(c),图(d)中矩形ACC’A’是沿晶胞对角面取得的截图。晶胞中各原子在矩形ACC’A’的位置为
A.
 B.
B. C.
C. D.
D.
③若最近的B和P的距离为a pm,阿伏加德罗常数的值为NA,晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】 在农业上用作高效磷钾复合肥,工业上用作缓冲剂、培养剂、发酵助剂等,其四方晶胞如图(a)所示,图(b)、图(c)分别显示的是
在农业上用作高效磷钾复合肥,工业上用作缓冲剂、培养剂、发酵助剂等,其四方晶胞如图(a)所示,图(b)、图(c)分别显示的是 、
、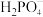 在晶胞xz面、yz面上的位置:
在晶胞xz面、yz面上的位置:
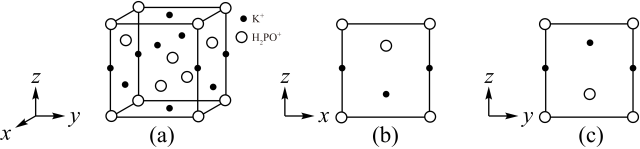
(1)下列关于 的说法正确的是_______。
的说法正确的是_______。
(2)在 中四种组成元素各自所能形成的简单离子中,核外电子排布相同的是
中四种组成元素各自所能形成的简单离子中,核外电子排布相同的是_______ (填离子符号)。
(3)①氧原子最外层有_______ 种运动状态不同的电子。
②氧原子价电子层上的电子可以进行重排以便提供一个空轨道与氮原子形成配位键,该氧原子重排后的价电子排布图为_______ ,电子重排后的氧原子能量有所升高,原因是不符合_______ (填“泡利原理”或“洪特规则”)。
③原子中运动的电子有两种相反的自旋状态,若一种自旋状态用 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态的氧原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的氧原子,其价电子自旋磁量子数的代数和为_______ 。
(4)工业上有多种方法制备 。
。
方法①: ,写出
,写出 的空间构型为
的空间构型为_______ ,与 电子总数相同的等电子体的分子式为
电子总数相同的等电子体的分子式为_______ , 的
的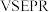 模型名称为
模型名称为_______ 。
方法②:以三乙胺( )、氯化钾、磷酸为原料,生成的
)、氯化钾、磷酸为原料,生成的 以晶体形式析出。1个三乙胺分子中σ键数目为
以晶体形式析出。1个三乙胺分子中σ键数目为_______ 。
(5)① 四方晶胞在x轴方向的投影图为
四方晶胞在x轴方向的投影图为_______ (填字母标号)。
A.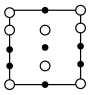 B.
B. 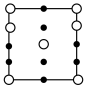 C.
C. 
②若晶胞底边的边长均为anm,高为cnm,阿伏加德罗常数的值为NA,则晶体的密度为_______  (写出表达式)。
(写出表达式)。
 在农业上用作高效磷钾复合肥,工业上用作缓冲剂、培养剂、发酵助剂等,其四方晶胞如图(a)所示,图(b)、图(c)分别显示的是
在农业上用作高效磷钾复合肥,工业上用作缓冲剂、培养剂、发酵助剂等,其四方晶胞如图(a)所示,图(b)、图(c)分别显示的是 、
、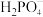 在晶胞xz面、yz面上的位置:
在晶胞xz面、yz面上的位置:
(1)下列关于
 的说法正确的是_______。
的说法正确的是_______。| A.化合物中电负性最大的元素是O |
B.化合物中P的杂化类型为 |
C.化合物中阴阳离子个数比为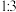 |
D.与P同周期的元素中,第一电离能( )比P原子大的元素有3种 )比P原子大的元素有3种 |
 中四种组成元素各自所能形成的简单离子中,核外电子排布相同的是
中四种组成元素各自所能形成的简单离子中,核外电子排布相同的是(3)①氧原子最外层有
②氧原子价电子层上的电子可以进行重排以便提供一个空轨道与氮原子形成配位键,该氧原子重排后的价电子排布图为
③原子中运动的电子有两种相反的自旋状态,若一种自旋状态用
 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态的氧原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的氧原子,其价电子自旋磁量子数的代数和为(4)工业上有多种方法制备
 。
。方法①:
 ,写出
,写出 的空间构型为
的空间构型为 电子总数相同的等电子体的分子式为
电子总数相同的等电子体的分子式为 的
的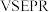 模型名称为
模型名称为方法②:以三乙胺(
 )、氯化钾、磷酸为原料,生成的
)、氯化钾、磷酸为原料,生成的 以晶体形式析出。1个三乙胺分子中σ键数目为
以晶体形式析出。1个三乙胺分子中σ键数目为(5)①
 四方晶胞在x轴方向的投影图为
四方晶胞在x轴方向的投影图为
A.
 B.
B.  C.
C. 
②若晶胞底边的边长均为anm,高为cnm,阿伏加德罗常数的值为NA,则晶体的密度为
 (写出表达式)。
(写出表达式)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】钙钛矿(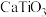 )型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料。回答下列问题:
)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料。回答下列问题:
(1) 的四卤化物熔点如下表所示,
的四卤化物熔点如下表所示, 熔点高于其他三种卤化物,自
熔点高于其他三种卤化物,自 至
至 熔点依次升高,原因是
熔点依次升高,原因是_______ 。
(2)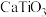 的晶胞如图(a)所示,其组成元素的电负性大小顺序是
的晶胞如图(a)所示,其组成元素的电负性大小顺序是_______ ;金属离子与氧离子间的作用力为_______ , 的配位数是
的配位数是_______ 。
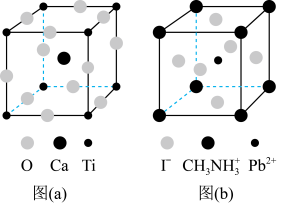
(3)一种立方钙钛矿结构的金属卤化物光电材料的组成为 、
、 和有机碱离子
和有机碱离子 ,其晶胞如图(b)所示。其中
,其晶胞如图(b)所示。其中 与图(a)中
与图(a)中_______ 的空间位置相同,有机碱 中,N原子的杂化轨道类型是
中,N原子的杂化轨道类型是_______ ;若晶胞参数为 ,则晶体密度为
,则晶体密度为_______  (列出计算式)。
(列出计算式)。
 )型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料。回答下列问题:
)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料。回答下列问题:(1)
 的四卤化物熔点如下表所示,
的四卤化物熔点如下表所示, 熔点高于其他三种卤化物,自
熔点高于其他三种卤化物,自 至
至 熔点依次升高,原因是
熔点依次升高,原因是| 化合物 |  |  |  |  |
| 熔点/℃ | 377 | 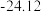 | 38.3 | 155 |
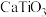 的晶胞如图(a)所示,其组成元素的电负性大小顺序是
的晶胞如图(a)所示,其组成元素的电负性大小顺序是 的配位数是
的配位数是
(3)一种立方钙钛矿结构的金属卤化物光电材料的组成为
 、
、 和有机碱离子
和有机碱离子 ,其晶胞如图(b)所示。其中
,其晶胞如图(b)所示。其中 与图(a)中
与图(a)中 中,N原子的杂化轨道类型是
中,N原子的杂化轨道类型是 ,则晶体密度为
,则晶体密度为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】氮、氧、磷、铁是与生命活动密切相关的元素。回答下列问题:
(1)P的基态原子最外电子层具有的原子轨道数为___ ,Fe3+比Fe2+稳定的原因是_______________ 。
(2)N、O、P三种元素第一电离能最大的是_________ ,电负性最大的是__________ 。
(3)含氮化合物NH4SCN溶液是检验Fe3+的常用试剂,SCN-中C原子的杂化类型为____ ,1mol SCN-中含π键的数目为_____ NA。
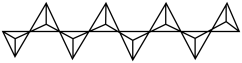
(4)某直链多磷酸钠的阴离子呈如图所示的无极单链状结构,其中磷氧四面体通过共有顶角氧原子相连,则该多磷酸钠的化学式为__________ 。
(5)FeO、NiO的晶体结构均与氯化钠晶体结构相同、其中Fe2+和Ni2+的离子半径分别为7.8×10-2nm、6.9×10-2nm,则熔点FeO___ NiO(填“<”、“>”或“=”)原因是_____________________________ 。
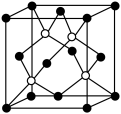
(6)磷化硼是一种超硬耐磨的涂层材料,其晶胞结构如图所示。P原子与B原子的最近距离为acm,则磷化硼晶胞的边长为_____ cm。(用含a的代数式表示)
(1)P的基态原子最外电子层具有的原子轨道数为
(2)N、O、P三种元素第一电离能最大的是
(3)含氮化合物NH4SCN溶液是检验Fe3+的常用试剂,SCN-中C原子的杂化类型为
(4)某直链多磷酸钠的阴离子呈如图所示的无极单链状结构,其中磷氧四面体通过共有顶角氧原子相连,则该多磷酸钠的化学式为

(5)FeO、NiO的晶体结构均与氯化钠晶体结构相同、其中Fe2+和Ni2+的离子半径分别为7.8×10-2nm、6.9×10-2nm,则熔点FeO
(6)磷化硼是一种超硬耐磨的涂层材料,其晶胞结构如图所示。P原子与B原子的最近距离为acm,则磷化硼晶胞的边长为

您最近一年使用:0次
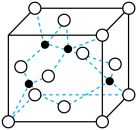
【推荐3】2017年4月26日,海军成立68周年时,我国第一艘国产航母成功下水。建造航母需要大量的新型材料。航母的龙骨要耐冲击,航母的甲板要耐高温,航母的外壳要耐腐蚀。
(1)镍铬钢抗腐蚀性能强,基态铬原子的价电子排布式为___________ ,同一周期中与基态Ni原子有相同的未成对电子数目的原子有___________ 种(填数字)。
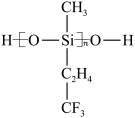
(2)航母甲板涂有一层耐高温的材料聚硅氧烷(结构如图所示)。其O原子杂化方式为___________ 杂化,元素C、O、F、Si的电负性由大到小的顺序为___________ 。
(3)海洋是元素的摇篮,海水中含有大量卤族元素。
①根据下表数据判断:最有可能生成较稳定的单核阳离子的卤素原子是___________ (填元素符号)
②根据价层电子对互斥理论,预测ClO3-的空间构型为___________ 形,写出一个C1O2-的等电子体的化学符号___________ 。
③已知HClO3酸性强于HClO,从结构上分析其原因是___________ 。
(4)海底金属软泥是在洋海底覆盖着的一层红棕色沉积物,蕴藏着大量的资源,含有硅、氧化铁、锰、锌等。Zn2+与S2-形成的一种晶体结构如图所示(黑球表示Zn2+,白球表示S2-)。则该晶胞中六个面心的离子围成的立体图形为___________ 。已知该晶体的密度为ρ g·cm-3,阿伏加德罗常数为NA,该晶体中Zn2+和S2-之间的最短距离为体对角线的 ,则该晶体中S2-和Zn2+之间的最短距离为
,则该晶体中S2-和Zn2+之间的最短距离为___________ nm。(写出计算式即可)
(1)镍铬钢抗腐蚀性能强,基态铬原子的价电子排布式为
(2)航母甲板涂有一层耐高温的材料聚硅氧烷(结构如图所示)。其O原子杂化方式为

(3)海洋是元素的摇篮,海水中含有大量卤族元素。
①根据下表数据判断:最有可能生成较稳定的单核阳离子的卤素原子是
| 元素 | 氟 | 氯 | 溴 | 碘 |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
②根据价层电子对互斥理论,预测ClO3-的空间构型为
③已知HClO3酸性强于HClO,从结构上分析其原因是
(4)海底金属软泥是在洋海底覆盖着的一层红棕色沉积物,蕴藏着大量的资源,含有硅、氧化铁、锰、锌等。Zn2+与S2-形成的一种晶体结构如图所示(黑球表示Zn2+,白球表示S2-)。则该晶胞中六个面心的离子围成的立体图形为
 ,则该晶体中S2-和Zn2+之间的最短距离为
,则该晶体中S2-和Zn2+之间的最短距离为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】2017年5月海底天然气水合物(俗称“可燃冰”)试采成功,这是我国能源开发的一次历史性突破。一定条件下,CH4和CO2都能与H2O形成如图所示的笼状结构(表面的小球是水分子,内部的大球是CH4分子或CO2分子;“可燃冰”是CH4与H2O形成的水合物),其相关参数见下表。
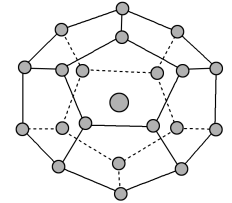
(1)CH4和CO2所含的三种元素电负性从大到小的顺序为_______ ; 碳原子的最高能级的符号是_______ ,其电子云形状是_______ 。
(2)CO2分子中碳原子的杂化轨道类型为_______ , 分子的空间结构为_______ 。 相同条件下,CO2与SO2在水中的溶解度较大的是SO2,理由是_______ 。
(3)为开采海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是_______ 。
(4)“可燃冰”中分子间存在的作用力是氢键和_______ , 上图中最 小的环中连接的原子总数是_______ 。

| 参数分子 | 分子直径/nm | 分子与H2O的结合能E(kJ·mol-1) |
| CH4 | 0.436 | 16.40 |
| CO2 | 0.512 | 29.91 |
(1)CH4和CO2所含的三种元素电负性从大到小的顺序为
(2)CO2分子中碳原子的杂化轨道类型为
(3)为开采海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是
(4)“可燃冰”中分子间存在的作用力是氢键和
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】元素周期表在化学中有举足轻重的地位。请根据提示回答下列问题:
(1)铁在生活生产中用途广泛,写出 Fe 在元素周期表中的位置_______ 。Fe 分别与硫单质和氯气共热,可以得到两种含铁的二元化合物。请问这两种物质中金属阳离子的未成对电子数之比为_______ 。
(2)古往今来,人类发展的脚步离不开青铜器的冶炼,锻造及使用。如今,铜元素依旧为科研人员所钟爱,请写出铜原子的价电子排布式_______ 。利用铜离子作为中心原子可以形成多种具有良好特性的配合物。我们熟知的是一种深蓝色配合物,向硫酸铜溶液中通入过量氨气,可制备这种深蓝色配合物[Cu(NH3)4]2+。请用适当的化学用语描述该反应过程的实质_______ 。写出[Cu(NH3)4]2+配体的电子式_______ 。
(3)I1表示第一电离,I1(Mg)> I1(Al)> I1(Na),原因是_______ 。
(4)CoO 的晶胞如图所示。
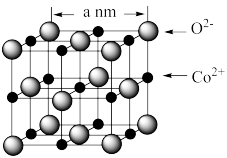
设阿伏加德罗常数的值为 NA,则 CoO 晶体的密度为_______ g﹒cm−3(列出计算式即可)
(5)磷元素在农药的合成中有着重要作用。了解其化合物的结构有助于我们合成新型农药,提高粮食的产量。PO 的 VSEPR 模型为
的 VSEPR 模型为_______ ,其中 P 的杂化轨道类型为_______ 。
(6)配位化学中,硼元素深受研究者的喜爱。其原因在于 B 容易与配体形成配位键,如BF 、B(OH)
、B(OH) 等,从原子结构分析其原因
等,从原子结构分析其原因_______ 。
(7)溶解度、熔沸点、颜色等是每种物质自身特有的性质,但也存在一定的规律。
①水和 H2S 均可以溶于乙醇,但 H2O 在乙醇中的溶解度大于 H2S 的原因_______
a.水和乙醇均为分子晶体 b.水和乙醇分子间可以形成氢键 c.水和乙醇可以发生反应
②比较下列锗卤化物的熔点和沸点,分析其变化规律的原因_______ 。
(1)铁在生活生产中用途广泛,写出 Fe 在元素周期表中的位置
(2)古往今来,人类发展的脚步离不开青铜器的冶炼,锻造及使用。如今,铜元素依旧为科研人员所钟爱,请写出铜原子的价电子排布式
(3)I1表示第一电离,I1(Mg)> I1(Al)> I1(Na),原因是
(4)CoO 的晶胞如图所示。

设阿伏加德罗常数的值为 NA,则 CoO 晶体的密度为
(5)磷元素在农药的合成中有着重要作用。了解其化合物的结构有助于我们合成新型农药,提高粮食的产量。PO
 的 VSEPR 模型为
的 VSEPR 模型为(6)配位化学中,硼元素深受研究者的喜爱。其原因在于 B 容易与配体形成配位键,如BF
 、B(OH)
、B(OH) 等,从原子结构分析其原因
等,从原子结构分析其原因(7)溶解度、熔沸点、颜色等是每种物质自身特有的性质,但也存在一定的规律。
①水和 H2S 均可以溶于乙醇,但 H2O 在乙醇中的溶解度大于 H2S 的原因
a.水和乙醇均为分子晶体 b.水和乙醇分子间可以形成氢键 c.水和乙醇可以发生反应
②比较下列锗卤化物的熔点和沸点,分析其变化规律的原因
| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | −49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约 400 |
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】[化学——选修3:物质结构与性质]
金属钼(Mo)常用于工业、军事等领域,已被多个国家列为战略金属,我国的钼储量居世界第二。已知钼在元素周期表中呈现的信息为

回答下列问题
(1)钼位于元素周期表的位置是__________ ,基态Mo原子核外有_________ 种不同运动状态的电子,其中核外电子占据最高能层的符号是______________ 。
(2)辉钼(MoS2)在纳米电子设备制造领域比硅或富勒烯(如C60)更有优势,可用H2S硫化(NH4)2MoO4溶液生产辉钼。O、N、S的第一电离能由大到小的顺序________________ ,H2S中心原子的杂化轨道类型为____________ 。
(3)MoS2纳米粒子具有类似于石墨的层状结构,具有优异的润滑性能,其原因是_________ 。
(4)Mo能与CO形成Mo(CO)6的配合物,其中Mo的化合价为_________ ,其配体分子与N2具有相似的化学结构,则该配体分子中σ键与π键数目之比为_________ 。
(5)金属钼晶体中的原子堆积方式如图所示,这种堆积方式为_________ 堆积。若晶体钼的密度为ρg·cm-3,钼原子半径为rpm,NA表示阿伏伽德罗常数的值,M表示钼的相对原子质量,则钼晶胞中原子的空间利用率为__________________ (用含有ρ、r、NA、M的代数式表示)。
金属钼(Mo)常用于工业、军事等领域,已被多个国家列为战略金属,我国的钼储量居世界第二。已知钼在元素周期表中呈现的信息为

回答下列问题
(1)钼位于元素周期表的位置是
(2)辉钼(MoS2)在纳米电子设备制造领域比硅或富勒烯(如C60)更有优势,可用H2S硫化(NH4)2MoO4溶液生产辉钼。O、N、S的第一电离能由大到小的顺序
(3)MoS2纳米粒子具有类似于石墨的层状结构,具有优异的润滑性能,其原因是
(4)Mo能与CO形成Mo(CO)6的配合物,其中Mo的化合价为
(5)金属钼晶体中的原子堆积方式如图所示,这种堆积方式为

您最近一年使用:0次



