已知H2CO3、H2S的电离常数如表,判断下列反应能否发生,若能,写出离子方程式。
(1)往Na2S溶液中加入少量NaHCO3溶液:_______ 。
(2)往Na2CO3溶液中加入少量NaHS溶液:_______ 。
(3)往Na2S溶液中通入少量CO2:_______ 。
(4)往Na2S溶液中通入过量CO2:_______ 。
(5)往Na2CO3溶液中通入少量H2S:_______ 。
(6)往Na2CO3溶液中通入过量H2S:_______ 。
| H2CO3 | H2S |
| K1=4.3×10-7,K2=5.6×10-11 | K1=9.1×10-8,K2=1.1×10-12 |
(2)往Na2CO3溶液中加入少量NaHS溶液:
(3)往Na2S溶液中通入少量CO2:
(4)往Na2S溶液中通入过量CO2:
(5)往Na2CO3溶液中通入少量H2S:
(6)往Na2CO3溶液中通入过量H2S:
22-23高二·全国·课时练习 查看更多[1]
(已下线)第三章水溶液中的离子反应与平衡——整体认识
更新时间:2023-03-08 17:53:02
|
【知识点】 弱电解质的电离平衡常数
相似题推荐
填空题
|
较易
(0.85)
【推荐1】完成下列问题
(1)室温下,向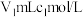 的
的 溶液中逐滴加入
溶液中逐滴加入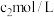 的醋酸至溶液恰好呈中性,消耗醋酸
的醋酸至溶液恰好呈中性,消耗醋酸 ,计算此时醋酸的电离常数
,计算此时醋酸的电离常数
___________ (用含本题中字母的式子表示)。
(2)已知: 时,
时,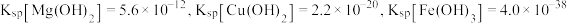 ,
,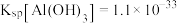 。溶液中某离子物质的量浓度低于
。溶液中某离子物质的量浓度低于 时,可认为已沉淀完全。
时,可认为已沉淀完全。
①在 下,向浓度均为
下,向浓度均为 的
的 和
和 混合溶液中逐滴加入氨水,先生成沉淀的化学式为
混合溶液中逐滴加入氨水,先生成沉淀的化学式为___________ 。
②现向一定浓度的 和
和 的混合溶液中逐滴加入氨水,当
的混合溶液中逐滴加入氨水,当 刚好完全沉淀时,测定
刚好完全沉淀时,测定 。此时所得沉淀中
。此时所得沉淀中___________ ( “还含有”或“不含有”) 。
。
(1)室温下,向
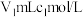 的
的 溶液中逐滴加入
溶液中逐滴加入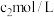 的醋酸至溶液恰好呈中性,消耗醋酸
的醋酸至溶液恰好呈中性,消耗醋酸 ,计算此时醋酸的电离常数
,计算此时醋酸的电离常数
(2)已知:
 时,
时,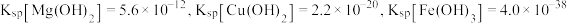 ,
,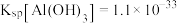 。溶液中某离子物质的量浓度低于
。溶液中某离子物质的量浓度低于 时,可认为已沉淀完全。
时,可认为已沉淀完全。①在
 下,向浓度均为
下,向浓度均为 的
的 和
和 混合溶液中逐滴加入氨水,先生成沉淀的化学式为
混合溶液中逐滴加入氨水,先生成沉淀的化学式为②现向一定浓度的
 和
和 的混合溶液中逐滴加入氨水,当
的混合溶液中逐滴加入氨水,当 刚好完全沉淀时,测定
刚好完全沉淀时,测定 。此时所得沉淀中
。此时所得沉淀中 。
。
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐2】运用化学反应原理,研究硫、磷化合物的反应具有重要意义。
(1)已知H3PO2(次磷酸)的水溶液中存在H3PO2分子。H3PO2与足量NaOH溶液充分反应,消耗的酸和碱的物质的量相等,则生成盐的化学式为_____ ,该盐属于_____ (填“正盐”或“酸式盐”)。H3PO2易被氧化为H3PO4,已知常温下,H3PO4的电离常数为Ka1=6.9×10-3,Ka2=6.2×10-8,Ka3=4.8×10-13,请利用以上数据计算推测Na2HPO4溶液呈_____ 性。
(2)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水的电离平衡_____ (填“向左”“向右”或“不”)移动。试计算该溶液中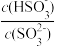 =
=_____ (常温下,H2SO3的电离平衡常数Ka1=1.0×10-2,Ka2=6.0×10-8)。
(3)化工生产中常用FeS作沉淀剂除去工业废水中的Cu2+,其反应原理为Cu2+(aq)+FeS(s) CuS(s)+Fe2+(aq)。下列有关叙述正确的是
CuS(s)+Fe2+(aq)。下列有关叙述正确的是_____ 。
a.Ksp(FeS)<Ksp(CuS)
b.达到平衡时c(Fe2+)=c(Cu2+)
c.溶液中加入少量Na2S固体后,溶液中c(Fe2+)、c(Cu2+)都减小
d.该反应平衡常数K= 。
。
(1)已知H3PO2(次磷酸)的水溶液中存在H3PO2分子。H3PO2与足量NaOH溶液充分反应,消耗的酸和碱的物质的量相等,则生成盐的化学式为
(2)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水的电离平衡
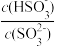 =
=(3)化工生产中常用FeS作沉淀剂除去工业废水中的Cu2+,其反应原理为Cu2+(aq)+FeS(s)
 CuS(s)+Fe2+(aq)。下列有关叙述正确的是
CuS(s)+Fe2+(aq)。下列有关叙述正确的是a.Ksp(FeS)<Ksp(CuS)
b.达到平衡时c(Fe2+)=c(Cu2+)
c.溶液中加入少量Na2S固体后,溶液中c(Fe2+)、c(Cu2+)都减小
d.该反应平衡常数K=
 。
。
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐3】研究电解质在水溶液中的离子反应与平衡有重要的意义。
(1)25℃时,在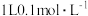 的HA溶液中,有
的HA溶液中,有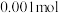 的HA电离成离子,则该温度下的电离平衡常数约为
的HA电离成离子,则该温度下的电离平衡常数约为___________ 。
(2)在25℃时,将pH=11的 溶液
溶液 与pH=2的HCl溶液
与pH=2的HCl溶液 混合,若所得溶液为中性,则
混合,若所得溶液为中性,则 。
。
(3)常温下将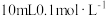 的NaOH溶液与
的NaOH溶液与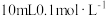 的醋酸溶液混合,则混合后溶液中各离子浓度的大小顺序为
的醋酸溶液混合,则混合后溶液中各离子浓度的大小顺序为___________ 。
(4)常温下,几种弱酸的电离平衡常数如下表所示,回答下列问题:
①上述四种酸酸性由强到弱的顺序为___________ ;
②将少量的 通入
通入 溶液中,反应的离子方程式:
溶液中,反应的离子方程式:___________ 。
(5)已知在25℃时,将浓度相等的HF与NaF溶液等体积混合,溶液呈酸性。解释溶液呈酸性的原因___________ 。
(1)25℃时,在
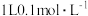 的HA溶液中,有
的HA溶液中,有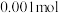 的HA电离成离子,则该温度下的电离平衡常数约为
的HA电离成离子,则该温度下的电离平衡常数约为(2)在25℃时,将pH=11的
 溶液
溶液 与pH=2的HCl溶液
与pH=2的HCl溶液 混合,若所得溶液为中性,则
混合,若所得溶液为中性,则 。
。(3)常温下将
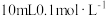 的NaOH溶液与
的NaOH溶液与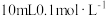 的醋酸溶液混合,则混合后溶液中各离子浓度的大小顺序为
的醋酸溶液混合,则混合后溶液中各离子浓度的大小顺序为(4)常温下,几种弱酸的电离平衡常数如下表所示,回答下列问题:
| 化学式 |  |  |  |  |
| 电离平衡常数 | 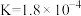 | 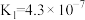 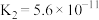 |  | 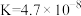 |
②将少量的
 通入
通入 溶液中,反应的离子方程式:
溶液中,反应的离子方程式:(5)已知在25℃时,将浓度相等的HF与NaF溶液等体积混合,溶液呈酸性。解释溶液呈酸性的原因
您最近一年使用:0次



