运用化学反应原理,研究硫、磷化合物的反应具有重要意义。
(1)已知H3PO2(次磷酸)的水溶液中存在H3PO2分子。H3PO2与足量NaOH溶液充分反应,消耗的酸和碱的物质的量相等,则生成盐的化学式为_____ ,该盐属于_____ (填“正盐”或“酸式盐”)。H3PO2易被氧化为H3PO4,已知常温下,H3PO4的电离常数为Ka1=6.9×10-3,Ka2=6.2×10-8,Ka3=4.8×10-13,请利用以上数据计算推测Na2HPO4溶液呈_____ 性。
(2)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水的电离平衡_____ (填“向左”“向右”或“不”)移动。试计算该溶液中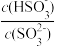 =
=_____ (常温下,H2SO3的电离平衡常数Ka1=1.0×10-2,Ka2=6.0×10-8)。
(3)化工生产中常用FeS作沉淀剂除去工业废水中的Cu2+,其反应原理为Cu2+(aq)+FeS(s) CuS(s)+Fe2+(aq)。下列有关叙述正确的是
CuS(s)+Fe2+(aq)。下列有关叙述正确的是_____ 。
a.Ksp(FeS)<Ksp(CuS)
b.达到平衡时c(Fe2+)=c(Cu2+)
c.溶液中加入少量Na2S固体后,溶液中c(Fe2+)、c(Cu2+)都减小
d.该反应平衡常数K= 。
。
(1)已知H3PO2(次磷酸)的水溶液中存在H3PO2分子。H3PO2与足量NaOH溶液充分反应,消耗的酸和碱的物质的量相等,则生成盐的化学式为
(2)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水的电离平衡
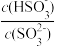 =
=(3)化工生产中常用FeS作沉淀剂除去工业废水中的Cu2+,其反应原理为Cu2+(aq)+FeS(s)
 CuS(s)+Fe2+(aq)。下列有关叙述正确的是
CuS(s)+Fe2+(aq)。下列有关叙述正确的是a.Ksp(FeS)<Ksp(CuS)
b.达到平衡时c(Fe2+)=c(Cu2+)
c.溶液中加入少量Na2S固体后,溶液中c(Fe2+)、c(Cu2+)都减小
d.该反应平衡常数K=
 。
。
更新时间:2024-01-21 16:22:36
|
相似题推荐
填空题
|
较易
(0.85)
名校
解题方法
【推荐1】已知某温度下碳酸的电离常数Ka1=4.3×10−7,Ka2=5.6×10−11,草酸(H2C2O4)的电离常数Ka1=5.9×10−2,Ka2=6.4×10−5.请回答:
(1)相同温度下,0.1mol·L−1Na2CO3溶液的pH___________ (填“大于”、“小于”或“等于”)0.1mol·L−1Na2C2O4溶液的pH。
(2)相同温度下,等浓度的草酸溶液和碳酸溶液中,氢离子浓度较大的是___________ 。若将碳酸钠溶液与等浓度且过量的草酸溶液混合,___________ (填“会”或“不会”)产生气体。
(3)已知①草酸受热易分解②草酸钙为难溶于水的物质。将草酸溶液与足量澄清石灰水混合,反应的离子方程式为___________ ;实验室可利用草酸的受热分解制取CO,反应的化学方程式为___________ 。
(4)实验测得常温下NaHCO3溶液的pH>7,而NaHC2O4溶液的pH<7,可能的原因是___________ 。
(1)相同温度下,0.1mol·L−1Na2CO3溶液的pH
(2)相同温度下,等浓度的草酸溶液和碳酸溶液中,氢离子浓度较大的是
(3)已知①草酸受热易分解②草酸钙为难溶于水的物质。将草酸溶液与足量澄清石灰水混合,反应的离子方程式为
(4)实验测得常温下NaHCO3溶液的pH>7,而NaHC2O4溶液的pH<7,可能的原因是
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐2】某同学查阅资料发现,人体血液里由于存在重要的酸碱平衡:CO2+ H2O H2CO3
H2CO3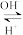 HCO
HCO ,使血液pH范围保持在7.35 ~ 7.45,否则就会发生酸中毒或碱中毒。
,使血液pH范围保持在7.35 ~ 7.45,否则就会发生酸中毒或碱中毒。
(1)人体血液发生酸中毒时,可注射 ___________缓解(填字母)。
(2)已知25°C时,CO 水解反应的平衡常数Kh=2×10 −4 mol∙L−1,当溶液中c (HCO
水解反应的平衡常数Kh=2×10 −4 mol∙L−1,当溶液中c (HCO ):c(CO
):c(CO )=2:1时,溶液的pH=
)=2:1时,溶液的pH=___________ 。
(3)亚砷酸(H3AsO3)可用于治疗白血病,亚砷酸(H3AsO3)在溶液中存在多种微粒形态,各种微粒的物质的量分数与溶液pH关系如下图所示。

①NaH2AsO3溶液呈___________ (填 “酸”、“碱”或“中”)性:写出NaH2AsO3水解的离子方程式___________ 。
②将KOH溶液滴入H3AsO3溶液中,当pH从13调节至14时,所发生反应的离子方程式为___________ 。
③下列说法正确的是___________ (填字母)。
a. H3AsO3的电离平衡常数Ka1∙Ka2= 10a+b
b. H3AsO3溶液中: c(H2AsO ) + 2c(HAsO
) + 2c(HAsO ) + 3c(AsO
) + 3c(AsO ) + c(OH-) = c(H+)
) + c(OH-) = c(H+)
c. K3AsO3溶液中: c(K+)=3c (AsO ) +3c (HAsO
) +3c (HAsO )+3c (H2AsO
)+3c (H2AsO )
)
(4)医学研究表明,砷的化合物会影响人体代谢和免疫功能造成砷中毒。某工业废水中砷含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,向废水中先加入适量漂白粉,再加入生石灰调节pH,将砷元素转化为Ca3(AsO4)2沉淀。则要除去AsO ,溶液中的c(Ca2+)至少为
,溶液中的c(Ca2+)至少为___________ mol∙L−1。
{已知: Ksp[Ca3(AsO4)2]=8 × 10−19 mol5∙L−5,当残留在溶液中的离子浓度≤1 ×10−5 mol∙L−1,可认为沉淀完全}。
 H2CO3
H2CO3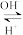 HCO
HCO ,使血液pH范围保持在7.35 ~ 7.45,否则就会发生酸中毒或碱中毒。
,使血液pH范围保持在7.35 ~ 7.45,否则就会发生酸中毒或碱中毒。(1)人体血液发生酸中毒时,可注射 ___________缓解(填字母)。
| A.NaOH溶液 | B.NaHCO3溶液 | C.NaCl溶液 | D.Na2SO4溶液 |
 水解反应的平衡常数Kh=2×10 −4 mol∙L−1,当溶液中c (HCO
水解反应的平衡常数Kh=2×10 −4 mol∙L−1,当溶液中c (HCO ):c(CO
):c(CO )=2:1时,溶液的pH=
)=2:1时,溶液的pH=(3)亚砷酸(H3AsO3)可用于治疗白血病,亚砷酸(H3AsO3)在溶液中存在多种微粒形态,各种微粒的物质的量分数与溶液pH关系如下图所示。

①NaH2AsO3溶液呈
②将KOH溶液滴入H3AsO3溶液中,当pH从13调节至14时,所发生反应的离子方程式为
③下列说法正确的是
a. H3AsO3的电离平衡常数Ka1∙Ka2= 10a+b
b. H3AsO3溶液中: c(H2AsO
 ) + 2c(HAsO
) + 2c(HAsO ) + 3c(AsO
) + 3c(AsO ) + c(OH-) = c(H+)
) + c(OH-) = c(H+)c. K3AsO3溶液中: c(K+)=3c (AsO
 ) +3c (HAsO
) +3c (HAsO )+3c (H2AsO
)+3c (H2AsO )
)(4)医学研究表明,砷的化合物会影响人体代谢和免疫功能造成砷中毒。某工业废水中砷含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,向废水中先加入适量漂白粉,再加入生石灰调节pH,将砷元素转化为Ca3(AsO4)2沉淀。则要除去AsO
 ,溶液中的c(Ca2+)至少为
,溶液中的c(Ca2+)至少为{已知: Ksp[Ca3(AsO4)2]=8 × 10−19 mol5∙L−5,当残留在溶液中的离子浓度≤1 ×10−5 mol∙L−1,可认为沉淀完全}。
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐3】室温下,通过下列实验探究Na2CO3溶液的性质。
依据实验操作和现象,回答下列问题:
(1)向0.1mol/LNa2CO3溶液滴入酚酞溶液,观察到的现象是____ ,原因____ (用离子方程式表示)。
(2)用数据与化学符号表示0.1mol/LNaHCO3溶液中微粒之间的等量关系:c(OH-)=c(H+)+c(H2CO3)-____ ;c(CO )+c(HCO
)+c(HCO )+c(H2CO3)=
)+c(H2CO3)=____ 。
(3)实验2反应的化学方程式为____ ,实验3中随CO2的不断通入,溶液中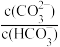
____ (填减小、不变或增大)。
(4)实验4中反应的离子方程式为____ 。
| 实验 | 实验操作和现象 |
| 1 | 用pH试纸测定0.1mol/LNa2CO3溶液的pH,测得pH约为12 |
| 2 | 向0.1mol/LNa2CO3溶液中加入过量0.2mol/LCaCl2溶液,产生白色沉淀 |
| 3 | 向0.1mol/LNa2CO3溶液中通入过量CO2,测得溶液pH约为8 |
| 4 | 向0.1mol/LNa2CO3溶液中滴加几滴0.05mol/LHCl,观察不到实验现象 |
依据实验操作和现象,回答下列问题:
(1)向0.1mol/LNa2CO3溶液滴入酚酞溶液,观察到的现象是
(2)用数据与化学符号表示0.1mol/LNaHCO3溶液中微粒之间的等量关系:c(OH-)=c(H+)+c(H2CO3)-
 )+c(HCO
)+c(HCO )+c(H2CO3)=
)+c(H2CO3)=(3)实验2反应的化学方程式为
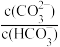
(4)实验4中反应的离子方程式为
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐1】(1)在25℃下,向浓度均为0.1mol·L-1的MgCl2和CuCl2的混合溶液中逐滴加入氨水,先生成_________ 填化学式)沉淀,生成该沉淀的离子方程式为_________________________ 。
已知25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时, =
=_____________ 。[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
已知25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,
 =
=
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐2】下表是不同温度下水的离子积的数据。试回答以下问题:
(1)若 ,则a
,则a_______  (填“>”、“<”或“=”),做此判断的理由是
(填“>”、“<”或“=”),做此判断的理由是_______ 。
(2) 时,某
时,某 溶液中
溶液中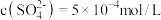 ,取该溶液
,取该溶液 加水稀释至
加水稀释至 ,则稀释后溶液中
,则稀释后溶液中
_______ 。
(3)在 温度下,测得某溶液
温度下,测得某溶液 ,①则该溶液显
,①则该溶液显_______ (填“酸”、“碱”或“中)性;
同样在 温度下
温度下 的
的 溶液
溶液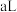 与
与 的
的 溶液
溶液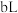 混合:
混合:
②若所得混合液为中性,则
_______ ;
③若所得混合液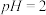 ,则
,则
_______ 。
(4)加热蒸干 溶液并灼烧所得固体,最终得到的产物是
溶液并灼烧所得固体,最终得到的产物是_______ 。
(5)常温下,已知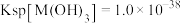 ,要使溶液中的
,要使溶液中的 降至
降至 ,则应调节溶液
,则应调节溶液
_______ 。
(6)已知:a.常温下,醋酸和 的电离平衡常数均为
的电离平衡常数均为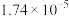 ;
;
b.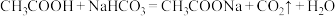 。
。
则 溶液呈
溶液呈_______ 性(填“酸”“碱”或“中”,下同), 溶液呈
溶液呈_______ 性, 溶液中物质的量浓度最大的离子是
溶液中物质的量浓度最大的离子是_______ (填化学式)。
温度/ | 25 |  |  |
| 水的离子积 |  | a | 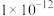 |
 ,则a
,则a (填“>”、“<”或“=”),做此判断的理由是
(填“>”、“<”或“=”),做此判断的理由是(2)
 时,某
时,某 溶液中
溶液中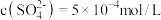 ,取该溶液
,取该溶液 加水稀释至
加水稀释至 ,则稀释后溶液中
,则稀释后溶液中
(3)在
 温度下,测得某溶液
温度下,测得某溶液 ,①则该溶液显
,①则该溶液显同样在
 温度下
温度下 的
的 溶液
溶液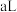 与
与 的
的 溶液
溶液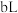 混合:
混合:②若所得混合液为中性,则

③若所得混合液
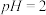 ,则
,则
(4)加热蒸干
 溶液并灼烧所得固体,最终得到的产物是
溶液并灼烧所得固体,最终得到的产物是(5)常温下,已知
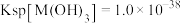 ,要使溶液中的
,要使溶液中的 降至
降至 ,则应调节溶液
,则应调节溶液
(6)已知:a.常温下,醋酸和
 的电离平衡常数均为
的电离平衡常数均为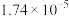 ;
;b.
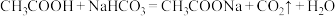 。
。则
 溶液呈
溶液呈 溶液呈
溶液呈 溶液中物质的量浓度最大的离子是
溶液中物质的量浓度最大的离子是
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐1】人体胃液中含有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围内,当胃酸过多时,医生通常用“小苏打片”或“胃舒平”给病人治疗。
(1)用小苏打片(NaHCO3)治疗胃酸过多的离子方程式为_______ 。
(2)如果病人同时患有胃溃疡,最好服用“胃舒平”[主要成分是Al(OH)3],反应的离子方程式为_______ 。
(3)25℃,两种酸的电离平衡常数如表所示。
H2SO3溶液和NaHCO3溶液反应的主要离子方程式为_______ 。
(1)用小苏打片(NaHCO3)治疗胃酸过多的离子方程式为
(2)如果病人同时患有胃溃疡,最好服用“胃舒平”[主要成分是Al(OH)3],反应的离子方程式为
(3)25℃,两种酸的电离平衡常数如表所示。
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】已知 时,HCOOH:
时,HCOOH: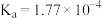 ,HCN:
,HCN: 。
。
(1)相同条件下,等浓度、等体积的HCOOH和HCN,导电性HCOOH_______ HCN,完全中和两溶液所需NaOH的物质的量HCOOH_______ HCN (填>、<或=)。
(2)一定浓度的稀HCN溶液,能使HCN电离程度增大的是_______ ,能使溶液酸性增强的是_______ (以上均填字母代号)
a.滴加少量浓度更大的HCN溶液 b.加水稀释 c.加入少量NaCN固体 d.加入少量NaOH固体
(3)下列反应不能发生的是_______
 时,HCOOH:
时,HCOOH: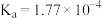 ,HCN:
,HCN: 。
。(1)相同条件下,等浓度、等体积的HCOOH和HCN,导电性HCOOH
(2)一定浓度的稀HCN溶液,能使HCN电离程度增大的是
a.滴加少量浓度更大的HCN溶液 b.加水稀释 c.加入少量NaCN固体 d.加入少量NaOH固体
(3)下列反应不能发生的是_______
A. |
B. |
C.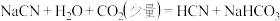 |
D. |
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐3】对于弱酸,在一定温度下达到电离平衡时,各粒子的浓度存在一种定量的关系。若25 ℃时有HA  H++A-,则K=
H++A-,则K= 。式中:K为电离平衡常数,只与温度有关,c为各粒子的平衡浓度。下表是几种常见弱酸的电离平衡常数(25 ℃)。
。式中:K为电离平衡常数,只与温度有关,c为各粒子的平衡浓度。下表是几种常见弱酸的电离平衡常数(25 ℃)。
回答下列各题:
(1)K只与温度有关,当温度升高时,K值___________ (填“增大”“减小”或“不变”)。
(2)在温度相同时,各弱酸的K值不同,且K值越大酸性越___________ ;某酸的K=6.4×10-6,则0.1 mol/L的上述各酸的H+离子浓度比该酸大的有___________ 和___________ (填名称)。
(3)若把CH3COOH、H2CO3、HCO 、H2S、HS-、H3PO4、H2PO
、H2S、HS-、H3PO4、H2PO 、HPO
、HPO 都看作是酸,其中酸性最强的是
都看作是酸,其中酸性最强的是___________ ,最弱的是___________ 。
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律,此规律是___________ ,产生此规律的原因是___________ 。
 H++A-,则K=
H++A-,则K= 。式中:K为电离平衡常数,只与温度有关,c为各粒子的平衡浓度。下表是几种常见弱酸的电离平衡常数(25 ℃)。
。式中:K为电离平衡常数,只与温度有关,c为各粒子的平衡浓度。下表是几种常见弱酸的电离平衡常数(25 ℃)。| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH CH3COO-+H+ CH3COO-+H+ | K=1.76×10-5 |
| H2CO3 | H2CO3 H++HCO H++HCOHCO   H++CO H++CO | K1=4.31×10-7 K2=5.61×10-11 |
| H2S | H2S H++HS- H++HS-HS-  H++S2- H++S2- | K1=9.1×10-8 K2=1.1×10-12 |
| H3PO4 | H3PO4 H++H2PO H++H2PO H2PO   H++HPO H++HPO HPO   H++PO H++PO | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
回答下列各题:
(1)K只与温度有关,当温度升高时,K值
(2)在温度相同时,各弱酸的K值不同,且K值越大酸性越
(3)若把CH3COOH、H2CO3、HCO
 、H2S、HS-、H3PO4、H2PO
、H2S、HS-、H3PO4、H2PO 、HPO
、HPO 都看作是酸,其中酸性最强的是
都看作是酸,其中酸性最强的是(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律,此规律是
您最近一年使用:0次



