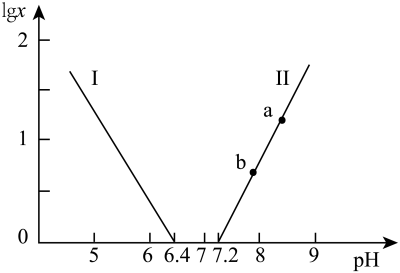
常温下,水溶液中部分缓冲对的微粒浓度之比的对数值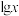 [x表示
[x表示 或
或 ]与溶液pH的关系如图所示。下列说法错误的是
]与溶液pH的关系如图所示。下列说法错误的是
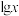 [x表示
[x表示 或
或 ]与溶液pH的关系如图所示。下列说法错误的是
]与溶液pH的关系如图所示。下列说法错误的是
A.曲线Ⅰ表示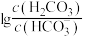 与溶液pH的变化关系 与溶液pH的变化关系 |
B.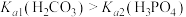 |
| C.a→b的过程中,水的电离程度逐渐减小 |
D.当pH增大时,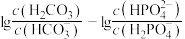 的值逐渐增大 的值逐渐增大 |
2023·辽宁·一模 查看更多[2]
更新时间:2023-03-16 11:16:44
|
相似题推荐
单选题
|
较难
(0.4)
名校
【推荐1】常温下向20mL0.10mol/LCH3COOH溶液中滴加0.10mol/ L NaOH溶液时,混合溶液的pH与相关微粒的浓度关系如图所示。已知:pKa=-lgKa。下列说法不正确的是
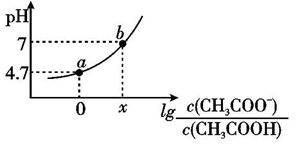

A.CH3COOH溶液中存在如下平衡:CH3COOH H++CH3COO- H++CH3COO- |
| B.b点,加入NaOH溶液的体积小于20mL |
| C.将等物质的量的CH3COOH和CH3 COONa一起溶于蒸馏水中,得到对应a点的溶液 |
| D.常温下,CH3COOH的电离常数为Ka,则pKa=4.7 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐2】如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),向20mL0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液,根据图示判断,下列说法正确的是( )
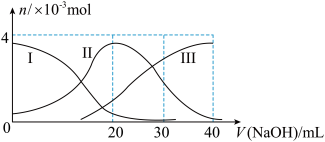

A.H2A在水中的电离方程式是:H2A=H++HA-;HA- H++A2- H++A2- |
| B.当V(NaOH)=20 mL时,溶液中各离子浓度的大小顺序为:c(OH-) >c(H+) |
| C.当V(NaOH)=40 mL时,溶液中水的电离程度比纯水大 |
| D.当V(NaOH)=30 mL时,溶液中存在以下关系:2c(H+)+c(HA-)+2c(H2A)=c(A2-)+2c(OH-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐3】肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知:
①N2(g) + 2O2(g) =2 NO2(g) ΔH = +67.7kJ/mol
②2N2H4(g) + 2NO2(g) =3N2(g) + 4H2O (g) ΔH = -1135.7kJ/mol
下列说法正确的是
①N2(g) + 2O2(g) =2 NO2(g) ΔH = +67.7kJ/mol
②2N2H4(g) + 2NO2(g) =3N2(g) + 4H2O (g) ΔH = -1135.7kJ/mol
下列说法正确的是
| A.N2H4(g) + O2(g) = N2(g) + 2H2O(g)ΔH = -1068 kJ/mol |
| B.肼是与氨类似的弱碱,它易溶于水,其电离方程式:N2H4+ H2O = N2H5++ OH- |
| C.铂做电极,以KOH溶液为电解质溶液的肼——空气燃料电池,放电时的负极反应式:N2H4-4e-+ 4OH-= N2+ 4H2O |
| D.铂做电极,以KOH溶液为电解质溶液的肼——空气燃料电池,工作一段时间后,KOH溶液的pH将增大 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】乙二胺(H2NCH2CH2NH2),无色液体,有类似于氨的性质 ,已知:25℃时,电离常数kb1=10-4.07 kb2=10-7.15;乙二胺溶液中各含氮微粒的分布分数δ(平衡时某含氮微粒的浓度占各含氮微粒浓度之和的分数)随溶液pH的变化曲线如右图。下列说法错误 的是

A.H2NCH2CH2NH2在水溶液中第一步电离的方程式H2NCH2CH2NH2+H2O H2NCH2CH2NH3++OH- H2NCH2CH2NH3++OH- |
| B.曲线Ⅰ代表的微粒符号为[H3NCH2CH2NH3]2+ |
| C.曲线Ⅰ与曲线Ⅱ相交点对应pH=4.07 |
| D.在0.1 mol·L-1 H2NCH2CH2NH3Cl溶液中各离子浓度大小关系为c(Cl-)>c(H2NCH2CH2NH3+)>c(H+)>c(OH-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】常温下, 均为2、体积均为
均为2、体积均为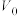 的
的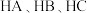 溶液,分别加水稀释至体积为
溶液,分别加水稀释至体积为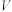 ,溶液
,溶液 随
随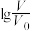 的变化关系如图所示,下列叙述错误的是
的变化关系如图所示,下列叙述错误的是

 均为2、体积均为
均为2、体积均为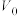 的
的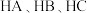 溶液,分别加水稀释至体积为
溶液,分别加水稀释至体积为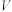 ,溶液
,溶液 随
随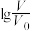 的变化关系如图所示,下列叙述错误的是
的变化关系如图所示,下列叙述错误的是
A.常温下: |
B.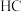 的电离度: 的电离度: 点 点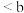 点 点 |
C.当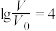 时,三种溶液同时升高温度, 时,三种溶液同时升高温度,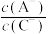 减小 减小 |
D. 点酸的总浓度小于 点酸的总浓度小于 点酸的总浓度 点酸的总浓度 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
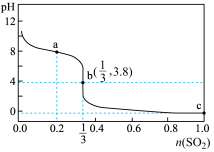
【推荐1】常温下,向1升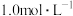 的NaClO溶液中缓慢通入
的NaClO溶液中缓慢通入 气体,使其充分吸收,溶液pH与通入
气体,使其充分吸收,溶液pH与通入 的物质的量关系如图所示(忽略溶液体积变化及NaClO、HClO的分解,以上发生的氧化还原反应均为不可逆反应)。下列说法错误的是
的物质的量关系如图所示(忽略溶液体积变化及NaClO、HClO的分解,以上发生的氧化还原反应均为不可逆反应)。下列说法错误的是
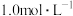 的NaClO溶液中缓慢通入
的NaClO溶液中缓慢通入 气体,使其充分吸收,溶液pH与通入
气体,使其充分吸收,溶液pH与通入 的物质的量关系如图所示(忽略溶液体积变化及NaClO、HClO的分解,以上发生的氧化还原反应均为不可逆反应)。下列说法错误的是
的物质的量关系如图所示(忽略溶液体积变化及NaClO、HClO的分解,以上发生的氧化还原反应均为不可逆反应)。下列说法错误的是
A.常温下,HClO电离平衡常数的数量级为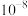 |
B.a点溶液中: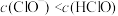 |
C.b点溶液中: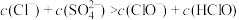 |
D.c点溶液中: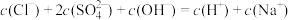 |
您最近一年使用:0次
单选题
|
较难
(0.4)
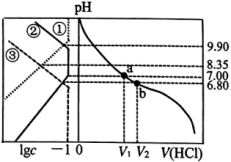
【推荐2】某二胺(H2NRNH2)为二元弱碱,常温下向20mL 0.1mol/L的该二胺溶液中通入HCl气体(溶液体积变化忽略不计),得到的体系中RN2H4、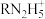 、
、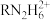 三种粒子的浓度的对数值(lgc)、通入HCl气体的体积与pH关系如图所示。下列说法正确的是
三种粒子的浓度的对数值(lgc)、通入HCl气体的体积与pH关系如图所示。下列说法正确的是
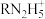 、
、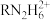 三种粒子的浓度的对数值(lgc)、通入HCl气体的体积与pH关系如图所示。下列说法正确的是
三种粒子的浓度的对数值(lgc)、通入HCl气体的体积与pH关系如图所示。下列说法正确的是
A.①代表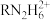 |
B.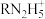 的水解常数的数量级为 的水解常数的数量级为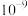 |
C.a点时, |
| D.b点时,通入HCl气体的体积为0.672L(标准状况下) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐3】已知Kb(NH3·H2O)=1.7×10-5,Ka(CH3COOH)=1.7×10-5。25℃时,向20mL浓度均为0.01mol·L-1的盐酸和醋酸的混合溶液中逐滴加入0.01mol·L-1的氨水,测定过程中电导率和pH变化曲线如图所示,下列说法错误的是


| A.a点溶液中,c(CH3COO-)数量级约为10-5 |
| B.b点溶液中,c(NH4+) > c(CH3COOH) |
| C.c点溶液中,c(NH4+) +c(NH3·H2O) = c(Cl-)+c(CH3COO-)+c(CH3COOH) |
| D.c点水的电离程度小于d点 |
您最近一年使用:0次

 、
、 三种溶液,pM[
三种溶液,pM[ ,M表示
,M表示 、
、 或
或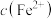 ]随pH变化关系如图所示。下列有关分析不正确的是
]随pH变化关系如图所示。下列有关分析不正确的是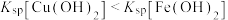 ;②溶液中离子浓度小于
;②溶液中离子浓度小于 可以认为已经除尽。
可以认为已经除尽。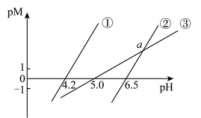
 ,需调整溶液的pH至少为6.7
,需调整溶液的pH至少为6.7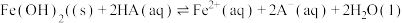 的平衡常数为
的平衡常数为


