研究不同价态硫元素之间的转化是合理利用硫元素的基本途径。
Ⅰ.以下是硫元素形成物质的价类二维图及含硫物质相互转化的部分信息。

(1)G是一种由四种元素组成的钠盐,它的电离方程式是___________ 。
(2)C有毒,实验室可以用过量的NaOH溶液吸收,反应的化学方程式是___________ 。
(3)检验H中阴离子的实验操作及现象是___________ 。
(4)C→F→E是造成酸雨的可能途径,请写出其中的化学方程式___________ 。
Ⅱ.某小组同学设计实验实现几种价态硫元素的转化。可选用的实验药品如下:
Na2SO3溶液②浓硫酸③ 溶液④稀硫酸⑤酸性
溶液④稀硫酸⑤酸性 溶液⑥品红溶液⑦铜片
溶液⑥品红溶液⑦铜片
(5)实验ⅰ选择的试剂是①和___________ (填序号),证明实现转化的现象是___________ ,该转化利用了 的
的___________ 性。
(6)实验ⅱ实现了-2价S向0价S的转化,相应的离子方程式为___________ ,选择试剂③和⑤也能实现-2价S向0价S的转化,相应的离子方程式为___________ 。
(7)实验ⅲ中发生反应的化学方程式是___________ ,证明实现转化的现象是___________ 。
Ⅰ.以下是硫元素形成物质的价类二维图及含硫物质相互转化的部分信息。

(1)G是一种由四种元素组成的钠盐,它的电离方程式是
(2)C有毒,实验室可以用过量的NaOH溶液吸收,反应的化学方程式是
(3)检验H中阴离子的实验操作及现象是
(4)C→F→E是造成酸雨的可能途径,请写出其中的化学方程式
Ⅱ.某小组同学设计实验实现几种价态硫元素的转化。可选用的实验药品如下:
Na2SO3溶液②浓硫酸③
 溶液④稀硫酸⑤酸性
溶液④稀硫酸⑤酸性 溶液⑥品红溶液⑦铜片
溶液⑥品红溶液⑦铜片| 实验序号 | 预期转化 | 选择试剂(填序号) | 证明实现转化的现象 |
| ⅰ |  | ||
| ⅱ | ①、③、④ | 淡黄色沉淀 | |
| ⅲ |  | ②、⑦、⑥ |
 的
的(6)实验ⅱ实现了-2价S向0价S的转化,相应的离子方程式为
(7)实验ⅲ中发生反应的化学方程式是
更新时间:2023-03-15 17:55:29
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】铈的氧化物在半导体材料、高级颜料及汽车尾气的净化器方面有广泛应用。以氟碳酸铈(主要含CeFCO3)为原料制备CeO2的工艺流程如下:

已知:①CeO2具有较强的氧化性,难溶于一般的酸或碱。
②F-能和很多金属离子形成较为稳定的配合物,如Ce4+能与F-结合成CeF3+,Al3+也能与F-结合成AlF ;它的这种性质有利于酸浸步骤,却不利于后续的沉淀步骤。
;它的这种性质有利于酸浸步骤,却不利于后续的沉淀步骤。
③Ce4+能被萃取剂TBP萃取,而Ce3+不能。
回答下列问题:
(1)“氧化焙烧”后的固体产物中含有CeO2和CeF4,CeO2和CeF4的物质的量之比为3:1,“酸浸”时发生反应的离子方程式为_______ 。
(2)“反萃取”步骤中发生反应的离子方程式为_______ 。

已知:①CeO2具有较强的氧化性,难溶于一般的酸或碱。
②F-能和很多金属离子形成较为稳定的配合物,如Ce4+能与F-结合成CeF3+,Al3+也能与F-结合成AlF
 ;它的这种性质有利于酸浸步骤,却不利于后续的沉淀步骤。
;它的这种性质有利于酸浸步骤,却不利于后续的沉淀步骤。③Ce4+能被萃取剂TBP萃取,而Ce3+不能。
回答下列问题:
(1)“氧化焙烧”后的固体产物中含有CeO2和CeF4,CeO2和CeF4的物质的量之比为3:1,“酸浸”时发生反应的离子方程式为
(2)“反萃取”步骤中发生反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】(1)含氮废水是造成水体污染的重要原因之一、研究含氮废水的处理对水体净化有重要意义。利用 O2 和 H2 可高效去除水体中同时存在的 NH 和 NO
和 NO 。
。
具体方法是:先利用氧气将 NH 氧化成 NO
氧化成 NO ,再利用 H2 将 NO
,再利用 H2 将 NO 还原为N2 (2NO
还原为N2 (2NO +5H2
+5H2 N2+2OH-+4H2O)。
N2+2OH-+4H2O)。
①写出 N2 的电子式___________ 。
②利用氧气氧化NH 的反应中氧化剂与还原剂的物质的量之比为
的反应中氧化剂与还原剂的物质的量之比为___________ 。
③若完全处理含 100g 含 NH4NO34%的废水,至少需要标准状况下的 H2___________ L。
④该污水处理的好处是___________ (列举一条即可)
(2)碱性锌锰电池是日常生活中消耗量最大的电池, 其构造如图所示。放电时总反应为 Zn+2H2O+2MnO2=Zn(OH)2+2MnOOH。从废旧碱性锌锰 电池中回收 Zn 和 MnO2 的工艺如图:


回答下列问题:
①“还原焙烧”过程中,高价金属化合物被还原为低价氧化物或金属单质(其中 MnOOH、 MnO2 被还原成 MnO),主要原因是“粉料”中含有___________ (写名称)
②已知有关数据如下表所示,“净化”是为了除去浸出液中的 Fe2+, 操作方法是___________
③ “电解”时,阳极的电极反应式为___________ 。本工艺中应循环利用的物质是___________ (填化学
式)。
 和 NO
和 NO 。
。具体方法是:先利用氧气将 NH
 氧化成 NO
氧化成 NO ,再利用 H2 将 NO
,再利用 H2 将 NO 还原为N2 (2NO
还原为N2 (2NO +5H2
+5H2 N2+2OH-+4H2O)。
N2+2OH-+4H2O)。①写出 N2 的电子式
②利用氧气氧化NH
 的反应中氧化剂与还原剂的物质的量之比为
的反应中氧化剂与还原剂的物质的量之比为③若完全处理含 100g 含 NH4NO34%的废水,至少需要标准状况下的 H2
④该污水处理的好处是
(2)碱性锌锰电池是日常生活中消耗量最大的电池, 其构造如图所示。放电时总反应为 Zn+2H2O+2MnO2=Zn(OH)2+2MnOOH。从废旧碱性锌锰 电池中回收 Zn 和 MnO2 的工艺如图:


回答下列问题:
①“还原焙烧”过程中,高价金属化合物被还原为低价氧化物或金属单质(其中 MnOOH、 MnO2 被还原成 MnO),主要原因是“粉料”中含有
②已知有关数据如下表所示,“净化”是为了除去浸出液中的 Fe2+, 操作方法是
| Zn(OH)2 | Fe(OH)3 | Mn(OH)2 | |
| 开始沉淀的 pH | 5.5 | 1.9 | 8.0 |
| 沉淀完全的 pH | 8.0 | 3.2 | 10.0 |
③ “电解”时,阳极的电极反应式为
式)。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】某同学利用Cl2氧化K2MnO4制备KMnO4的装置如下图所示(夹持装置略):
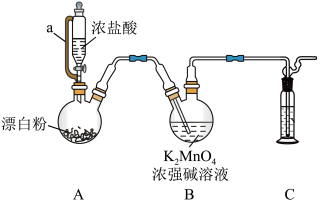
已知:锰酸钾(K2MnO4) 在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:3 + 2H2O = 2
+ 2H2O = 2 + MnO2↓+4OH-
+ MnO2↓+4OH-
回答下列问题:
(1)装置A中a的作用是_______ ;装置 C中的试剂为_______ ;A中制备Cl2的化学方程式为_______ 。
(2)上述装置存在一处缺陷,会导致KMnO4产率降低,原因是_______ 。

已知:锰酸钾(K2MnO4) 在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:3
 + 2H2O = 2
+ 2H2O = 2 + MnO2↓+4OH-
+ MnO2↓+4OH-回答下列问题:
(1)装置A中a的作用是
(2)上述装置存在一处缺陷,会导致KMnO4产率降低,原因是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题:

(1)若A在常温下为固体单质,B是能使品红溶液褪色的有刺激性气味的无色气体。写出B→C的化学方程式__ 。
(2)若A在常温下为气体单质,将装满气体C的试管倒扣在水槽中,溶液最终充满试管容积的 ,另外
,另外 容积为无色气体。D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的离子方程式
容积为无色气体。D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的离子方程式__ 。
(3)若A在常温下为非金属气态氢化物,B遇到空气变成红棕色。写出实验室制取A气体的化学方程式___ 。

(1)若A在常温下为固体单质,B是能使品红溶液褪色的有刺激性气味的无色气体。写出B→C的化学方程式
(2)若A在常温下为气体单质,将装满气体C的试管倒扣在水槽中,溶液最终充满试管容积的
 ,另外
,另外 容积为无色气体。D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的离子方程式
容积为无色气体。D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的离子方程式(3)若A在常温下为非金属气态氢化物,B遇到空气变成红棕色。写出实验室制取A气体的化学方程式
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。

(1)A物质的化学式为___________ ,A与足量NaOH溶液加热条件下反应的离子方程式为___________ 。
(2)当X为强碱时,写出过量B与Cl2反应的化学方程式___________ ,该反应中氧化产物与还原产物的物质的量之比为___________ 。
(3)当X为强碱时,写出铜与F的稀溶液反应的离子方程式___________ 。
(4)当X为强酸时,B与D发生反应的化学方程式为___________ 。

(1)A物质的化学式为
(2)当X为强碱时,写出过量B与Cl2反应的化学方程式
(3)当X为强碱时,写出铜与F的稀溶液反应的离子方程式
(4)当X为强酸时,B与D发生反应的化学方程式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】华北地区雾霾时有发生,这与汽车尾气、工业生产排放的大量有害气体有关。下列反应中,B、C是空气质量监测的物质,其中C是红棕色气体,D是强酸(部分反应条件和产物已略去)。
A →B →C → D
(1)若A是气体单质,则A生成B的化学方程式为___________ 。
(2)若A为气态氢化物且水溶液呈碱性,则A的化学式为___________ ,写出A在生产生活中的一种用途_____________ 。
(3)D的浓溶液与铜反应的化学方程式为____________ ,在此反应中体现了硝酸_______ 性和_______ 性。
A →B →C → D
(1)若A是气体单质,则A生成B的化学方程式为
(2)若A为气态氢化物且水溶液呈碱性,则A的化学式为
(3)D的浓溶液与铜反应的化学方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】化学小组为了证明SO2和Cl2的漂白性,设计了如图所示的实验装置:
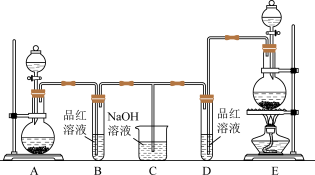
(1)他们制备SO2的反应原理Na2SO3+H2SO4(较浓)=Na2SO4+SO2↑+2H2O,应选用图中A、E装置中的_______ (填序号)制SO2.
(2)他们制取Cl2时使用了浓盐酸,结合另一发生装置的特点,写出他们制Cl2的原理_______ (写化学方程式),并指出反应中浓盐酸所表现出的性质是_______ 、_______ 。
(3)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管中的液体加热,B试管中的现象是_______ 。
(4)NaOH溶液分别与两种气体反应的离子方程式是_______ 、_______ 。
(5)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色。查阅资料得知:两种气体按体积比1:1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的离子方程式是_______ 。

(1)他们制备SO2的反应原理Na2SO3+H2SO4(较浓)=Na2SO4+SO2↑+2H2O,应选用图中A、E装置中的
(2)他们制取Cl2时使用了浓盐酸,结合另一发生装置的特点,写出他们制Cl2的原理
(3)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管中的液体加热,B试管中的现象是
(4)NaOH溶液分别与两种气体反应的离子方程式是
(5)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色。查阅资料得知:两种气体按体积比1:1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的离子方程式是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】无水CuSO4在强热下会发生分解反应:
CuSO4 CuO + SO3↑
CuO + SO3↑
2SO3 2SO2↑+ O2↑
2SO2↑+ O2↑
某研究性学习小组设计了下图所示装置(夹持仪器已略去),利用D管在反应前后的质量差计算分解的无水CuSO4的质量。

实验步骤:
①称量反应前D管的质量。
②连接好装置,关闭K,加热硬质玻璃管A一定时间后,停止加热。
③待硬质玻璃管A冷却后,打开K,通入一段时间的空气。
④再称量D管,得其反应前后的质量差为m。
(1)B管中出现的现象是__________________________________________________ 。
有关离子方程式是__________________________________________________
(2)B管的作用是除去混合气体中的SO3,实验过程中发现B管的温度明显升高,主要原因是______________________
(3)按上述方法实验,假设B、C、D对气体的吸收均完全,并忽略空气中CO2的影响,能否根据m计算分解的无水CuSO4的质量?___________
原因是__________________________________________________________ 。
CuSO4
 CuO + SO3↑
CuO + SO3↑2SO3
 2SO2↑+ O2↑
2SO2↑+ O2↑某研究性学习小组设计了下图所示装置(夹持仪器已略去),利用D管在反应前后的质量差计算分解的无水CuSO4的质量。

实验步骤:
①称量反应前D管的质量。
②连接好装置,关闭K,加热硬质玻璃管A一定时间后,停止加热。
③待硬质玻璃管A冷却后,打开K,通入一段时间的空气。
④再称量D管,得其反应前后的质量差为m。
(1)B管中出现的现象是
有关离子方程式是
(2)B管的作用是除去混合气体中的SO3,实验过程中发现B管的温度明显升高,主要原因是
(3)按上述方法实验,假设B、C、D对气体的吸收均完全,并忽略空气中CO2的影响,能否根据m计算分解的无水CuSO4的质量?
原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】实验室以食盐为原料制备焦亚硫酸钠(Na2S2O5)并测定其纯度,流程如下:
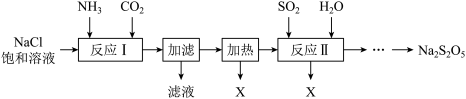
已知:
①Na2SO3+SO2=Na2S2O5,5 +2
+2 +16H+=10CO2↑+2Mn2++8H2O;
+16H+=10CO2↑+2Mn2++8H2O;
②焦亚硫酸钠与强酸接触放出SO2,并生成盐。
(1)反应Ⅰ的化学方程式为__________ ;流程中X的化学式为__________ 。
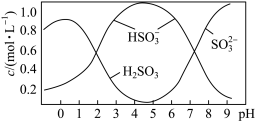
(2)0.5molNa2S2O5溶解于水配成1L溶液,该溶液pH=4.5。
溶液中部分微粒浓度随溶液酸碱性变化如图所示,写出Na2S2O5溶于水时主要反应的离子方程式为__________ 。

已知:
①Na2SO3+SO2=Na2S2O5,5
 +2
+2 +16H+=10CO2↑+2Mn2++8H2O;
+16H+=10CO2↑+2Mn2++8H2O;②焦亚硫酸钠与强酸接触放出SO2,并生成盐。
(1)反应Ⅰ的化学方程式为
(2)0.5molNa2S2O5溶解于水配成1L溶液,该溶液pH=4.5。
溶液中部分微粒浓度随溶液酸碱性变化如图所示,写出Na2S2O5溶于水时主要反应的离子方程式为

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】二氧化硫是污染大气的主要物质之一。含二氧化硫的工业尾气可用如下方法来处理并制得有广泛用途的石膏。

(1)SO2造成的一种常见环境污染为___ ;列举二氧化硫的一种用途___ 。
(2)SO2使紫色KMnO4溶液褪色的离子方程式为___ ;(提示:KMnO4被还原为Mn2+)
(3)通空气时反应的化学方程式为___ ;若在实验室进行,操作A是_____ 。
(4)亚硫酸氢铵常用于造纸工业,若用某气体水溶液处理该工业尾气得到亚硫酸氢铵,则该气体为_______ 。
(5)有人提出在燃煤中加入适量的生石灰,可减少烟气中二氧化硫的排放,你认为是否合理?_______ (填“合理”或“不合理”);理由是______ 。

(1)SO2造成的一种常见环境污染为
(2)SO2使紫色KMnO4溶液褪色的离子方程式为
(3)通空气时反应的化学方程式为
(4)亚硫酸氢铵常用于造纸工业,若用某气体水溶液处理该工业尾气得到亚硫酸氢铵,则该气体为
(5)有人提出在燃煤中加入适量的生石灰,可减少烟气中二氧化硫的排放,你认为是否合理?
您最近一年使用:0次
【推荐2】工业和交通运输业的迅速发展,城市人口的高度集中,机动车数量的日益增多,人类向大气中大量排放烟尘和有害气体等,对大气造成了严重的污染。启东市近期一次的“空气质量日报”显示,启东的空气已受到一定程度的污染。一研究性学习小组对启东市的空气污染情况进行了下列研究。
⑴小组一同学初步分析得出,启东市空气污染的主要原因可能有如下三种:
A、使用石油液化气 B、燃烧含硫煤 C、粉尘污染
另一同学认为还有一个不可排除的原因是:D:__________________________________
研究性学习小组就造成启东市空气污染的最主要原因调查了本市100名市民和100位环保部门人士。调查结果如下图所示:
空气污染原因调查人数分布图
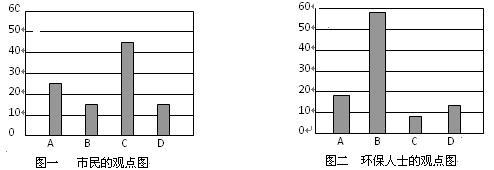
从市民和环保人士的不同观点上分析,你认为造成启东市空气污染的主要有害成分是
___________________ (用化学式表示)
⑵空气污染形成酸雨。研究性学习小组对启东市的雨水进行了采样和分析,刚采集时测得PH为4.82,放在烧杯中经2小时后,再次测得PH为4.68,较长一段时间后发现PH不再变化,对此,你的合理解释是_________________________________________
⑶研究性学习小组取相当于标准状况下的空气1.000L(含氮气、氧气、二氧化碳、二氧化硫等),缓慢通过足量溴水,在所得溶液中加入过量的氯化钡溶液,产生白色沉淀,将沉淀洗涤,干燥,称得其质量为0.233g,进行这一实验的目的是__________________ ,通过计算得到的结论是__________________________________________ (以定量描述)
⑷该小组提出下列措施以减少空气污染主要有害成分排放量,你认为合理的是_____
(填序号)
①用天然气代替煤炭作民用燃料 ②改进燃烧技术,提高煤的燃烧效率
③工厂生产时将燃煤锅炉的烟囱造得更高 ④燃煤中加入适量石灰石后使用
⑴小组一同学初步分析得出,启东市空气污染的主要原因可能有如下三种:
A、使用石油液化气 B、燃烧含硫煤 C、粉尘污染
另一同学认为还有一个不可排除的原因是:D:
研究性学习小组就造成启东市空气污染的最主要原因调查了本市100名市民和100位环保部门人士。调查结果如下图所示:
空气污染原因调查人数分布图

从市民和环保人士的不同观点上分析,你认为造成启东市空气污染的主要有害成分是
⑵空气污染形成酸雨。研究性学习小组对启东市的雨水进行了采样和分析,刚采集时测得PH为4.82,放在烧杯中经2小时后,再次测得PH为4.68,较长一段时间后发现PH不再变化,对此,你的合理解释是
⑶研究性学习小组取相当于标准状况下的空气1.000L(含氮气、氧气、二氧化碳、二氧化硫等),缓慢通过足量溴水,在所得溶液中加入过量的氯化钡溶液,产生白色沉淀,将沉淀洗涤,干燥,称得其质量为0.233g,进行这一实验的目的是
⑷该小组提出下列措施以减少空气污染主要有害成分排放量,你认为合理的是
(填序号)
①用天然气代替煤炭作民用燃料 ②改进燃烧技术,提高煤的燃烧效率
③工厂生产时将燃煤锅炉的烟囱造得更高 ④燃煤中加入适量石灰石后使用
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】研究大气中含硫化合物(主要是SO2和H2S)的转化对环境保护具有重要意义.
(1)SO2的大量排放会引起严重的环境问题是________ ,潮湿条件下,写出大气中SO2转化为H2SO4的方程式________________________________ .
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42﹣,两步反应的能量变化如图:1mol H2S(g)全部氧化成SO42﹣(aq)的热化学方程式为________________________________________

(3)利用H2S废气制取氢气的方法有多种,比如图的电化学法:

①该法制氢过程如图,反应池中反应物的流向采用气、液逆流方式,其目的是_________ ;
②反应池中发生反应的化学方程式为_______________________ ;
③反应后的溶液进入电解池,产生氢气的电极名称为_________ ,电解反应的离子方程式为___________________ 。
(1)SO2的大量排放会引起严重的环境问题是
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42﹣,两步反应的能量变化如图:1mol H2S(g)全部氧化成SO42﹣(aq)的热化学方程式为

(3)利用H2S废气制取氢气的方法有多种,比如图的电化学法:

①该法制氢过程如图,反应池中反应物的流向采用气、液逆流方式,其目的是
②反应池中发生反应的化学方程式为
③反应后的溶液进入电解池,产生氢气的电极名称为
您最近一年使用:0次



