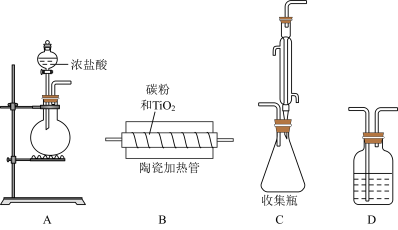
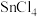我国自主开发的“钛战甲”是一种钛合金材料,为深潜万米的“奋斗者”号建造了世界最大、搭载人数最多的潜水器载人舱球壳。TiCl4是制备钛及其化合物的重要中间体,可利用下列装置在实验室制备TiCl4(夹持装置略去):
已知:
①TiO2+2C+2Cl2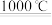 TiCl4+2CO
TiCl4+2CO
②TiCl4为无色或淡黄色液体,熔点为-30℃,沸点为136.4℃,极易与水反应
③PdCl2的盐酸溶液可吸收CO而生成黑色颗粒Pd
回答下列问题:
(1)盛放浓盐酸的仪器名称为______ ,圆底烧瓶内所装试剂可为______ (填编号)。
①MnO2 ②KMnO4 ③浓H2SO4
写出其中发生的离子反应方程式______ 。
(2)装置的连接顺序为______ (D装置可重复使用)。
(3)对于实验过程的控制,开始的操作为______ (填①或②),实验结束的操作为_____ (填③或④)。
①先打开分液漏斗活塞,一段时间后,再陶瓷管通电加热
②先陶瓷管通电加热,一段时间后,再打开分液漏斗活塞
③先陶瓷管断电停止加热,一段时间后,再关闭分液漏斗活塞
④先关闭分液漏斗活塞,一段时间后,再陶瓷管断电停止加热
(4)装置C左边进气的细长导管作用为______ 。
(5)吸收尾气中CO的的化学方程式_____ 。
(6)所得的TiCl4可用Mg制Ti,该过程可在______ 气氛围保护下进行 (填编号) 。
①氮气 ②氧气 ③水蒸气 ④氩气

已知:
①TiO2+2C+2Cl2
 TiCl4+2CO
TiCl4+2CO②TiCl4为无色或淡黄色液体,熔点为-30℃,沸点为136.4℃,极易与水反应
③PdCl2的盐酸溶液可吸收CO而生成黑色颗粒Pd
回答下列问题:
(1)盛放浓盐酸的仪器名称为
①MnO2 ②KMnO4 ③浓H2SO4
写出其中发生的离子反应方程式
(2)装置的连接顺序为
(3)对于实验过程的控制,开始的操作为
①先打开分液漏斗活塞,一段时间后,再陶瓷管通电加热
②先陶瓷管通电加热,一段时间后,再打开分液漏斗活塞
③先陶瓷管断电停止加热,一段时间后,再关闭分液漏斗活塞
④先关闭分液漏斗活塞,一段时间后,再陶瓷管断电停止加热
(4)装置C左边进气的细长导管作用为
(5)吸收尾气中CO的的化学方程式
(6)所得的TiCl4可用Mg制Ti,该过程可在
①氮气 ②氧气 ③水蒸气 ④氩气
更新时间:2023-03-29 16:52:33
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】锌盐在化工、医药、电镀等方面都有重要应用。以硫化锌精矿为原料,选择在常压下,采用氧化-酸浸法进行实验生产的工艺如图所示。
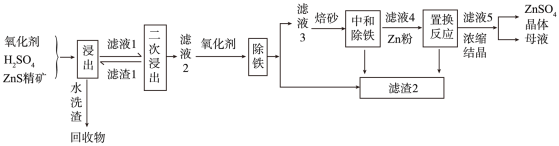
已知:①浸出液杂质离子主要是Fe2+、Fe3+,还含有少量的Cu2+、Ni2+等;
②pH=1.5时,除铁的化学方程式为3Fe2(SO4)3+K2SO4+12H2O=2KFe3(SO4)2(OH)6↓+6H2SO4;
③25℃时,Ksp[Fe(OH)3]=3×10-39。
回答下列问题:
(1)浸出时,选用氧化-酸浸法而不直接选用酸浸法的优点是_______ ,氧化剂在稀硫酸介质中对硫化锌精矿进行浸取时所涉及的化学反应机理较为复杂,若氧化剂为稀硝酸时氧化产物为单质S,则发生反应的离子方程式为_______ 。
(2)温度对硫化锌精矿的浸出率有重要的影响,从室温到100°C范围内,温度对硫化锌精矿的浸出率的影响结果如图所示:
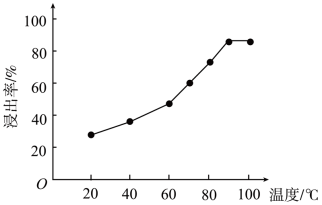
随浸出温度的升高,硫化锌精矿的浸出率显著提高的原因是_______ ;实际工业生产选用的合适温度为_______ 左右。
(3)若氧化剂为H2O2,用离子方程式解释除铁之前需要加入氧化剂的目的:_______ 。测定除铁后的滤液中c(Fe3+)为0.003mol·L-1,则此时溶液的pH=_______ 。
(4)除铁后再进一步调节pH=4左右,使其完全水解形成Fe(OH)3沉淀,即可达到除铁要求,不在除铁之前调节pH=4的原因是_______ 。
(5)加入Zn的目的是_______ 。

已知:①浸出液杂质离子主要是Fe2+、Fe3+,还含有少量的Cu2+、Ni2+等;
②pH=1.5时,除铁的化学方程式为3Fe2(SO4)3+K2SO4+12H2O=2KFe3(SO4)2(OH)6↓+6H2SO4;
③25℃时,Ksp[Fe(OH)3]=3×10-39。
回答下列问题:
(1)浸出时,选用氧化-酸浸法而不直接选用酸浸法的优点是
(2)温度对硫化锌精矿的浸出率有重要的影响,从室温到100°C范围内,温度对硫化锌精矿的浸出率的影响结果如图所示:

随浸出温度的升高,硫化锌精矿的浸出率显著提高的原因是
(3)若氧化剂为H2O2,用离子方程式解释除铁之前需要加入氧化剂的目的:
(4)除铁后再进一步调节pH=4左右,使其完全水解形成Fe(OH)3沉淀,即可达到除铁要求,不在除铁之前调节pH=4的原因是
(5)加入Zn的目的是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】孔雀石主要成分是 ,还含少量
,还含少量 及硅的氧化物,实验室以孔雀石为原料制备硫酸铜晶体的步骤如下:
及硅的氧化物,实验室以孔雀石为原料制备硫酸铜晶体的步骤如下:

有关物质沉淀的pH数据如下:
(1)步骤Ⅰ加稀硫酸充分反应,提高步骤Ⅰ反应速率的措施是_______ (写一条即可)。
(2)步骤Ⅱ中试剂①应选用试剂_______ (填代号)。
a. b.稀
b.稀 c.双氧水 d.氯水
c.双氧水 d.氯水
相关反应的离子方程式为:_______ 。
(3)步骤Ⅲ加入CuO调节溶液的pH至_______ (填写范围),目的是_______ 。
(4)从滤液3中获得干燥的硫酸铜晶体的操作是_______ 。
(5)常温下 的
的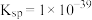 ,若要将溶液中的
,若要将溶液中的 转化为
转化为 沉淀,使溶液中
沉淀,使溶液中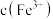 降低至
降低至 ,必须将溶液调节至
,必须将溶液调节至
_______ 。
(6)用 和孔雀石反应可以制得金属铜,已知1mol氨气通过灼热的
和孔雀石反应可以制得金属铜,已知1mol氨气通过灼热的 可以产生
可以产生 金属铜,则该反应的化学方程式为
金属铜,则该反应的化学方程式为_______ 。
 ,还含少量
,还含少量 及硅的氧化物,实验室以孔雀石为原料制备硫酸铜晶体的步骤如下:
及硅的氧化物,实验室以孔雀石为原料制备硫酸铜晶体的步骤如下:
有关物质沉淀的pH数据如下:
| 物质 |  开始沉淀 开始沉淀 |  完全沉淀 完全沉淀 |
 | 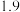 |  |
 | 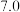 |  |
 |  | 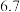 |
(1)步骤Ⅰ加稀硫酸充分反应,提高步骤Ⅰ反应速率的措施是
(2)步骤Ⅱ中试剂①应选用试剂
a.
 b.稀
b.稀 c.双氧水 d.氯水
c.双氧水 d.氯水相关反应的离子方程式为:
(3)步骤Ⅲ加入CuO调节溶液的pH至
(4)从滤液3中获得干燥的硫酸铜晶体的操作是
(5)常温下
 的
的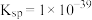 ,若要将溶液中的
,若要将溶液中的 转化为
转化为 沉淀,使溶液中
沉淀,使溶液中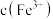 降低至
降低至 ,必须将溶液调节至
,必须将溶液调节至
(6)用
 和孔雀石反应可以制得金属铜,已知1mol氨气通过灼热的
和孔雀石反应可以制得金属铜,已知1mol氨气通过灼热的 可以产生
可以产生 金属铜,则该反应的化学方程式为
金属铜,则该反应的化学方程式为
您最近一年使用:0次
【推荐3】锑(Sb)及其化合物在工业上有许多用途。以辉锑矿(主要成分为Sb2S3,还含有PbS、As2S3、CuO、SiO2等)为原料制备金属锑的工艺流程如图所示:
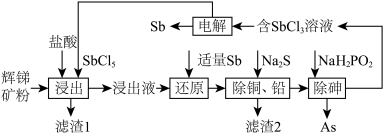
已知:① 浸出液中除含过量盐酸和SbCl5之外,还含有SbCl3、PbCl2、AsCl3、CuCl2等;
②常温下:Ksp(CuS)=1.27×10-36,Ksp(PbS)=9.04×10-29;
③溶液中离子浓度小于或等于1.0×10-5mol/L时,认为该离子沉淀完全。
(1)滤渣1中除了S之外,还有___________ (填化学式)。
(2)“浸出”时,Sb2S3发生反应的化学方程式为_________ 。
(3)该生产流程能实现(填化学式)的循环利用__________ 。
(4)常温下,“除铜、铅”时,Cu2+和Pb2+均沉淀完全,此时溶液中的c(S2-)不低于______ 。
(5)“电解”时,被氧化的Sb元素与被还原的Sb元素的质量之比为_______ 。

已知:① 浸出液中除含过量盐酸和SbCl5之外,还含有SbCl3、PbCl2、AsCl3、CuCl2等;
②常温下:Ksp(CuS)=1.27×10-36,Ksp(PbS)=9.04×10-29;
③溶液中离子浓度小于或等于1.0×10-5mol/L时,认为该离子沉淀完全。
(1)滤渣1中除了S之外,还有
(2)“浸出”时,Sb2S3发生反应的化学方程式为
(3)该生产流程能实现(填化学式)的循环利用
(4)常温下,“除铜、铅”时,Cu2+和Pb2+均沉淀完全,此时溶液中的c(S2-)不低于
(5)“电解”时,被氧化的Sb元素与被还原的Sb元素的质量之比为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】实验室利用下图装置制备 ,并探究其性质。据图回答下列问题;
,并探究其性质。据图回答下列问题;

(1)盛放浓盐酸的仪器名称是_______ ,A中发生反应的离子方程式为_______ 。
(2)B中盛放的试剂是_______ ,其作用是_______ 。
(3)制备 的反应是放热反应,反应温度较高时有副反应友生,改进该实验装置以减少副反应发生的方法是
的反应是放热反应,反应温度较高时有副反应友生,改进该实验装置以减少副反应发生的方法是_______ 。
(4)E的作用是_______ ,下列不能代替E中 溶液的是
溶液的是_______ (填一个合理答案标号)。
A. 溶液 B.
溶液 B. 溶液 C.
溶液 C. 溶液 D.
溶液 D. 溶液
溶液
(5)在一支试管中依次加入氢氧化铁颗粒和氢氧化钾溶液,再加入 溶液,有紫红色的高铁酸钾
溶液,有紫红色的高铁酸钾 生成,由此可知
生成,由此可知 具有
具有_______ 性(填“氧化”或“还原”),完成并配平该反应的离子方程式:_______ 。
(6)该小组同学将制得的氯气配制成氯水,以探究 的还原性。进行了如下实验:取一定量的
的还原性。进行了如下实验:取一定量的 溶液,向其中滴加少量新制氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
溶液,向其中滴加少量新制氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1: 被
被 氧化
氧化
假设2: 被
被 氧化
氧化
请你完成下表,验证假设。
 ,并探究其性质。据图回答下列问题;
,并探究其性质。据图回答下列问题;
(1)盛放浓盐酸的仪器名称是
(2)B中盛放的试剂是
(3)制备
 的反应是放热反应,反应温度较高时有副反应友生,改进该实验装置以减少副反应发生的方法是
的反应是放热反应,反应温度较高时有副反应友生,改进该实验装置以减少副反应发生的方法是(4)E的作用是
 溶液的是
溶液的是A.
 溶液 B.
溶液 B. 溶液 C.
溶液 C. 溶液 D.
溶液 D. 溶液
溶液(5)在一支试管中依次加入氢氧化铁颗粒和氢氧化钾溶液,再加入
 溶液,有紫红色的高铁酸钾
溶液,有紫红色的高铁酸钾 生成,由此可知
生成,由此可知 具有
具有(6)该小组同学将制得的氯气配制成氯水,以探究
 的还原性。进行了如下实验:取一定量的
的还原性。进行了如下实验:取一定量的 溶液,向其中滴加少量新制氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
溶液,向其中滴加少量新制氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:假设1:
 被
被 氧化
氧化假设2:
 被
被 氧化
氧化请你完成下表,验证假设。
| 实验步骤 | 预期现象 | 结论 |
| ①取少量黄色溶液于试管中,滴加几滴 | 假设1正确 | |
| ②取少量黄色溶液于试管中,滴加几滴 | 假设2正确 |
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】无水四氯化锡( )用于制作FTO导电玻璃,FTO玻璃广泛用于液晶显示屏、光催化、薄膜太阳能电池基底等;军事上四氯化锡蒸气与
)用于制作FTO导电玻璃,FTO玻璃广泛用于液晶显示屏、光催化、薄膜太阳能电池基底等;军事上四氯化锡蒸气与 及水汽混合呈浓烟状,可制作烟幕弹。实验室可用熔融的金属锡与干燥氯气利用图装置制备四氯化锡。有关信息如下表:
及水汽混合呈浓烟状,可制作烟幕弹。实验室可用熔融的金属锡与干燥氯气利用图装置制备四氯化锡。有关信息如下表:
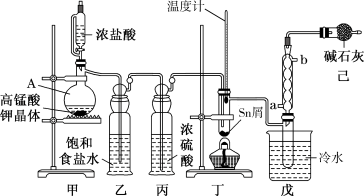
(1)实验室用二氧化锰制氯气的离子方程式为_______________________ 。
(2)装置己的作用有___________________ 。
(3) 和Sn的反应产物可能会有
和Sn的反应产物可能会有 和
和 为防止产品中带入
为防止产品中带入 ,除了通入过量氯气外,应控制温度在
,除了通入过量氯气外,应控制温度在_________ 范围内。(填标号)
a.114~232℃ b.232~652℃ c.652~2260℃
(4)为了确认丁中 的生成,可选用以下
的生成,可选用以下_____ 检验。(填标号)
a.稀盐酸
b.滴有KSCN(KSCN遇 变红)溶液的
变红)溶液的 溶液
溶液
c.酸性高锰酸钾溶液
(5)氯气在实际生活中的用途很多,可用于饮用水消毒。但对饮用水消毒副作用够,产生影响人体健康的有机氯衍生物。可用氯气制取高铁酸钠净水,补全缺项,并配平离子方程式______ 。
______ ______(______)+______
______(______)+______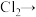 ______
______ ______(______)+
______(______)+
(6)工业上常将氯气转化为漂白粉,工业上利用氯气和石灰乳生产漂白粉的主要化学方程式是_________________ ,在空气中漂白粉长期存放会变质而失效的原理是(用化学方程式说明)____________ _____ 。
 )用于制作FTO导电玻璃,FTO玻璃广泛用于液晶显示屏、光催化、薄膜太阳能电池基底等;军事上四氯化锡蒸气与
)用于制作FTO导电玻璃,FTO玻璃广泛用于液晶显示屏、光催化、薄膜太阳能电池基底等;军事上四氯化锡蒸气与 及水汽混合呈浓烟状,可制作烟幕弹。实验室可用熔融的金属锡与干燥氯气利用图装置制备四氯化锡。有关信息如下表:
及水汽混合呈浓烟状,可制作烟幕弹。实验室可用熔融的金属锡与干燥氯气利用图装置制备四氯化锡。有关信息如下表:
化学式 | Sn |
|
|
熔点/℃ | 232 | 246 | -33 |
沸点/℃ | 2260 | 652 | 114 |
其他性质 | 银白色固体金属 | 无色晶体,Sn(Ⅱ)易被氧化 | 无色液体,遇水反应 |
(2)装置己的作用有
(3)
 和Sn的反应产物可能会有
和Sn的反应产物可能会有 和
和 为防止产品中带入
为防止产品中带入 ,除了通入过量氯气外,应控制温度在
,除了通入过量氯气外,应控制温度在a.114~232℃ b.232~652℃ c.652~2260℃
(4)为了确认丁中
 的生成,可选用以下
的生成,可选用以下a.稀盐酸
b.滴有KSCN(KSCN遇
 变红)溶液的
变红)溶液的 溶液
溶液c.酸性高锰酸钾溶液
(5)氯气在实际生活中的用途很多,可用于饮用水消毒。但对饮用水消毒副作用够,产生影响人体健康的有机氯衍生物。可用氯气制取高铁酸钠净水,补全缺项,并配平离子方程式
______
 ______(______)+______
______(______)+______ ______
______ ______(______)+
______(______)+
(6)工业上常将氯气转化为漂白粉,工业上利用氯气和石灰乳生产漂白粉的主要化学方程式是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】用MnO2和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水CuCl2,装置如图所示。请回答下列问题:

(1)写出制备氯气的化学方程式_______ 。
(2)B中选用的试剂是_______ ,其作用是_______ ;C中选用的试剂是_______ ,其作用是_______ 。
(3)装置E选用的试剂是_______ ,目的是_______ 。写出E中发生反应的化学方程式_______ 。
(4)但实验发现D中得到的无水CuCl2总是偏蓝色,请你提出改进方案_______ 。
(5)在实际生产中,人们曾用浓氨水(挥发出NH3)来检验氯气管道是否漏气。若管道某处泄露氯气,就会在该处产生白烟(NH4Cl),同时产生一种可直接排放空气中的气体。完成上述过程中化学反应方程式的配平____ 。
NH3+Cl2=NH4Cl+

(1)写出制备氯气的化学方程式
(2)B中选用的试剂是
(3)装置E选用的试剂是
(4)但实验发现D中得到的无水CuCl2总是偏蓝色,请你提出改进方案
(5)在实际生产中,人们曾用浓氨水(挥发出NH3)来检验氯气管道是否漏气。若管道某处泄露氯气,就会在该处产生白烟(NH4Cl),同时产生一种可直接排放空气中的气体。完成上述过程中化学反应方程式的配平
NH3+Cl2=NH4Cl+
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】某粗盐溶液中除泥沙外,还含有Ca2+、Mg2+、 等杂质离子,粗盐提纯后可以通过侯氏制碱法(其反应原理为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl)和电解饱和食盐水制取多种重要工业产品。下图是有关工艺流程,A、B、C、D、E、F为中学化学常见物质。
等杂质离子,粗盐提纯后可以通过侯氏制碱法(其反应原理为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl)和电解饱和食盐水制取多种重要工业产品。下图是有关工艺流程,A、B、C、D、E、F为中学化学常见物质。

回答下列问题:
(1)环节I中A、B、C依次应加入的物质为NaOH、___________ 、___________ ,加入D发生反应的离子方程式为___________ 、___________ 。
(2)环节Ⅱ中为了产生更多沉淀NaHCO3,应先通入过量的气体E为___________ ,再通入过量的F.析出NaHCO3晶体中可能含有少量氯离子杂质,检验该晶体中是否含有氯离子杂质的操作方法是___________ 。热分解时需用到的仪器为___________ (填符号)
A.表面皿 B.蒸发皿 C.培养皿 D.坩埚
(3)FeCO3与砂糖混用可以作补血剂,工业上用NaCO3溶液和FeSO4溶液发生复分解反应制备,(已知溶液pH大于8.8时,Fe2+转化为Fe(OH)2沉淀,实验中所用Na2CO3溶液的pH=10)。
①在烧杯中混合上述溶液制备FeCO3沉淀时的具体操作为___________ 。
a.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
②将FeSO4溶液缓慢加入到盛有NaHCO3溶液的烧杯中也得到FeCO3沉淀,同时在实验中观察到有无色无味的气体产生,该反应的离子方程式为___________ 。
 等杂质离子,粗盐提纯后可以通过侯氏制碱法(其反应原理为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl)和电解饱和食盐水制取多种重要工业产品。下图是有关工艺流程,A、B、C、D、E、F为中学化学常见物质。
等杂质离子,粗盐提纯后可以通过侯氏制碱法(其反应原理为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl)和电解饱和食盐水制取多种重要工业产品。下图是有关工艺流程,A、B、C、D、E、F为中学化学常见物质。
回答下列问题:
(1)环节I中A、B、C依次应加入的物质为NaOH、
(2)环节Ⅱ中为了产生更多沉淀NaHCO3,应先通入过量的气体E为
A.表面皿 B.蒸发皿 C.培养皿 D.坩埚
(3)FeCO3与砂糖混用可以作补血剂,工业上用NaCO3溶液和FeSO4溶液发生复分解反应制备,(已知溶液pH大于8.8时,Fe2+转化为Fe(OH)2沉淀,实验中所用Na2CO3溶液的pH=10)。
①在烧杯中混合上述溶液制备FeCO3沉淀时的具体操作为
a.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
②将FeSO4溶液缓慢加入到盛有NaHCO3溶液的烧杯中也得到FeCO3沉淀,同时在实验中观察到有无色无味的气体产生,该反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】某工厂设计了如下工艺实现低浓度 中硫元素的回收利用,该过程如图。
中硫元素的回收利用,该过程如图。
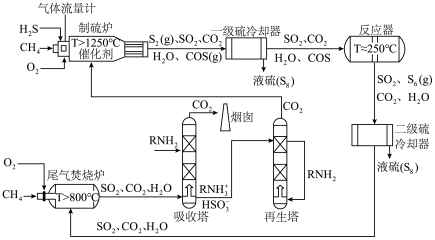
回答下列问题:
(1)一级冷却室中发生 ,该过程发生
,该过程发生______ (“物理”或“化学”)变化。
(2) 中碳的化合价为
中碳的化合价为 价,在反应器中
价,在反应器中 与水蒸气发生非氧化还原反应生成
与水蒸气发生非氧化还原反应生成 的化学方程式为
的化学方程式为_______ 。
(3)制硫炉的原始炉温为1000℃,分析通入 的作用为
的作用为______ 。
(4)制硫炉和反应器中溢出的硫蒸气分别为 和
和 ,分析二者存在形式不同的原因
,分析二者存在形式不同的原因_____ 。
(5)液硫不仅会溶解 ,还会与其反应生成
,还会与其反应生成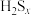 ,根据液硫中
,根据液硫中 的含量与温度的关系图判断,应在
的含量与温度的关系图判断,应在____ (填标号)范围内收集纯净液硫。

A.120~140℃ B.180~220℃ C.280~320℃
(6)吸收塔中吸收液 发生反应的离子方程式为
发生反应的离子方程式为________ 。
(7)有关该工艺的说法错误的是_______。
 中硫元素的回收利用,该过程如图。
中硫元素的回收利用,该过程如图。
回答下列问题:
(1)一级冷却室中发生
 ,该过程发生
,该过程发生(2)
 中碳的化合价为
中碳的化合价为 价,在反应器中
价,在反应器中 与水蒸气发生非氧化还原反应生成
与水蒸气发生非氧化还原反应生成 的化学方程式为
的化学方程式为(3)制硫炉的原始炉温为1000℃,分析通入
 的作用为
的作用为(4)制硫炉和反应器中溢出的硫蒸气分别为
 和
和 ,分析二者存在形式不同的原因
,分析二者存在形式不同的原因(5)液硫不仅会溶解
 ,还会与其反应生成
,还会与其反应生成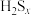 ,根据液硫中
,根据液硫中 的含量与温度的关系图判断,应在
的含量与温度的关系图判断,应在
A.120~140℃ B.180~220℃ C.280~320℃
(6)吸收塔中吸收液
 发生反应的离子方程式为
发生反应的离子方程式为(7)有关该工艺的说法错误的是_______。
A.本工艺中可循环利用的物质为 和 和 |
| B.需控制硫冷却器温度,防止生成固态硫堵塞管道 |
| C.尾气焚烧炉将废气中残留的硫化物充分转化的目的是提高硫回收率 |
D.吸收塔的作用是分离 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】叠氮化钠( )常用作汽车安全气囊中的药剂。实验室制取叠氮化钠的原理、实验装置及实验步骤如图:
)常用作汽车安全气囊中的药剂。实验室制取叠氮化钠的原理、实验装置及实验步骤如图:

①打开装置D导管上的旋塞,加热制取氨气。
②再加热装置A中的金属钠,使其熔化并与氨气充分反应后,停止加热装置D并关闭旋塞。
③向装置A中b容器内充入加热介质并加热到210∼220℃,然后通入 。
。
④冷却,向产物中加入乙醇(降低 的溶解度),减压浓缩结晶后,再过滤,并用乙醚洗涤,晾干。
的溶解度),减压浓缩结晶后,再过滤,并用乙醚洗涤,晾干。
已知:Ⅰ. 是易溶于水的白色晶体,微溶于乙醇,不溶于乙醚;
是易溶于水的白色晶体,微溶于乙醇,不溶于乙醚;
Ⅱ. 熔点210℃,沸点400℃,在水溶液中易水解。
熔点210℃,沸点400℃,在水溶液中易水解。
请回答下列问题:
(1)装置B中盛放的药品为_______ ;步骤①中先加热通 一段时间的目的是
一段时间的目的是_______ 。
(2)步骤②氨气与熔化的钠反应生成 的化学方程式为
的化学方程式为_______ 。
(3)生成 的化学方程式为
的化学方程式为_______ 。
(4)图中仪器a用的是铁质而不用玻璃,其主要原因是_______ 。
(5)步骤④中用乙醚洗涤的主要目的是_______ 。
(6)汽车经撞击后30毫秒内,会引发 迅速分解成两种单质,其中氧化产物和还原产物的质量之比为
迅速分解成两种单质,其中氧化产物和还原产物的质量之比为_______ 。
 )常用作汽车安全气囊中的药剂。实验室制取叠氮化钠的原理、实验装置及实验步骤如图:
)常用作汽车安全气囊中的药剂。实验室制取叠氮化钠的原理、实验装置及实验步骤如图:
①打开装置D导管上的旋塞,加热制取氨气。
②再加热装置A中的金属钠,使其熔化并与氨气充分反应后,停止加热装置D并关闭旋塞。
③向装置A中b容器内充入加热介质并加热到210∼220℃,然后通入
 。
。④冷却,向产物中加入乙醇(降低
 的溶解度),减压浓缩结晶后,再过滤,并用乙醚洗涤,晾干。
的溶解度),减压浓缩结晶后,再过滤,并用乙醚洗涤,晾干。已知:Ⅰ.
 是易溶于水的白色晶体,微溶于乙醇,不溶于乙醚;
是易溶于水的白色晶体,微溶于乙醇,不溶于乙醚;Ⅱ.
 熔点210℃,沸点400℃,在水溶液中易水解。
熔点210℃,沸点400℃,在水溶液中易水解。请回答下列问题:
(1)装置B中盛放的药品为
 一段时间的目的是
一段时间的目的是(2)步骤②氨气与熔化的钠反应生成
 的化学方程式为
的化学方程式为(3)生成
 的化学方程式为
的化学方程式为(4)图中仪器a用的是铁质而不用玻璃,其主要原因是
(5)步骤④中用乙醚洗涤的主要目的是
(6)汽车经撞击后30毫秒内,会引发
 迅速分解成两种单质,其中氧化产物和还原产物的质量之比为
迅速分解成两种单质,其中氧化产物和还原产物的质量之比为
您最近一年使用:0次