阿根廷科学家MasVeronica等人利用Ni(Ⅱ)Al(Ⅲ)层状复合催化剂进行了乙醇水蒸气重整制氢的研究。其主要反应为
反应I.C2H5OH(g)+3H2O(g)=2CO2(g)+6H2(g) △H1=+173.3kJ/mol △S=+362.7J/(K•mol)
反应Ⅱ.C2H5OH(g)+H2O(g)=2CO(g)+4H2(g) △H2=+255.7kJ/mol
若在恒容密闭容器中发生上述反应。
(1)反应I在常温下
(2)对上述恒容密闭容器中的体系,下列说法正确的是
| A.增大H2O(g)的浓度,有利于提高C2H5OH平衡转化率 |
| B.一定温度下,增大C2H5OH的浓度可以提高C2H5OH的平衡转化率 |
| C.若气体的平均相对分子质量保持不变,说明反应体系已达平衡 |
| D.升高温度可以使反应I、Ⅱ的正反应速率加快,逆反应速率减小,平衡向正反应方向移动 |
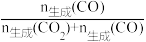 ×100%。
×100%。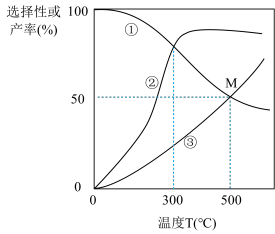
①图中曲线表示平衡时H2产率随温度变化的曲线是
②在密闭容器中,以投料比n(C2H5OH):n(H2O)=3:8通入混合气体,此时C2H5OH的转化率为66.67%,求交点M坐标为(500℃,50%)时反应Ⅱ的平衡常数Kp=
③一定能提高CO选择性的关键因素是
④请分析说明曲线②随温度变化的原因
(4)对乙醇水蒸气重整制氢反应I进行反应机理分析如下,“*”表示催化剂表面的活性中心,请补充完成基元反应iii。
i.C2H6O(g)+(*)→C2H6O*
ii.C2H6O*+(*)→CH4O*+CH2*
ⅲ.
iv.CH2*+2H2O(g)→CO2(g)+3H2(g)+(*)
相似题推荐
(1)在2L的容器中充入H2、I2各1mol,对于反应:H2(g)+I2(g)
 2HI(g),在323K和343K时H2的转化率随时间变化的结果如图所示。
2HI(g),在323K和343K时H2的转化率随时间变化的结果如图所示。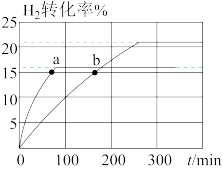
①323K时反应的平衡转化率
 =
=②在343K时,要提高I2转化率,可采取的措施是
③比较a、b处反应速率大小:v(a)
(2)对于反应:H2(g)+I2(g)
 2HI(g)提出如下反应历程
2HI(g)提出如下反应历程第一步:I2
 I+I(快速平衡)
I+I(快速平衡)第二步:H2+2I→2HI (慢反应)
其中可近似认为第二步反应不影响第一步的平衡。 下列表述正确的是
a.v(第一步的逆反应)<v(第二步的逆反应)
b.反应的中间产物只有I
c.第二步反应活化能较低
d.第二步中H2与I的碰撞仅部分有效
(3)已知反应2HI(g)
 H2(g)+I2(g)的能量变化如图所示,则1molHI(g)分子中化学键断裂时需吸收的能量为
H2(g)+I2(g)的能量变化如图所示,则1molHI(g)分子中化学键断裂时需吸收的能量为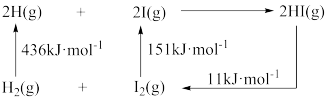
已知:2RCOO-+Cu2+
 (RCOO)2Cu
(RCOO)2Cu (1)可利用活性炭对地沟油进行脱色处理,这利用了活性炭的
(2)取30 mL三油酸甘油酯在不同条件下水解,实验结果如下表所示。
| 序号 | 试剂 | 温度 | 时间 | 水解率 |
| a | 20 mL3 mol/L H2SO4 | 95℃ | 3小时 | 52.1% |
| b | 20 mL 6 mol/LNaOH | 70℃ | 1.5 | 97.7% |
②对比实验a、b可以得到的结论有
(3)将预处理后的地沟油水解,用水解所得液体去除Cu2+的实验过程如下图所示。

①RCOONa属于
②实验表明,硫酸酸化后液体的pH会影响Cu2+的去除率。实验测得,pH=5时Cu2+的去除率低于pH=7时的,其原因为
(1)甲烷水蒸气催化重整制得
 CO(g)+3H2(g) ΔH>0。
CO(g)+3H2(g) ΔH>0。①为提高CH4的平衡转化率,降低其在混合物中百分含量,可采取的措施有
②下图中,X 为投料比
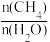 ,φ 为CH4的平衡转化率,其它条件不变,φ 随 X 的变化趋势曲线为
,φ 为CH4的平衡转化率,其它条件不变,φ 随 X 的变化趋势曲线为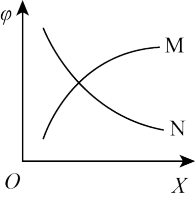
③某条件下,若 CH4(g)、H2O(g)初始浓度均为 0.2mol/L,CH4的平衡转化率φ=25%,K=
(2)热化学硫碘循环分解水制得
反应i:SO2(g)+I2(g)+2H2O(g)=H2SO4(l)+2HI(g) ∆H1=-82kJ·mol−1
反应ii:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) ∆H2=+544kJ·mol−1
反应iii:……
反应ⅰ~iii循环实现分解水:2H2O(g)=2H2(g)+O2(g) ∆H=+484kJ·mol−1。
①写出反应i 中K的表达式
②写出反应iii的热化学方程式



