T℃时,在体积为2L的密闭容器内,与同一个化学反应有关的A、B、C、D四种物质(D为固体,其余均为气体)的物质的量随反应时间变化的曲线如图所示,回答下列问题。
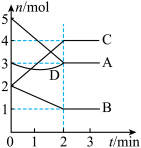
(1)该反应的化学方程式为_______ 。
(2)物质D在反应中的作用是______ 。
(3)若在上述反应中A是SO2、B是O2、C是SO3。下列说法能表示反应达到平衡状态的是______ (填字母);在0~2min内用O2表示的反应速率v(O2)=______ 。
A.容器内的气体压强保持不变 B.物质的量浓度:c(SO2)=2c(O2)
C.混合气的平均相对分子质量保持不变 D.化学反应速率:v(SO2)=v(SO3)
(4)某兴趣小组同学拟在实验室中制取SO2,并探究SO2使品红溶液褪色的原因。
①用Cu和浓硫酸反应制取SO2,化学反应方程式是_______ 。
②兴趣小组同学利用如图装置探究SO2的漂白性,观察到I中品红溶液不褪色,II中品红溶液褪色。
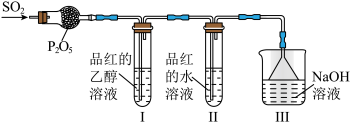
查阅资料:SO2通入水中存在如下反应:SO2+xH2O SO2•xH2O
SO2•xH2O H++HSO
H++HSO +(x-1)H2O;HSO
+(x-1)H2O;HSO
 SO
SO +H+。
+H+。
通过分析上述现象,猜测使品红水溶液褪色的微粒可能是i.H2SO3;ii.______ ;iii.______ 。
③为了证明上述猜测ii和iii,进行表中实验1和2,记录现象。
该实验说明,两种粒子中,______ 使品红水溶液褪色程度更大。
④取实验1所得溶液直接加热接近沸腾,溶液不恢复红色,在热溶液中滴加稀硫酸则恢复红色;说明______ ;取实验2所得溶液直接加热,则慢慢恢复浅红色,说明NaHSO3与品红生成的物质不稳定。

(1)该反应的化学方程式为
(2)物质D在反应中的作用是
(3)若在上述反应中A是SO2、B是O2、C是SO3。下列说法能表示反应达到平衡状态的是
A.容器内的气体压强保持不变 B.物质的量浓度:c(SO2)=2c(O2)
C.混合气的平均相对分子质量保持不变 D.化学反应速率:v(SO2)=v(SO3)
(4)某兴趣小组同学拟在实验室中制取SO2,并探究SO2使品红溶液褪色的原因。
①用Cu和浓硫酸反应制取SO2,化学反应方程式是
②兴趣小组同学利用如图装置探究SO2的漂白性,观察到I中品红溶液不褪色,II中品红溶液褪色。

查阅资料:SO2通入水中存在如下反应:SO2+xH2O
 SO2•xH2O
SO2•xH2O H++HSO
H++HSO +(x-1)H2O;HSO
+(x-1)H2O;HSO
 SO
SO +H+。
+H+。通过分析上述现象,猜测使品红水溶液褪色的微粒可能是i.H2SO3;ii.
③为了证明上述猜测ii和iii,进行表中实验1和2,记录现象。
| 实验序号 | 实验1 | 实验2 |
| 实验操作 |  2mL0.20mol•L-1Na2SO3溶液 |  2mL0.20mol•L-1NaHSO3溶液 |
| 实验现象 | 迅速褪色 | 褪色较慢 |
④取实验1所得溶液直接加热接近沸腾,溶液不恢复红色,在热溶液中滴加稀硫酸则恢复红色;说明
更新时间:2023-04-28 22:03:41
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】用图所示实验装置可以完成中学化学实验中的一些实验。

(1)现有稀硝酸、稀盐酸、稀硫酸、碳酸钠粉末、硅酸钠溶液五种试剂。选择三种试剂利用如图装置证明酸性强弱:H2SO4 > H2CO3 > H2SiO3
①仪器A的名称_______ ,A中试剂_______ ,B中试剂_______ 。
②C中发生反应的化学方程式:_______ 。
(2)利用如图装置实验,证明二氧化硫气体具有漂白性。已知:Na2SO3 + H2SO4=Na2SO4 +SO2↑+H2O。 在装置A中加入 70%的硫酸溶液,B中加入Na2SO3粉末;
①C中应加入_______ 溶液。打开分液漏斗活塞,一段时间后观察到C中现象是_______ ,反应完全后,将C试管加热一段时间发生的现象是_______ 。
②如果仅用如图装置进行此实验,可能造成环境污染,此污染属于_______ (选填“白色污染”或“酸雨污染"),因此应该在C装置后加一个盛有_______ 溶液的洗气瓶。
③将二氧化硫气体通入FeCl3溶液中反应一段时间后,滴加KSCN溶液,溶液未变红色,请写出所发生反应的离子方程式:_______ 。

(1)现有稀硝酸、稀盐酸、稀硫酸、碳酸钠粉末、硅酸钠溶液五种试剂。选择三种试剂利用如图装置证明酸性强弱:H2SO4 > H2CO3 > H2SiO3
①仪器A的名称
②C中发生反应的化学方程式:
(2)利用如图装置实验,证明二氧化硫气体具有漂白性。已知:Na2SO3 + H2SO4=Na2SO4 +SO2↑+H2O。 在装置A中加入 70%的硫酸溶液,B中加入Na2SO3粉末;
①C中应加入
②如果仅用如图装置进行此实验,可能造成环境污染,此污染属于
③将二氧化硫气体通入FeCl3溶液中反应一段时间后,滴加KSCN溶液,溶液未变红色,请写出所发生反应的离子方程式:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】I.研究性学习小组进行SO2的制备及性质探究实验,装置如图(a为活塞,加热及固定装置已略去)。

(1)连接仪器、检查装置气密性,检验上述装置气密性的操作是_______ ,然后加药品,打开a,然后滴入浓硫酸,加热。
(2)铜与浓硫酸反应制备SO2的化学方程式是_______ 。
(3)探究SO2与品红作用的可逆性,请写出实验操作及现象_______ 。
(4)SO2通入KMnO4溶液中,现象是_______ 说明SO2具有_______ 性。
Ⅱ.硝酸是一种具有强氧化性、腐蚀性的强酸,其还原产物因硝酸浓度的不同而变化,总体上说,浓硝酸的还原产物主要为NO2、稀硝酸的还原产物为NO。回答下列问题:64gCu与适量的浓HNO3反应,铜全部作用后,共收集到22.4L气体(标准状况),反应中消耗的HNO3的物质的量是_______ ,产生的气体是_______ ,其物质的量之比是_______ 。

(1)连接仪器、检查装置气密性,检验上述装置气密性的操作是
(2)铜与浓硫酸反应制备SO2的化学方程式是
(3)探究SO2与品红作用的可逆性,请写出实验操作及现象
(4)SO2通入KMnO4溶液中,现象是
Ⅱ.硝酸是一种具有强氧化性、腐蚀性的强酸,其还原产物因硝酸浓度的不同而变化,总体上说,浓硝酸的还原产物主要为NO2、稀硝酸的还原产物为NO。回答下列问题:64gCu与适量的浓HNO3反应,铜全部作用后,共收集到22.4L气体(标准状况),反应中消耗的HNO3的物质的量是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】化学小组为了证明SO2和Cl2的漂白性,设计了如图所示的实验装置:
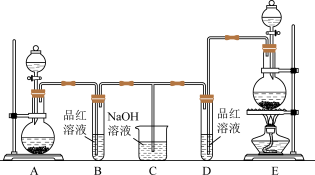
(1)他们制备SO2的反应原理Na2SO3+H2SO4(较浓)=Na2SO4+SO2↑+2H2O,应选用图中A、E装置中的_______ (填序号)制SO2.
(2)他们制取Cl2时使用了浓盐酸,结合另一发生装置的特点,写出他们制Cl2的原理_______ (写化学方程式),并指出反应中浓盐酸所表现出的性质是_______ 、_______ 。
(3)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管中的液体加热,B试管中的现象是_______ 。
(4)NaOH溶液分别与两种气体反应的离子方程式是_______ 、_______ 。
(5)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色。查阅资料得知:两种气体按体积比1:1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的离子方程式是_______ 。

(1)他们制备SO2的反应原理Na2SO3+H2SO4(较浓)=Na2SO4+SO2↑+2H2O,应选用图中A、E装置中的
(2)他们制取Cl2时使用了浓盐酸,结合另一发生装置的特点,写出他们制Cl2的原理
(3)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管中的液体加热,B试管中的现象是
(4)NaOH溶液分别与两种气体反应的离子方程式是
(5)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色。查阅资料得知:两种气体按体积比1:1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的离子方程式是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】以 催化加氢制
催化加氢制 有利于实现“碳中和”。合成时有反应:
有利于实现“碳中和”。合成时有反应:
反应Ⅰ(主反应):
反应Ⅱ(副反应):
相关键能如下表:
回答下列问题:
(1)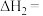
___________
(2)向某密闭容器中按投料比 通入混合气体,体系压强恒定为2.5MPa,控制不同温度若只发生反应Ⅰ(主反应)达平衡,体系中
通入混合气体,体系压强恒定为2.5MPa,控制不同温度若只发生反应Ⅰ(主反应)达平衡,体系中 和
和 的体积分数如图所示。
的体积分数如图所示。

 温度下,下列有关反应Ⅰ(主反应)说法正确的是
温度下,下列有关反应Ⅰ(主反应)说法正确的是________
A.若 时,反应达平衡
时,反应达平衡
B.若反应混合气体的密度保持不变,反应达平衡
C.若 保持不变时,反应达平衡
保持不变时,反应达平衡
D.反应达平衡时,不再有 和
和 生成
生成
反应Ⅰ(主反应)反应10min达A点平衡状态,则该反应的分压平衡常数
___________ (结果保留2位小数,以平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(3)在恒压、 和
和 的起始量一定的条件下,
的起始量一定的条件下, 的平衡转化率或平衡时
的平衡转化率或平衡时 的选择性随温度的变化如图。
的选择性随温度的变化如图。

已知: 的选择性
的选择性
①图中曲线c、d表示 选择性的曲线是
选择性的曲线是___________ (填“c”、“d”),理由是___________ 。
②若不改变反应时间和温度,一定能提高 选择性的措施有
选择性的措施有___________ (写一条)。
 催化加氢制
催化加氢制 有利于实现“碳中和”。合成时有反应:
有利于实现“碳中和”。合成时有反应:反应Ⅰ(主反应):

反应Ⅱ(副反应):

相关键能如下表:
| 化学键 |  |  |  |  |
| 键能 | 436 | 803 | 1071 | 464 |
(1)
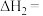
(2)向某密闭容器中按投料比
 通入混合气体,体系压强恒定为2.5MPa,控制不同温度若只发生反应Ⅰ(主反应)达平衡,体系中
通入混合气体,体系压强恒定为2.5MPa,控制不同温度若只发生反应Ⅰ(主反应)达平衡,体系中 和
和 的体积分数如图所示。
的体积分数如图所示。
 温度下,下列有关反应Ⅰ(主反应)说法正确的是
温度下,下列有关反应Ⅰ(主反应)说法正确的是A.若
 时,反应达平衡
时,反应达平衡B.若反应混合气体的密度保持不变,反应达平衡
C.若
 保持不变时,反应达平衡
保持不变时,反应达平衡D.反应达平衡时,不再有
 和
和 生成
生成反应Ⅰ(主反应)反应10min达A点平衡状态,则该反应的分压平衡常数

(3)在恒压、
 和
和 的起始量一定的条件下,
的起始量一定的条件下, 的平衡转化率或平衡时
的平衡转化率或平衡时 的选择性随温度的变化如图。
的选择性随温度的变化如图。
已知:
 的选择性
的选择性
①图中曲线c、d表示
 选择性的曲线是
选择性的曲线是②若不改变反应时间和温度,一定能提高
 选择性的措施有
选择性的措施有
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】汽车尾气中通常含有NO和CO等大气污染物,科学家寻找高效催化剂实现了汽车尾气的转化,进而减少汽车尾气对大气的污染。
(1)在100 kPa和298.15 K下,由稳定单质生成1 mol化合物的焓变称为该物质在 298.15 K时的标准摩尔生成焓。已知NO标准摩尔生成焓AH= +91.5 kJ/mol,CO的标准燃烧热AH=- 283kJ/mol,由此写出NO和CO反应的热化学反应方程式____ 。
(2) 一定温度下,向2L恒容密闭容器中充入4.0molNO2和4.0molCO,在催化剂作用下发生反应4CO(g)+2NO2(g) = N2(g)+4CO2(g) △H<0,测得相关数据如下:
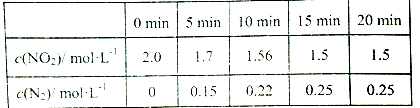
①5~l0min,用NO2的浓度变化表示的反应速率为____ 。
②以下表述能说明该反应已达到平衡状态的是____ 。
A.气体颜色不再变化
B.气体密度不再变化
C.气体平均相对分子质量不再变化
③20 min时,保持温度不变,继续向该容器中加入l.0mol NO2和l.0molCO,在t1时反应再次达到平衡,则N02的转化率比原平衡____ (填“增大”、“减小”或“不变)。
④该温度下反应的化学平衡常数K=_____ (保留两位有效数字)。
( ) N2O4与NO2之间存在反应N2O4(g)  2NO2(g )。将一定量的N2O4放入恒容密闭容器中,在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系:v(N2O4)=klp(N2O4),v(NO2)=k2P2(NO2),其中k1、k2是与反应温度有关的常数。则一定温度下,k1、k2与平衡常数Kp的关系是k1=
2NO2(g )。将一定量的N2O4放入恒容密闭容器中,在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系:v(N2O4)=klp(N2O4),v(NO2)=k2P2(NO2),其中k1、k2是与反应温度有关的常数。则一定温度下,k1、k2与平衡常数Kp的关系是k1=_____ 。(Kp为平衡分压代替平衡浓度计算所得的平衡常数,分压=总压×物质的量分数)
(4)电解法处理氮氧化合物是目前大气污染治理的一个新思路,原理是将NOx在电解池中分解成无污染的N2除去,如图示,两电极间是固体氧化物电解质,在一定条件下可自由传导 O2-,如果NOx为NO,则电解池阴极电极反应式为______ 。

(1)在100 kPa和298.15 K下,由稳定单质生成1 mol化合物的焓变称为该物质在 298.15 K时的标准摩尔生成焓。已知NO标准摩尔生成焓AH= +91.5 kJ/mol,CO的标准燃烧热AH=- 283kJ/mol,由此写出NO和CO反应的热化学反应方程式
(2) 一定温度下,向2L恒容密闭容器中充入4.0molNO2和4.0molCO,在催化剂作用下发生反应4CO(g)+2NO2(g) = N2(g)+4CO2(g) △H<0,测得相关数据如下:

①5~l0min,用NO2的浓度变化表示的反应速率为
②以下表述能说明该反应已达到平衡状态的是
A.气体颜色不再变化
B.气体密度不再变化
C.气体平均相对分子质量不再变化
③20 min时,保持温度不变,继续向该容器中加入l.0mol NO2和l.0molCO,在t1时反应再次达到平衡,则N02的转化率比原平衡
④该温度下反应的化学平衡常数K=
 2NO2(g )。将一定量的N2O4放入恒容密闭容器中,在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系:v(N2O4)=klp(N2O4),v(NO2)=k2P2(NO2),其中k1、k2是与反应温度有关的常数。则一定温度下,k1、k2与平衡常数Kp的关系是k1=
2NO2(g )。将一定量的N2O4放入恒容密闭容器中,在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系:v(N2O4)=klp(N2O4),v(NO2)=k2P2(NO2),其中k1、k2是与反应温度有关的常数。则一定温度下,k1、k2与平衡常数Kp的关系是k1=(4)电解法处理氮氧化合物是目前大气污染治理的一个新思路,原理是将NOx在电解池中分解成无污染的N2除去,如图示,两电极间是固体氧化物电解质,在一定条件下可自由传导 O2-,如果NOx为NO,则电解池阴极电极反应式为

您最近一年使用:0次
【推荐3】研究氮、硫、碳及其化合物的转化对于减少如雾霾、酸雨、酸雾等环境污染问题有重大意义。请回答下列问题:
(1)在一定条件下,CH4可与NO2反应生成对环境无污染的物质。
已知:①CH4的燃烧热:∆H=-890.3 kJ•mol-1②N2(g)+2O2(g)⇌2NO2(g)∆H=+67.0 kJ•mol-1③H2O(g)=H2O(l)∆H=-41.0 kJ•mol-1,则CH4(g)+2NO2 (g) ⇌CO2+2H2O (g)+N2(g)∆H=___ kJ•mol -1。
(2)活性炭也可用于处理汽车尾气中的NO。在2L恒容密闭容器中加入0.1000molNO和2.030mol固体活性炭,生成CO2、N2两种气体,在不同温度下测得平衡体系中各物质的物质的量如表所示:
①反应的正反应为________ (填“吸热”或“放热”)反应。
②一定温度下,下列能说明该反应已达到平衡状态的是_______ 。
A. N2与NO 的生成速率相等 B. 混合气体的密度保持不变
C.∆H 保持不变 D. 容器的总压强保持不变
③ 200 ℃时,平衡后向该容器中再充入0.1molNO,再次平衡后,NO的百分含量将______ (填“增大”“减小”或“不变”)。
(3)SO2经催化氧化可制取硫酸,在一定温度下,往一恒容密闭容器中以体积比2∶1,通入SO2和O2,测得容器内总压强在不同温度下与反应时间的关系如图所示。
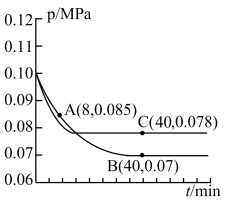
图中C 点时,SO2的转化率为________ 。
②其中C 点的正反应速率υC(正)与A点的逆反应速率υA(逆)的大小关系为:υC(正)____ υA(逆)(填“>”、“<”或“=”)。
(4)有人设想将CO按下列反应除去:2CO(g)=2C(s)+O2(g) ∆H>0,请你分析该设想能否实现?_____ (填“能”或“否”),依据是__________ 。
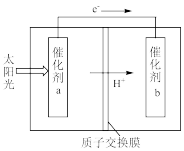
(5)利用人工光合作用,借助太阳能使CO2和H2O转化为HCOOH,如图所示,在催化剂b表面发生的电极反应为:___________ 。
(1)在一定条件下,CH4可与NO2反应生成对环境无污染的物质。
已知:①CH4的燃烧热:∆H=-890.3 kJ•mol-1②N2(g)+2O2(g)⇌2NO2(g)∆H=+67.0 kJ•mol-1③H2O(g)=H2O(l)∆H=-41.0 kJ•mol-1,则CH4(g)+2NO2 (g) ⇌CO2+2H2O (g)+N2(g)∆H=
(2)活性炭也可用于处理汽车尾气中的NO。在2L恒容密闭容器中加入0.1000molNO和2.030mol固体活性炭,生成CO2、N2两种气体,在不同温度下测得平衡体系中各物质的物质的量如表所示:
| 温度 | 固体活性炭/mol | NO/mol | N2/mol | CO2/mol |
| 200℃ | 2.000 | 0.0400 | 0.0300 | 0.0300 |
| 335℃ | 2.005 | 0.0500 | 0.0250 | 0.0250 |
②一定温度下,下列能说明该反应已达到平衡状态的是
A. N2与NO 的生成速率相等 B. 混合气体的密度保持不变
C.∆H 保持不变 D. 容器的总压强保持不变
③ 200 ℃时,平衡后向该容器中再充入0.1molNO,再次平衡后,NO的百分含量将
(3)SO2经催化氧化可制取硫酸,在一定温度下,往一恒容密闭容器中以体积比2∶1,通入SO2和O2,测得容器内总压强在不同温度下与反应时间的关系如图所示。

图中C 点时,SO2的转化率为
②其中C 点的正反应速率υC(正)与A点的逆反应速率υA(逆)的大小关系为:υC(正)
(4)有人设想将CO按下列反应除去:2CO(g)=2C(s)+O2(g) ∆H>0,请你分析该设想能否实现?
(5)利用人工光合作用,借助太阳能使CO2和H2O转化为HCOOH,如图所示,在催化剂b表面发生的电极反应为:

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】某化学兴趣小组利用以下装置探究氯气与氨气之间的反应。其中装置A、F分别为氨气和氯气的发生装置,装置C为纯净、干燥的氯气与氨气发生反应的装置。回答下列问题:

(1)装置A的圆底烧瓶中盛放的固体物质是 ,发生的反应是
,发生的反应是_______ 。
(2)装置B中的试剂是_______ ,E中的试剂是_______ 。
(3)C中的装置应选用图中的_______ (填甲或乙)

(4)装置C中集气瓶中有大量白烟产生,另一产物是空气主要成分,写出发生反应的化学方程式_______ 。
(5)兴趣小组查资料得知,在催化剂作用下, 与
与 能反应生成无污染的产物。另外收集了少量
能反应生成无污染的产物。另外收集了少量 充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入
充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入 (两端用夹子
(两端用夹子 、
、 夹好)。
夹好)。


(1)装置A的圆底烧瓶中盛放的固体物质是
 ,发生的反应是
,发生的反应是(2)装置B中的试剂是
(3)C中的装置应选用图中的

(4)装置C中集气瓶中有大量白烟产生,另一产物是空气主要成分,写出发生反应的化学方程式
(5)兴趣小组查资料得知,在催化剂作用下,
 与
与 能反应生成无污染的产物。另外收集了少量
能反应生成无污染的产物。另外收集了少量 充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入
充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入 (两端用夹子
(两端用夹子 、
、 夹好)。
夹好)。
| 操作步骤 | 实验现象 | 解释原因 |
打开 ,推动注射器活塞,使X中的气体缓慢入Y管中 ,推动注射器活塞,使X中的气体缓慢入Y管中 | ①Y管中 | ②反应的化学方程式 |
| 将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
打开 | ③ | ④ |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
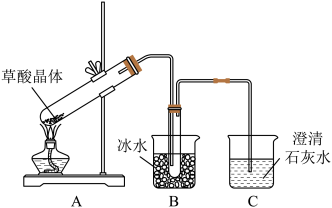
【推荐2】草酸(乙二酸)是一种二元弱酸,广泛存在于自然界的植物中。草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O4·2H2O)无色,熔点为101 ℃,易溶于水,受热脱水、升华,170 ℃以上分解。某甲实验小组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物。
回答下列问题:
(1)装置组装完毕后,实验开始前需要进行的操作为_____________________ 。
(2)装置C中可观察到溶液变浑浊,由此可知草酸晶体分解的产物中有CO2。装置B的主要作用是____________ 。若无装置B,则C中发生的离子反应方程式有CO2+ Ca2++2OH-=CaCO3↓+H2O、__________________________________________ 。
(3)乙组同学认为草酸晶体分解产物中还有CO,为进行验证,选用甲组实验中的装置A、B和下图所示的部分装置(可以重复选用)进行实验。
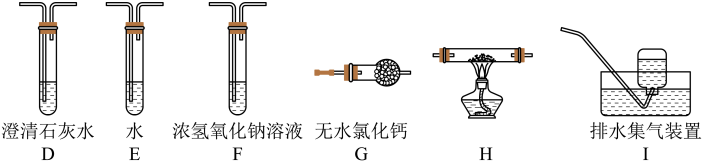
乙组同学的实验装置中,依次连接的合理顺序为A、B、F、___ 、G、H、___ 、I,H反应管中盛有的物质是________ (填化学式)。
(4)据两组同学的实验结果,可知草酸晶体分解的化学方程式为:_________________________________________ 。所有的反应物和生成物中属于电解质的有________ 种。

回答下列问题:
(1)装置组装完毕后,实验开始前需要进行的操作为
(2)装置C中可观察到溶液变浑浊,由此可知草酸晶体分解的产物中有CO2。装置B的主要作用是
(3)乙组同学认为草酸晶体分解产物中还有CO,为进行验证,选用甲组实验中的装置A、B和下图所示的部分装置(可以重复选用)进行实验。

乙组同学的实验装置中,依次连接的合理顺序为A、B、F、
(4)据两组同学的实验结果,可知草酸晶体分解的化学方程式为:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】早在1774年,瑞典化学家舍勒在研究软锰矿(主要成分MnO2)的过程中,将它与浓盐酸混合加热,产生了黄绿色气体一氯气。某小组同学利用舍勒发现氯气的方法制取氯气并探究其性质。

(1)装置①中制取氯气,实验室用二氧化锰和浓盐酸制备氯气的化学方程式为:_______ 。
(2)装置②中的饱和食盐水的作用_______ 。装置③中的现象是_______ 。
(3)装置④中反应的离子方程式是_______ 。
(4)若有71gCl2生成,则被氧化的HCl质量为_______ 。

(1)装置①中制取氯气,实验室用二氧化锰和浓盐酸制备氯气的化学方程式为:
(2)装置②中的饱和食盐水的作用
(3)装置④中反应的离子方程式是
(4)若有71gCl2生成,则被氧化的HCl质量为
您最近一年使用:0次



