 的资源化利用有利于碳中和目标的实现。回答下列问题:
的资源化利用有利于碳中和目标的实现。回答下列问题:(1)将
 催化加氢转化为
催化加氢转化为 是资源化利用的途径之一,适当温度下,在催化剂存在的
是资源化利用的途径之一,适当温度下,在催化剂存在的 加氢反应器中,主要反应有:
加氢反应器中,主要反应有:ⅰ.

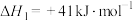

ⅱ.

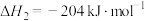

ⅲ.
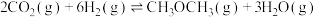


①

 ,
,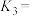
 、
、 的式子表示)。
的式子表示)。②将1mol
 、3mol
、3mol  充入2L的刚性容器中,测得反应进行到10min时,
充入2L的刚性容器中,测得反应进行到10min时, 的转化率与催化剂(X、Y、Z)、温度(T)间关系如图所示:
的转化率与催化剂(X、Y、Z)、温度(T)间关系如图所示: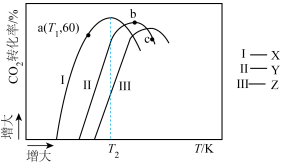
则三种催化剂条件下的反应中,
 温度下活化能最小的是
温度下活化能最小的是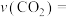
 ;转化率
;转化率 的原因可能是
的原因可能是A.b点平衡后升温平衡逆向移动
B.温度过高导致催化剂Y催化活性降低,c点时反应还没有达到平衡
C.b点不是平衡态c点是平衡态
(2)
 与
与 也可用于制备甲醇:
也可用于制备甲醇: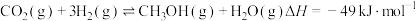 。TK时,向压强为9MPa的恒压容器中充入3mol
。TK时,向压强为9MPa的恒压容器中充入3mol  和7mol
和7mol  ,达到平衡时,
,达到平衡时, 的体积分数为
的体积分数为 。
。①写出能提高
 产率的两种方法:
产率的两种方法:②
 和
和 的平衡转化率之比为
的平衡转化率之比为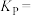
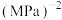 (以分压表示,分压=总压×气体物质的量分数,保留两位有效数字)。
(以分压表示,分压=总压×气体物质的量分数,保留两位有效数字)。
2023·湖北·模拟预测 查看更多[1]
更新时间:2023-05-12 20:47:52
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】C、N、S和Cl元素的单质及化合物在工业生产中的有效利用备受关注。请回答下列问题:
(1)已知:I.2SO2(g)+O2(g)+2H2O(1) =2H2SO4(aq) △H1;
Ⅱ.Cl2(g)+H2O(1) HCl(aq)+HClO(aq) △H2;
HCl(aq)+HClO(aq) △H2;
Ⅲ.2HClO(aq) =2HCl(aq)+O2(g) △H3
SO2(g)+Cl2(g)+2H2O(1)=2HCl(aq)+H2SO4 (aq) △H4=__________ (用含有△H1、△H2和△H3的代数式表示)。
(2)25℃时,H2SO3溶液中各含硫微粒的物质的量分数(δ)与溶液pH的变化关系如图所示。
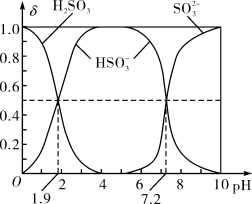
已知25℃时,NaHSO3的水溶液pH<7,用图中的数据通过计算解释原因____________________ 。
(3)利用“ Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“ Na-CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:

①放电时,正极的电极反应式为______ 。
②选用高氯酸钠—四甘醇二甲醚做电解液的优点是_______ (至少写两点)。
(4)氯氨是氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2C1、NHCl2和NC13),副产物少于其它水消毒剂。
①一氯胺(NH2Cl)的电子式为_______ 。一氯胺是重要的水消毒剂,其原因是由于一氯胺在中性、酸性环境中会发生水解,生成具有强烈杀菌作用的物质,该反应的化学方程式为_______ 。
②在恒温条件下,2molCl2和1molNH3发生反应2Cl2(g)+NH3(g)⇌NHCl2(l)+2HCl(g),测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示:
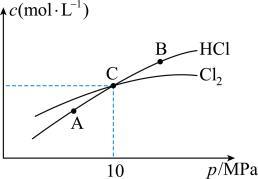
计算C点时该反应的压强平衡常数Kp(C)=_______ (Kp是平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(1)已知:I.2SO2(g)+O2(g)+2H2O(1) =2H2SO4(aq) △H1;
Ⅱ.Cl2(g)+H2O(1)
 HCl(aq)+HClO(aq) △H2;
HCl(aq)+HClO(aq) △H2;Ⅲ.2HClO(aq) =2HCl(aq)+O2(g) △H3
SO2(g)+Cl2(g)+2H2O(1)=2HCl(aq)+H2SO4 (aq) △H4=
(2)25℃时,H2SO3溶液中各含硫微粒的物质的量分数(δ)与溶液pH的变化关系如图所示。

已知25℃时,NaHSO3的水溶液pH<7,用图中的数据通过计算解释原因
(3)利用“ Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“ Na-CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2
 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
①放电时,正极的电极反应式为
②选用高氯酸钠—四甘醇二甲醚做电解液的优点是
(4)氯氨是氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2C1、NHCl2和NC13),副产物少于其它水消毒剂。
①一氯胺(NH2Cl)的电子式为
②在恒温条件下,2molCl2和1molNH3发生反应2Cl2(g)+NH3(g)⇌NHCl2(l)+2HCl(g),测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示:

计算C点时该反应的压强平衡常数Kp(C)=
您最近一年使用:0次
【推荐2】氢气是一种清洁能源。科学家探究太阳能制氢技术,设计流程图如图:
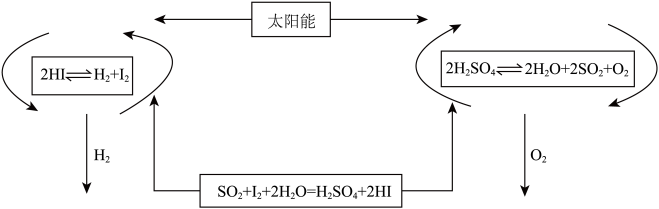
信息提示:以下反应均在150℃发生
2HI(aq)⇌H2(g)+I2(g) △H1
SO2(g)+I2(g)+2H2O(g)=H2SO4(l)+2HI(g) △H2
2H2SO4(l)⇌2H2O(g)+2SO2(g)+O2(g) △H3
2H2O(g)=2H2(g)+O2(g) △H4
请回答下列问题:
(1)△H4与△H1、△H2、△H3之间的关系是:△H4=______ 。
(2)该制氢气技术的优点是______ ,若反应SO2(g)+I2(g)+2H2O(g)=H2SO4(l)+2HI(g)在150℃下能自发进行,则△H ______ 0(填“>”,“<”或“=”)。
(3)在某温度下,H2SO4在不同催化剂条件下分解产生氧气的量随时间变化如图所示,则下列说法正确的是______ 。

A H2SO4分解反应的活化能大小顺序是:Ea(A)>Ea(B )>Ea(C)
B 若在恒容绝热的密闭容器中发生反应,当K值不变时,说明该反应已经达到平衡
C 0~4小时在A催化剂作用下,H2SO4分解的平均速率v(O2)=1250mol•h-1
D 不同催化剂的催化效果不同,是因为活化分子百分数不相同
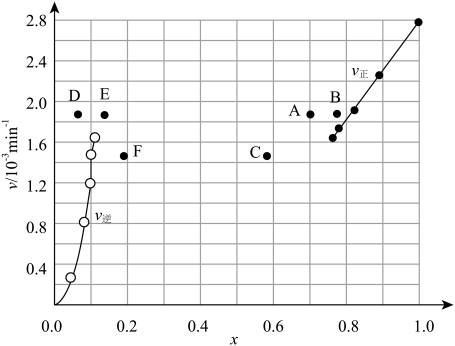
(4)对于反应:2HI(g)⇌H2(g)+I2(g),在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
①根据上述实验结果,该反应的平衡常数 K的计算式为: ______ 。
②上述反应中,正反应速率为v正=k正•x2(HI),逆反应速率为v逆=k逆•x(H2)•x(I2),其中k正、k逆为速率常数,则k逆为______ (以K和k正表示)。若k正=0.0027min-1,在t=40min时,v正= ______ min-1。
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为______ (填字母)。

信息提示:以下反应均在150℃发生
2HI(aq)⇌H2(g)+I2(g) △H1
SO2(g)+I2(g)+2H2O(g)=H2SO4(l)+2HI(g) △H2
2H2SO4(l)⇌2H2O(g)+2SO2(g)+O2(g) △H3
2H2O(g)=2H2(g)+O2(g) △H4
请回答下列问题:
(1)△H4与△H1、△H2、△H3之间的关系是:△H4=
(2)该制氢气技术的优点是
(3)在某温度下,H2SO4在不同催化剂条件下分解产生氧气的量随时间变化如图所示,则下列说法正确的是

A H2SO4分解反应的活化能大小顺序是:Ea(A)>Ea(B )>Ea(C)
B 若在恒容绝热的密闭容器中发生反应,当K值不变时,说明该反应已经达到平衡
C 0~4小时在A催化剂作用下,H2SO4分解的平均速率v(O2)=1250mol•h-1
D 不同催化剂的催化效果不同,是因为活化分子百分数不相同
(4)对于反应:2HI(g)⇌H2(g)+I2(g),在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
②上述反应中,正反应速率为v正=k正•x2(HI),逆反应速率为v逆=k逆•x(H2)•x(I2),其中k正、k逆为速率常数,则k逆为
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为

您最近一年使用:0次
【推荐3】(1)地球上的能源主要源于太阳,绿色植物的光合作用可以大量吸收CO2以减缓温室效应,主要过程可以描述分为下列三步(用“C5”表示C5H10O4,用“C3”表示C3H6O3):
Ⅰ、H2O(l)═2H+(aq)+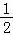 O2(g)+2e﹣△H=+284kJ/mol
O2(g)+2e﹣△H=+284kJ/mol
Ⅱ、CO2(g)+C5(s)+2H+(aq)═2C3+(s)△H=+396kJ/mol
Ⅲ、12C3+(s)+12e﹣═C6H12O6(葡萄糖、s)+6C5(s)+3O2(g)△H=﹣1200kJ/mol
写出绿色植物利用水和二氧化碳合成葡萄糖并放出氧气的热化学方程式_________ .
(2)降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol.
CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol.
测得CO2和CH3OH(g)的浓度随时间变化如图1所示
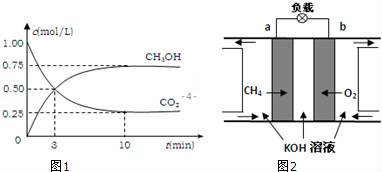
①一定温度下,不能说明该反应达到平衡状态的是:_________ (填序号)
a.体系的压强不再改变
b.体系的密度不再改变
c.各气体的浓度不再改变
d.各气体的质量分数不再改变
e.反应速率v(CO2)正∶v(H2)逆=1∶3
②从反应开始到平衡,氢气的平均反应速率v(H2)=________ mol/(L•min);
③氢气的转化率=____________ ;
④该反应的平衡常数为K=_________ 保留三位有效数字);
⑤下列措施中能使平衡体系中n(CH3OH)/ n(CO2)增大的是________ .
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出去 D.再充入1mol CO2和3mol H2
⑥当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2.则c1____ c2的关系(填>、<、=).
(3)减少温室气体排放的关键是节能减排,大力开发利用燃料电池就可以实现这一目标.如图2所示甲烷燃料电池(在上面).请回答:
①通入甲烷一极的电极反应式为___________ ;
②随着电池不断放电,电解质溶液的pH______ (填“增大”、“减小”或“不变”).
③通常情况下,甲烷燃料电池的能量利用率____ (填“大于”、“小于”或“等于”)甲烷燃烧的能量利用率.
④用该燃料电池以石墨电极电解2.0L 0.25 mol·L-1 CuSO4溶液,5min后在一个电极上有6.4gCu析出。则阳极的电极反应式为____________________ ; 此时得到的O2在标准状况下的体积为______ L;向电解后的溶液中加入下列哪种物质可使电解质溶液恢复原来的浓度:____________
A. CuSO4 B.H2O C.CuO D.CuCO3
Ⅰ、H2O(l)═2H+(aq)+
 O2(g)+2e﹣△H=+284kJ/mol
O2(g)+2e﹣△H=+284kJ/molⅡ、CO2(g)+C5(s)+2H+(aq)═2C3+(s)△H=+396kJ/mol
Ⅲ、12C3+(s)+12e﹣═C6H12O6(葡萄糖、s)+6C5(s)+3O2(g)△H=﹣1200kJ/mol
写出绿色植物利用水和二氧化碳合成葡萄糖并放出氧气的热化学方程式
(2)降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol.
CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图1所示

①一定温度下,不能说明该反应达到平衡状态的是:
a.体系的压强不再改变
b.体系的密度不再改变
c.各气体的浓度不再改变
d.各气体的质量分数不再改变
e.反应速率v(CO2)正∶v(H2)逆=1∶3
②从反应开始到平衡,氢气的平均反应速率v(H2)=
③氢气的转化率=
④该反应的平衡常数为K=
⑤下列措施中能使平衡体系中n(CH3OH)/ n(CO2)增大的是
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出去 D.再充入1mol CO2和3mol H2
⑥当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2.则c1
(3)减少温室气体排放的关键是节能减排,大力开发利用燃料电池就可以实现这一目标.如图2所示甲烷燃料电池(在上面).请回答:
①通入甲烷一极的电极反应式为
②随着电池不断放电,电解质溶液的pH
③通常情况下,甲烷燃料电池的能量利用率
④用该燃料电池以石墨电极电解2.0L 0.25 mol·L-1 CuSO4溶液,5min后在一个电极上有6.4gCu析出。则阳极的电极反应式为
A. CuSO4 B.H2O C.CuO D.CuCO3
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】近日,中国科学技术大学的江海龙教授调控催化剂中钴的价态,高选择性进行光催化还原CO2制备HCOOH。
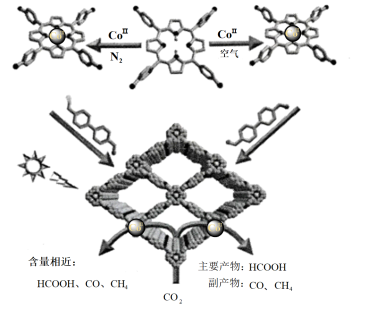
回答下列问题:
(1)根据图示可知,Co(II) →Co( III)中氧化剂是___________ ( 填化学式)。含Co(II)的催化剂对HCOOH的选择性___________ (填“ 高于”“低于”或“等于”)含Co( III)的催化剂。
(2)COF -367 – CoII和COF - 367 – CoIII催化CO2还原生成HCOOH的能垒图分别为a和b.注明: *代表吸附在催化剂表面,TS代表过渡态,能量单位为eV。

①CO2* +2H* =HCOOH * ΔH___________ 0(填“>”“<”或“=”)。
②在生成上述过渡态(TS)中,能垒最大为___________ eV。 COF - 367 – CoII和COF - 367 – CoIII中催化效能较高的是___________ (填“前者”或“后者”)。
(3)某催化剂作用下,CO2(g) + H2(g) HCOOH(g)的速率方程为 v正=k正c(CO2)·c(H2),v逆=k逆c(HCOOH)(k正、k逆为速率常数,只与温度、催化剂有关,与浓度无关)。某温度下,在容积均为2 L的恒容密闭容器甲、乙中投入下列物质,测得数据如表所示。
HCOOH(g)的速率方程为 v正=k正c(CO2)·c(H2),v逆=k逆c(HCOOH)(k正、k逆为速率常数,只与温度、催化剂有关,与浓度无关)。某温度下,在容积均为2 L的恒容密闭容器甲、乙中投入下列物质,测得数据如表所示。
 =
=___________ ,α___________ 50%(填“>”“<”或“=”)。
(4)在某催化剂作用下,向2 L恒容密闭反应器中充入1 mol CO2和2 mol H2发生如下反应:
主反应:CO2(g) +H2(g) HCOOH(g) ΔH >0
HCOOH(g) ΔH >0
副反应:CO2(g) +4H2(g) CH4(g) +2H2O(g) ΔH <0
CH4(g) +2H2O(g) ΔH <0
测得CO2的平衡转化率、HCOOH的选择性与温度关系如图所示。
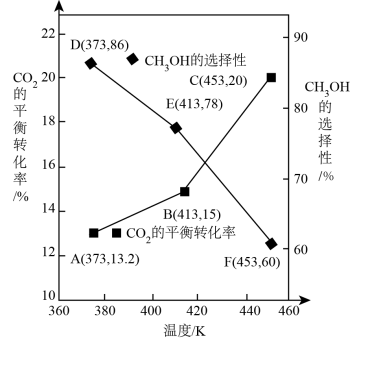
①已知:选择性等于HCOOH的物质的量与CO2转化的物质的量之比。其他条件不变,升高温度, CO2的平衡转化率增大的原因是___________ 。
②已知F点压强为27.2 kPa,主反应在F点对应的温度下,压强平衡常数Kp=___________ kPa-1(结果保留两位有效数字)。

回答下列问题:
(1)根据图示可知,Co(II) →Co( III)中氧化剂是
(2)COF -367 – CoII和COF - 367 – CoIII催化CO2还原生成HCOOH的能垒图分别为a和b.注明: *代表吸附在催化剂表面,TS代表过渡态,能量单位为eV。

①CO2* +2H* =HCOOH * ΔH
②在生成上述过渡态(TS)中,能垒最大为
(3)某催化剂作用下,CO2(g) + H2(g)
 HCOOH(g)的速率方程为 v正=k正c(CO2)·c(H2),v逆=k逆c(HCOOH)(k正、k逆为速率常数,只与温度、催化剂有关,与浓度无关)。某温度下,在容积均为2 L的恒容密闭容器甲、乙中投入下列物质,测得数据如表所示。
HCOOH(g)的速率方程为 v正=k正c(CO2)·c(H2),v逆=k逆c(HCOOH)(k正、k逆为速率常数,只与温度、催化剂有关,与浓度无关)。某温度下,在容积均为2 L的恒容密闭容器甲、乙中投入下列物质,测得数据如表所示。| 容器 | 起始投料/ mol | CO2的平衡转化率 | ||
| CO2 | H2 | HCOOH | ||
| 甲 | 1.0 | 1.0 | 0 | 50% |
| 乙 | 2.0 | 2.0 | 0 | α |
 =
=(4)在某催化剂作用下,向2 L恒容密闭反应器中充入1 mol CO2和2 mol H2发生如下反应:
主反应:CO2(g) +H2(g)
 HCOOH(g) ΔH >0
HCOOH(g) ΔH >0副反应:CO2(g) +4H2(g)
 CH4(g) +2H2O(g) ΔH <0
CH4(g) +2H2O(g) ΔH <0 测得CO2的平衡转化率、HCOOH的选择性与温度关系如图所示。

①已知:选择性等于HCOOH的物质的量与CO2转化的物质的量之比。其他条件不变,升高温度, CO2的平衡转化率增大的原因是
②已知F点压强为27.2 kPa,主反应在F点对应的温度下,压强平衡常数Kp=
您最近一年使用:0次
【推荐2】气候变化是人类面临的全球性问题,随着世界各国CO2排放,温室气体猛增,对全球生态系统产生较大破坏。我国积极参与国际社会碳减排,承诺2030前实现“碳达峰”,并积极布局“碳中和”, CO2的有效利用可以缓解温室效应。
(1)CO2催化合成甲醇是一种回收利用CO2很有前景的方法。如图1所示为该反应在无催化剂及有催化剂时的能量变化。由图可知,有催化剂存在的是过程____ 。(填“I”或“II”)

(2)一定条件下,由CO2和H2制备甲醇的过程中含有下列反应:
反应1:CO2(g)+H2(g) CO(g)+H2O(g) △H1
CO(g)+H2O(g) △H1
反应2:CO(g)+2H2(g) CH3OH(g) △H2
CH3OH(g) △H2
反应3:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
①其对应的平衡常数分别为K1、K2、K3,它们随温度变化的曲线如图2所示。则△H2____ △H3(填“大于”、“小于”或“等于”)。

②对于上述CO2加氢合成CH3OH的体系,下列说法错误的是____ (填标号)。
A.增大H2浓度有利于提高CO2的转化率
B.当气体的平均相对分子质量保持不变时,说明反应体系已达平衡
C.体系达平衡后,若压缩体积,则反应1平衡不移动,反应3平衡正向移动
D.选用合适的催化剂可以提高CH3OH在单位时间内的产量
(3)CO2和CH4也可以合理利用。在恒温恒容装置中通入等体积CO2和CH4,发生反应:CH4(g)+CO2(g) 2H2(g)+2CO(g) △H=+247.3kJ·mol-1,起始压强为p,达平衡时,CO2的平衡转化率为α。则该反应的平衡常数Kp=
2H2(g)+2CO(g) △H=+247.3kJ·mol-1,起始压强为p,达平衡时,CO2的平衡转化率为α。则该反应的平衡常数Kp=____ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
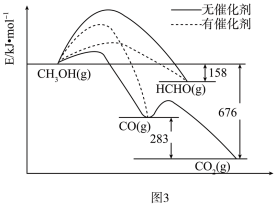
(4)甲醇是重要的化工原料,一定条件下1molCH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化如图3所示(反应物O2(g)和生成物H2O(g)(略去)。在有催化剂作用下,CH3OH与O2反应主要生成____ (填“CO”、“CO2”或“HCHO”)。
(5)近年来,有研究人员用CO2通过电催化生成多种燃料,实现CO2的回收利用,其工作原理如图4所示。

①请写出Cu电极上产生HCOOH的电极反应式:____ 。
②如果Cu电极上恰好只生成0.15molC2H4和0.30molCH3OH,则Pt电极上产生O2的物质的量为____ 。
(1)CO2催化合成甲醇是一种回收利用CO2很有前景的方法。如图1所示为该反应在无催化剂及有催化剂时的能量变化。由图可知,有催化剂存在的是过程

(2)一定条件下,由CO2和H2制备甲醇的过程中含有下列反应:
反应1:CO2(g)+H2(g)
 CO(g)+H2O(g) △H1
CO(g)+H2O(g) △H1反应2:CO(g)+2H2(g)
 CH3OH(g) △H2
CH3OH(g) △H2反应3:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3①其对应的平衡常数分别为K1、K2、K3,它们随温度变化的曲线如图2所示。则△H2

②对于上述CO2加氢合成CH3OH的体系,下列说法错误的是
A.增大H2浓度有利于提高CO2的转化率
B.当气体的平均相对分子质量保持不变时,说明反应体系已达平衡
C.体系达平衡后,若压缩体积,则反应1平衡不移动,反应3平衡正向移动
D.选用合适的催化剂可以提高CH3OH在单位时间内的产量
(3)CO2和CH4也可以合理利用。在恒温恒容装置中通入等体积CO2和CH4,发生反应:CH4(g)+CO2(g)
 2H2(g)+2CO(g) △H=+247.3kJ·mol-1,起始压强为p,达平衡时,CO2的平衡转化率为α。则该反应的平衡常数Kp=
2H2(g)+2CO(g) △H=+247.3kJ·mol-1,起始压强为p,达平衡时,CO2的平衡转化率为α。则该反应的平衡常数Kp=(4)甲醇是重要的化工原料,一定条件下1molCH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化如图3所示(反应物O2(g)和生成物H2O(g)(略去)。在有催化剂作用下,CH3OH与O2反应主要生成

(5)近年来,有研究人员用CO2通过电催化生成多种燃料,实现CO2的回收利用,其工作原理如图4所示。

①请写出Cu电极上产生HCOOH的电极反应式:
②如果Cu电极上恰好只生成0.15molC2H4和0.30molCH3OH,则Pt电极上产生O2的物质的量为
您最近一年使用:0次
【推荐3】氯气是现代工业的重要原料,将氯化氢转化为氯气的技术成为科学研究的热车点,回答下列问题:
(1)Deacon发明的直接氧化法为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。可按下列催化过程进行:
Ⅰ.CuCl2(s)=CuCl(s)+ Cl2(g) ΔH1=+83kJ·mol-1
Cl2(g) ΔH1=+83kJ·mol-1
Ⅱ.CuCl(s)+ O2(g)=CuO(s)+
O2(g)=CuO(s)+ Cl2(g) ΔH2=-20kJ·mol-1
Cl2(g) ΔH2=-20kJ·mol-1
Ⅲ.4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ΔH3
反应Ⅰ能自发进行的条件是___ 。利用ΔH1和ΔH2计算ΔH3时,还需要利用反应___ 的ΔH。
(2)如图为刚性容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1时HCl平衡转化率随温度变化的关系:

可知反应平衡常数K(400℃)__ K(500℃)(填“大于”或“小于”)。设容器内初始压强为p0,根据进料浓度比c(HCl):c(O2)=4:1的数据,计算400℃时容器内的平衡压强=___ (列出计算式)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比c(HCl):c(O2)过低、过高的不利影响分别是___ 。
(3)已知:氯气与NaOH溶液反应可生成NaClO3。有研究表明,生成NaClO3的反应分两步进行:
Ⅰ.2ClO-=ClO2-+Cl-
Ⅱ.ClO2-+ClO-=ClO3-+Cl-
常温下,反应Ⅱ能快速进行,但氯气与NaOH溶液反应很难得到NaClO3,试用碰撞理论解释其原因:___ 。
(4)电解NaClO3水溶液可制备NaClO4,写出阳极反应式:___ 。
(1)Deacon发明的直接氧化法为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。可按下列催化过程进行:
Ⅰ.CuCl2(s)=CuCl(s)+
 Cl2(g) ΔH1=+83kJ·mol-1
Cl2(g) ΔH1=+83kJ·mol-1Ⅱ.CuCl(s)+
 O2(g)=CuO(s)+
O2(g)=CuO(s)+ Cl2(g) ΔH2=-20kJ·mol-1
Cl2(g) ΔH2=-20kJ·mol-1Ⅲ.4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ΔH3
反应Ⅰ能自发进行的条件是
(2)如图为刚性容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1时HCl平衡转化率随温度变化的关系:

可知反应平衡常数K(400℃)
(3)已知:氯气与NaOH溶液反应可生成NaClO3。有研究表明,生成NaClO3的反应分两步进行:
Ⅰ.2ClO-=ClO2-+Cl-
Ⅱ.ClO2-+ClO-=ClO3-+Cl-
常温下,反应Ⅱ能快速进行,但氯气与NaOH溶液反应很难得到NaClO3,试用碰撞理论解释其原因:
(4)电解NaClO3水溶液可制备NaClO4,写出阳极反应式:
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】船舶柴油机发动机工作时,反应产生的 尾气是空气主要污染物之一,研究
尾气是空气主要污染物之一,研究 的转化方法和机理具有重要意义。
的转化方法和机理具有重要意义。
已知: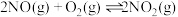





(1) 氧化脱除NO的总反应是
氧化脱除NO的总反应是
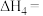
________ 。
(2)该反应过程有两步: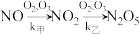 ,反应中各物质浓度变化如图所示。则速率常数
,反应中各物质浓度变化如图所示。则速率常数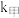
___________  (填“>”、“<”或“≈”),原因是
(填“>”、“<”或“≈”),原因是___________ 。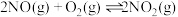 的反应历程分两步:
的反应历程分两步:
①则反应I与反应II的活化能:
___________ 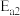 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
反应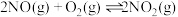 的平衡常数
的平衡常数
___________ (用 、
、 、
、 、
、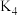 表示)。
表示)。
②在400k、初始压强为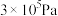 的恒温刚性容器中,按
的恒温刚性容器中,按 通入NO和
通入NO和 ,一定条件下发生反应。达平衡时NO转化率为90%,
,一定条件下发生反应。达平衡时NO转化率为90%, 转化率为40%。则
转化率为40%。则 的平衡常数
的平衡常数
___________ (分压=总压×物质的量分数;理想气体状态方程 ,
, )。
)。
(4)某研究小组将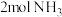 、
、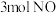 和一定量的
和一定量的 充入2L密闭容器中,在
充入2L密闭容器中,在 催化剂表面发生反应(
催化剂表面发生反应( ),NO的转化率随温度的变化情况如图所示:
),NO的转化率随温度的变化情况如图所示: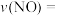
___________ (保留3位有效数字)。
②无氧条件下,NO生成 的转化率较低,原因可能是
的转化率较低,原因可能是___________ 。
 尾气是空气主要污染物之一,研究
尾气是空气主要污染物之一,研究 的转化方法和机理具有重要意义。
的转化方法和机理具有重要意义。已知:
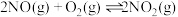





(1)
 氧化脱除NO的总反应是
氧化脱除NO的总反应是
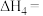
(2)该反应过程有两步:
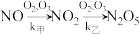 ,反应中各物质浓度变化如图所示。则速率常数
,反应中各物质浓度变化如图所示。则速率常数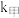
 (填“>”、“<”或“≈”),原因是
(填“>”、“<”或“≈”),原因是
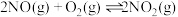 的反应历程分两步:
的反应历程分两步:| 步骤 | 反应 | 活化能 | 正反应速率方程 | 逆反应速率方程 |
| I |  (快) (快) |  | 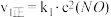 |  |
| II |  (慢) (慢) | 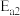 |  | 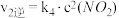 |

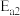 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。反应
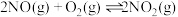 的平衡常数
的平衡常数
 、
、 、
、 、
、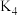 表示)。
表示)。②在400k、初始压强为
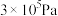 的恒温刚性容器中,按
的恒温刚性容器中,按 通入NO和
通入NO和 ,一定条件下发生反应。达平衡时NO转化率为90%,
,一定条件下发生反应。达平衡时NO转化率为90%, 转化率为40%。则
转化率为40%。则 的平衡常数
的平衡常数
 ,
, )。
)。(4)某研究小组将
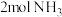 、
、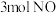 和一定量的
和一定量的 充入2L密闭容器中,在
充入2L密闭容器中,在 催化剂表面发生反应(
催化剂表面发生反应( ),NO的转化率随温度的变化情况如图所示:
),NO的转化率随温度的变化情况如图所示: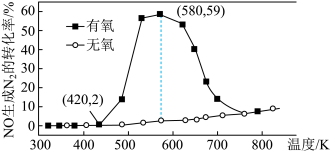
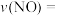
②无氧条件下,NO生成
 的转化率较低,原因可能是
的转化率较低,原因可能是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】CO、NO、NO2、SO2都是大气污染物,减少这些氧化物排放对于环境保护具有重要的意义。
已知下列热化学方程式
C(s)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol-1
N2(g)+2O2(g)=2NO2(g) ΔH2=+68kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH3=-221.0kJ·mol-1
(1)2NO2(g)+4CO(g)=4CO2(g)+N2(g)ΔH=__ kJ·mol-1。
①某温度下,在2L密闭容器中充入0.4molCO和0.6molNO2,此时容器的压强为2.0×105Pa,5s时,容器的压强变为原来的0.95倍,则从反应开始到5秒末NO2的平均反应速率v(NO2)=__ mol/(L·s)。
②下列能使该反应的反应速率增大,且平衡向正反应方向移动的是__ 。
A.适当升高温度
B.减小容器体积使体系压强增大
C.及时分离出CO2
D.向密闭容器中再充入0.4molNO2
(2)某温度下,下列反应的平衡常数如下:
a.2NO2(g)⇌N2(g)+2O2(g) K1=7.0×1016
b.2NO(g)⇌N2(g)+O2(g) K2=2.1×1030
反应2NO(g)+O2(g)⇌2NO2(g)的平衡常数K3=__ 。
(3)在催化剂作用下用CO还原NO2进行尾气处理。
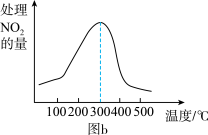
①相同条件下,选用A、B、C三种催化剂进行反应,生成N2的物质的量与时间变化如图a。活化能最小的是_ (用E(A)、E(B)、E(C)表示三种催化剂下该反应活化能)。

②在催化剂B作用下,测得相同时间内,处理NO2的量与温度的关系如图b。图中曲线先增大后减小,请说明后减小的原因___ (假设该温度范围内催化效率相同)。
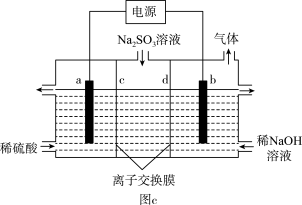
(4)煤燃烧产生的SO2用NaOH溶液吸收,将所得的Na2SO3溶液进行电解,可以制备H2SO4,其原理如图c所示(电极材料为石墨)。a电极反应式为__ 。b为_ (阴、阳)极,d离子交换膜为__ (阴、阳)离子交换膜。
已知下列热化学方程式
C(s)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol-1
N2(g)+2O2(g)=2NO2(g) ΔH2=+68kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH3=-221.0kJ·mol-1
(1)2NO2(g)+4CO(g)=4CO2(g)+N2(g)ΔH=
①某温度下,在2L密闭容器中充入0.4molCO和0.6molNO2,此时容器的压强为2.0×105Pa,5s时,容器的压强变为原来的0.95倍,则从反应开始到5秒末NO2的平均反应速率v(NO2)=
②下列能使该反应的反应速率增大,且平衡向正反应方向移动的是
A.适当升高温度
B.减小容器体积使体系压强增大
C.及时分离出CO2
D.向密闭容器中再充入0.4molNO2
(2)某温度下,下列反应的平衡常数如下:
a.2NO2(g)⇌N2(g)+2O2(g) K1=7.0×1016
b.2NO(g)⇌N2(g)+O2(g) K2=2.1×1030
反应2NO(g)+O2(g)⇌2NO2(g)的平衡常数K3=
(3)在催化剂作用下用CO还原NO2进行尾气处理。
①相同条件下,选用A、B、C三种催化剂进行反应,生成N2的物质的量与时间变化如图a。活化能最小的是

②在催化剂B作用下,测得相同时间内,处理NO2的量与温度的关系如图b。图中曲线先增大后减小,请说明后减小的原因

(4)煤燃烧产生的SO2用NaOH溶液吸收,将所得的Na2SO3溶液进行电解,可以制备H2SO4,其原理如图c所示(电极材料为石墨)。a电极反应式为

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】乙醇被广泛应用于能源、化工、食品等领域,工业上可用以下两种方法制备乙醇。
Ⅰ.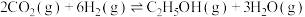 。一定条件下,在一密闭容器中充入
。一定条件下,在一密闭容器中充入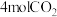 和
和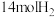 发生该反应,如图表示不同压强下
发生该反应,如图表示不同压强下 的平衡转化率与温度的关系。回答下列问题。
的平衡转化率与温度的关系。回答下列问题。
___________ 0(填“>”或“<”),
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(2)若在恒容绝热的容器中发生该反应,下列情况下反应一定达到平衡状态的是___________(填序号)。
Ⅱ.乙酸甲酯(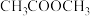 )催化加氢制取乙醇。包括以下主要反应:
)催化加氢制取乙醇。包括以下主要反应:
①

②
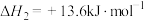
(3)已知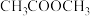 、
、 、
、 、
、 的燃烧热分别为
的燃烧热分别为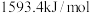 ,
,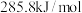 ,
,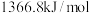 ,
,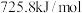 ,
,
___________ 。
(4)其他条件相同,将乙酸甲酯与氢气按一定流速通过固体催化剂表面,乙酸甲酯的转化率随氢酯比(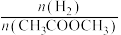 )的关系如图所示。已知固体催化剂作用下的反应速率与催化剂表面各反应物的吸附率有关。
)的关系如图所示。已知固体催化剂作用下的反应速率与催化剂表面各反应物的吸附率有关。___________ 。
(5)T℃时在1L密闭容器内通入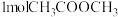 和
和 ,初始压强为100MPa,发生反应①和②,达到平衡时体系压强变成90MPa且
,初始压强为100MPa,发生反应①和②,达到平衡时体系压强变成90MPa且 的分压为
的分压为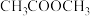 分压的5倍,反应①的平衡常数
分压的5倍,反应①的平衡常数
___________ 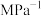 。
。
(6)研究发现,在酸性乙醇燃料电池中加入硝酸,可使电池持续大电流放电,工作原理如图。___________ 。
②当向正极通入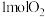 且全部被消耗时,理论上正负极溶液质量的变化差为
且全部被消耗时,理论上正负极溶液质量的变化差为___________ g(保留两位小数)。
Ⅰ.
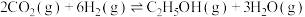 。一定条件下,在一密闭容器中充入
。一定条件下,在一密闭容器中充入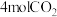 和
和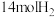 发生该反应,如图表示不同压强下
发生该反应,如图表示不同压强下 的平衡转化率与温度的关系。回答下列问题。
的平衡转化率与温度的关系。回答下列问题。


 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(2)若在恒容绝热的容器中发生该反应,下列情况下反应一定达到平衡状态的是___________(填序号)。
A.容器内 和 和 体积比不再改变 体积比不再改变 | B.容器内气体密度不再改变 |
| C.容器内温度不再发生改变 | D.断开 键与断开 键与断开 键的数目之比为2:3 键的数目之比为2:3 |
Ⅱ.乙酸甲酯(
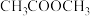 )催化加氢制取乙醇。包括以下主要反应:
)催化加氢制取乙醇。包括以下主要反应:①


②

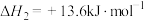
(3)已知
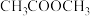 、
、 、
、 、
、 的燃烧热分别为
的燃烧热分别为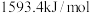 ,
,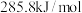 ,
,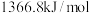 ,
,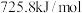 ,
,
(4)其他条件相同,将乙酸甲酯与氢气按一定流速通过固体催化剂表面,乙酸甲酯的转化率随氢酯比(
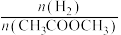 )的关系如图所示。已知固体催化剂作用下的反应速率与催化剂表面各反应物的吸附率有关。
)的关系如图所示。已知固体催化剂作用下的反应速率与催化剂表面各反应物的吸附率有关。
(5)T℃时在1L密闭容器内通入
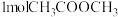 和
和 ,初始压强为100MPa,发生反应①和②,达到平衡时体系压强变成90MPa且
,初始压强为100MPa,发生反应①和②,达到平衡时体系压强变成90MPa且 的分压为
的分压为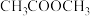 分压的5倍,反应①的平衡常数
分压的5倍,反应①的平衡常数
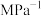 。
。(6)研究发现,在酸性乙醇燃料电池中加入硝酸,可使电池持续大电流放电,工作原理如图。

②当向正极通入
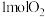 且全部被消耗时,理论上正负极溶液质量的变化差为
且全部被消耗时,理论上正负极溶液质量的变化差为
您最近一年使用:0次



