下列事实中,对调控化学反应速率的分析错误的是
A. 加热制氧气,加入少量 加热制氧气,加入少量 很快产生气体, 很快产生气体, 作催化剂 作催化剂 |
| B.黄铁矿煅烧时将矿粒粉碎有助于加快反应速率,增大反应物接触面积 |
| C.夏天的食品易霉变,冬天不易发生该现象,温度影响了化学反应速率 |
D.集气瓶中装有 和 和 的混合气体,在瓶外点燃镁条时发生爆炸,镁条作反应的催化剂 的混合气体,在瓶外点燃镁条时发生爆炸,镁条作反应的催化剂 |
更新时间:2023-06-15 15:38:17
|
【知识点】 影响化学反应速率的外因
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】在2.0 L恒温恒容密闭容器中充入2.0 mol N2和6.0 mol H2,加入催化剂发生反应:N2(g)+3H2(g) 2NH3(g),N2、H2的物质的量随时间的变化如下图所示。下列有关说法正确的是
2NH3(g),N2、H2的物质的量随时间的变化如下图所示。下列有关说法正确的是
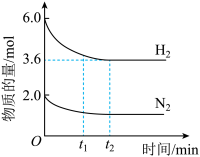
 2NH3(g),N2、H2的物质的量随时间的变化如下图所示。下列有关说法正确的是
2NH3(g),N2、H2的物质的量随时间的变化如下图所示。下列有关说法正确的是
| A.t1 min时,N2的生成速率等于N2的消耗速率 |
| B.使用催化剂可以缩短到达平衡时所需的时间 |
C.0~t2 min内,v(NH3)= mol·L−1·min−1 mol·L−1·min−1 |
| D.反应中通入足量的N2,可使H2完全转化为NH3 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】某研究小组用下图装置探究NaCl溶液对钢铁腐蚀的影响。

实验Ⅰ:向烧杯a、b中各加入30mL3.5%的NaCl溶液,闭合K,指针未发生偏转。加热烧杯a,指针向右偏转。
取a、b中溶液少量,滴加K3[Fe(CN)6]溶液,a中出现蓝色沉淀,b中无变化。改变NaCl溶液的浓度继续实验,记录如下:
查阅资料:在饱和NaCl溶液中O2浓度较低,钢铁不易被腐蚀。
下列说法不正确 的是:

实验Ⅰ:向烧杯a、b中各加入30mL3.5%的NaCl溶液,闭合K,指针未发生偏转。加热烧杯a,指针向右偏转。
取a、b中溶液少量,滴加K3[Fe(CN)6]溶液,a中出现蓝色沉淀,b中无变化。改变NaCl溶液的浓度继续实验,记录如下:
| 实验 | a | b | 指针偏转方向 |
| Ⅱ | 0.1% | 0.01% | 向右 |
| Ⅲ | 0.1% | 3.5% | 向左 |
| Ⅳ | 3.5% | 饱和溶液 | 向右 |
下列说法
| A.实验Ⅰ加热后,指针发生偏转的原因可能是温度升高,Fe还原性增强,反应速率加快 |
| B.实验Ⅱ中b作正极 |
| C.甲同学由实验Ⅱ、Ⅲ、Ⅳ得出结论NaCl溶液的浓度越大,Fe越容易被腐蚀 |
| D.根据上述实验,对钢铁腐蚀有影响的因素是:温度、NaCl溶液的浓度、O2的浓度 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐3】以H2O2和HCl为原料制备高纯度次氯酸的机理如图,V为元素钒,其最高化合价为+5, N(His404)、N(His496)为氨基酸,下列说法错误的是


| A.该机理中化合物A是催化剂 |
| B.反应过程中,钒的成键数目没有改变 |
| C.该催化循环过程中有氢氧键的断裂和形成 |
| D.制备机理的总反应的离子方程式为: H2O2+C1-+H+ =HClO+H2O |
您最近一年使用:0次



