对下列实验事实的理论解释不正确的
| 选项 | 实验事实 | 理论解释 |
| A | 环状S8分子结构如图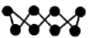 | S原子采取的杂化方式为sp3 |
| B | HF的沸点比HCl的高 | 键能:H—F>H—Cl |
| C | SO2易溶于水而难溶于CCl4 | SO2和水都是极性分子而CCl4为非极性分子 |
| D | Fe2+比Fe3+的稳定性小 | Fe2+和Fe3+的价电子排布式分别为3d6、3d5,Fe3+的3d能级为半充满的稳定结构 |
| A.A | B.B | C.C | D.D |
更新时间:2023-05-29 23:20:57
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】下列各项叙述错误的是
A.如果硫原子核外电子排布图为 ,则违反了泡利原理 ,则违反了泡利原理 |
| B.如果25号Mn元素的基态电子排布式为1s22s22p63s23p63d7,则违反了构造原理 |
C.氮原子的核外电子排布图为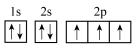 ,符合洪特规则和泡利原理 ,符合洪特规则和泡利原理 |
| D.泡利原理、洪特规则、构造原理都是对核外电子排布满足能量最低的要求 |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】下列各项叙述中,正确的是
| A.因H—Br键能大于H—Cl键能,故HBr的沸点高于HCl |
| B.电负性:F>N>H,因此键角大小为NF3>NH3 |
| C.与基态钾原子同周期且未成对电子数相同的元素还有4种 |
| D.水中的氢键可以表示为O—H···O,冰中每摩尔H2O有4NA个氢键 |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】石墨烯是一种由碳原子组成六角形呈蜂巢晶格的二维碳纳米材料(如图甲),石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(如图乙)。
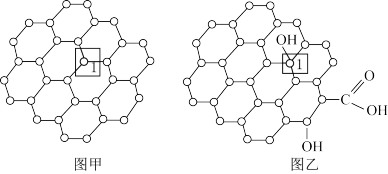
下列说法错误的是

下列说法错误的是
| A.图甲中,全为非极性共价键,图乙中,既有非极性共价键,也有极性共价键 |
| B.图乙中,1号C的杂化方式是sp2 |
| C.图甲中,1mol石墨烯中含有1.5mol的碳碳单键 |
| D.将50nm左右的石墨烯或氧化石墨烯溶于水,在相同条件下所得到的分散系后者更为稳定 |
您最近半年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】DDT的施用使疟蚊、跳蚤和苍蝇等得到有效的防治。但长期施用DDT,一些害虫体内会逐渐生成一种酶,使DDT发生催化反应脱去HCl生成DDE(如图所示):
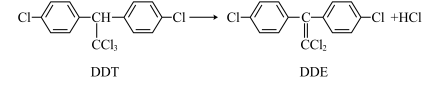
下列说法正确的是

下列说法正确的是
| A.DDT与DDE互为同系物 |
B.DDT中所有碳原子均为 杂化 杂化 |
| C.DDE中所有原子可能共面 |
| D.该反应的反应类型为取代反应 |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】下列事实与解释不相符 的是
| 选项 | 事实 | 解释 |
| A | 苯不能使酸性高锰酸钾溶液褪色 | 苯分子中含有大键而没有碳碳双键,大π键稳定性较强 |
| B | 过氧化氢分子是极性分子 | 过氧化氢分子中只含有极性键 |
| C | 金属具有导热性 | 当金属中存在温度差时,“自由电子”碰撞金属阳离子将能量进行传递 |
| D | 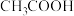 酸性弱于HCOOH 酸性弱于HCOOH | 电离程度乙酸较甲酸弱 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】下列探究方案能达到探究目的的是
| 选项 | 探究方案 | 探究目的 |
| A | 用毛皮摩擦过的带电橡胶靠近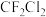 液流,液流方向改变 液流,液流方向改变 | 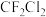 是极性分子 是极性分子 |
| B | 将铁锈溶于浓盐酸,滴入 溶液,紫色褪去 溶液,紫色褪去 | 铁锈中含有二价铁 |
| C | 石蜡油加强热,将产生的气体通入溴水,溴水颜色褪去 | 气体中含有乙烯 |
| D | 用pH计分别测0.1  NaClO和 NaClO和 溶液的pH,前者pH大 溶液的pH,前者pH大 |  |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
单选题
|
适中
(0.65)
【推荐1】由五种元素组成的某配离子是一种常用的有机催化剂,结构如图。X、Y、Z、M、Q五种元素原子序数依次增大,Y、Z、M同周期,基态Y原子各能级上的电子数相等,Q2+离子的价电子排布式为3d9。下列说法正确的是
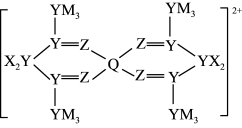

A.YZ 离子的空间构型为三角锥形 离子的空间构型为三角锥形 |
| B.Q的最高价氧化物对应的水化物能溶于强酸,不溶于任何碱 |
| C.Y和Z的简单氢化物的熔沸点:Z>Y |
| D.X2Z2在水中的溶解度小于其在CCl4中的溶解度 |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】下列对一些实验事实的理论解释正确的是
| 选项 | 实验事实 | 理论解释 |
| A | 1体积水可以溶解700体积氨气 | 氨是极性分子且有氢键的影响 |
| B | 白磷为正四面体分子 | 白磷分子中P-P键间的夹角是109.5° |
| C | SO2、H2O分子空间结构均为V形 | SO2、H2O中心原子均为sp3杂化 |
| D | HF的沸点高于HCl | H-F的键长比H-Cl的键长短 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次

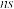 电子的能量不一定高于
电子的能量不一定高于 p电子的能量
p电子的能量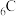 的电子排布式
的电子排布式 违反了洪特规则
违反了洪特规则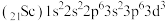 违反了构造原理
违反了构造原理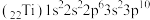 违反了泡利原理
违反了泡利原理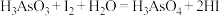 在碘量法分析中有重要应用。下列说法正确的是
在碘量法分析中有重要应用。下列说法正确的是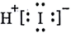

 (淀粉)。下列有关说法错误的是
(淀粉)。下列有关说法错误的是 分子中存在2个σ键和2个π键
分子中存在2个σ键和2个π键 和
和 均为极性分子
均为极性分子 、
、 和HCHO分子中的碳原子杂化方式各不相同
和HCHO分子中的碳原子杂化方式各不相同

