次磷酸钠( )在食品工业中用作防腐剂、抗氧化剂,也是一种很好的化学镀剂。请回答下列问题:
)在食品工业中用作防腐剂、抗氧化剂,也是一种很好的化学镀剂。请回答下列问题:
(1)次磷酸是一元弱酸( ),则次磷酸钠(
),则次磷酸钠( )属于
)属于__________ (填“正盐”“酸式盐”或“碱式盐”)。
(2)将待镀零件浸泡在 和
和 的混合溶液中,可达到化学镀镍的目的,该过程中
的混合溶液中,可达到化学镀镍的目的,该过程中 被氧化为二元弱酸
被氧化为二元弱酸 ,写出该反应的离子方程式:
,写出该反应的离子方程式:__________________ 。
(3)次磷酸钠的制备
将白磷( )和过量烧碱溶液混合加热,生成
)和过量烧碱溶液混合加热,生成 和
和 气体,
气体, 气体与NaClO溶液反应可生成次磷酸。实验装置如图所示(部分装置省略):
气体与NaClO溶液反应可生成次磷酸。实验装置如图所示(部分装置省略):__________ ,1 mol白磷中含有的共价键数目为__________ 。
②装置B的作用为_____________________ 。
③装置C中发生反应的化学方程式为__________________________________________ 。
④已知相关物质的溶解度如下表:
充分反应后,将A、C中溶液混合,将混合液(含极少量NaOH)蒸发浓缩,有大量杂质晶体析出,然后___________ ,得到含 的粗产品溶液,进一步处理得到粗产品。
的粗产品溶液,进一步处理得到粗产品。
(4)产品纯度的计算
取1.00g粗产品配成100mL溶液,取25.00mL于锥形瓶中,酸化后加入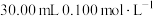 碘水,充分反应,然后以淀粉溶液作指示剂,用
碘水,充分反应,然后以淀粉溶液作指示剂,用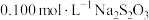 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液24.00mL,相关反应的方程式为
溶液24.00mL,相关反应的方程式为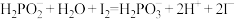 、
、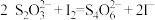 ,则产品纯度为
,则产品纯度为__________ 。
 )在食品工业中用作防腐剂、抗氧化剂,也是一种很好的化学镀剂。请回答下列问题:
)在食品工业中用作防腐剂、抗氧化剂,也是一种很好的化学镀剂。请回答下列问题:(1)次磷酸是一元弱酸(
 ),则次磷酸钠(
),则次磷酸钠( )属于
)属于(2)将待镀零件浸泡在
 和
和 的混合溶液中,可达到化学镀镍的目的,该过程中
的混合溶液中,可达到化学镀镍的目的,该过程中 被氧化为二元弱酸
被氧化为二元弱酸 ,写出该反应的离子方程式:
,写出该反应的离子方程式:(3)次磷酸钠的制备
将白磷(
 )和过量烧碱溶液混合加热,生成
)和过量烧碱溶液混合加热,生成 和
和 气体,
气体, 气体与NaClO溶液反应可生成次磷酸。实验装置如图所示(部分装置省略):
气体与NaClO溶液反应可生成次磷酸。实验装置如图所示(部分装置省略):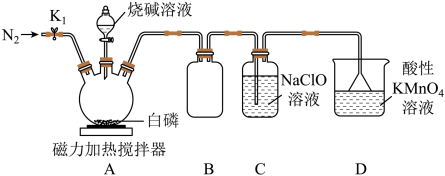
②装置B的作用为
③装置C中发生反应的化学方程式为
④已知相关物质的溶解度如下表:
溶解度/g 物质 | 25℃ | 100℃ |
NaCl | 37 | 39 |
| 100 | 667 |
 的粗产品溶液,进一步处理得到粗产品。
的粗产品溶液,进一步处理得到粗产品。(4)产品纯度的计算
取1.00g粗产品配成100mL溶液,取25.00mL于锥形瓶中,酸化后加入
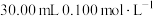 碘水,充分反应,然后以淀粉溶液作指示剂,用
碘水,充分反应,然后以淀粉溶液作指示剂,用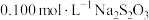 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液24.00mL,相关反应的方程式为
溶液24.00mL,相关反应的方程式为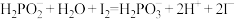 、
、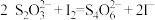 ,则产品纯度为
,则产品纯度为
更新时间:2023-07-08 13:49:59
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】用主要成分为 的矿石(杂质为
的矿石(杂质为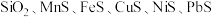 等)制取锰的流程如图所示。
等)制取锰的流程如图所示。

已知:流程中相关金属离子开始沉淀和完全沉淀的 如下:
如下:
(1)焙烧中 参与反应的化学方程式为
参与反应的化学方程式为___________ 。
(2)氧化过程中反应的离子方程式为___________ 。
(3)调 的目的是除去
的目的是除去 ,则
,则 的调控范围是
的调控范围是___________ ;加入 的目的是除去
的目的是除去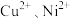 ,则除
,则除 转化的离子方程式为
转化的离子方程式为___________ 。
(4)电解中生成 的电极反应式为
的电极反应式为___________ 。
 的矿石(杂质为
的矿石(杂质为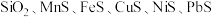 等)制取锰的流程如图所示。
等)制取锰的流程如图所示。
已知:流程中相关金属离子开始沉淀和完全沉淀的
 如下:
如下:| 金属离子 |  |  |  |  |  |
开始沉淀的 | 2.2 | 7.5 | 7.9 | 7.8 | 4.4 |
完全沉淀的 | 3.5 | 9.5 | 9.0 | 10.4 | 5.8 |
 参与反应的化学方程式为
参与反应的化学方程式为(2)氧化过程中反应的离子方程式为
(3)调
 的目的是除去
的目的是除去 ,则
,则 的调控范围是
的调控范围是 的目的是除去
的目的是除去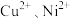 ,则除
,则除 转化的离子方程式为
转化的离子方程式为(4)电解中生成
 的电极反应式为
的电极反应式为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】高铁酸钾(K2FeO4)可做饮用水消毒剂。以废铁屑(表面带油污)为原料制备K2FeO4的流程如图:

回答下列问题:
(1)高铁酸钾中Fe元素的化合价为____ 。
(2)“碱洗”步骤的目的是____ 。
(3)“沉铁”步骤加入H2O2溶液,其对应反应的离子方程式为____ 。
(4)“氧化”步骤对应的化学方程式为____ 。
(5)该流程中可以循环利用的物质是____ (填化学式)。
(6)Zn和K2FeO4可以组成高铁电池,电池工作原理如图所示,正极的电极反应式为____ 。


回答下列问题:
(1)高铁酸钾中Fe元素的化合价为
(2)“碱洗”步骤的目的是
(3)“沉铁”步骤加入H2O2溶液,其对应反应的离子方程式为
(4)“氧化”步骤对应的化学方程式为
(5)该流程中可以循环利用的物质是
(6)Zn和K2FeO4可以组成高铁电池,电池工作原理如图所示,正极的电极反应式为

您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】硫酸铅广泛应用于制造铅蓄电池、白色颜料等。工业生产中利用方铅矿(主要成分为PbS,含有FeS2等杂质)制备PbSO4的工艺流程如下:

已知:1.PbCl2难溶于冷水,易溶于热水;2.PbCl2(s)+2Cl—(aq) PbCl
PbCl (aq)
(aq)
(1)“浸取”时需要加热,该过程中盐酸与MnO2、PbS发生反应生成PbCl2和S的化学方程式为_______ ,结合原理分析饱和食盐水的作用_______ 。
(2)“沉淀”中获得PbCl2采取的措施是_______ 。(答出一条即可)
(3)“滤液a”经过处理后可以返回到_______ 工序循环使用。
(4)硫酸铅广泛应用于制造铅蓄电池,铅蓄电池正极材料是_______ ,电解质溶液为_______ ,充电时阴极反应式为_______ 。

已知:1.PbCl2难溶于冷水,易溶于热水;2.PbCl2(s)+2Cl—(aq)
 PbCl
PbCl (aq)
(aq)(1)“浸取”时需要加热,该过程中盐酸与MnO2、PbS发生反应生成PbCl2和S的化学方程式为
(2)“沉淀”中获得PbCl2采取的措施是
(3)“滤液a”经过处理后可以返回到
(4)硫酸铅广泛应用于制造铅蓄电池,铅蓄电池正极材料是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】随着钴酸锂电池的普及使用,从废旧的钴酸锂电池中提取锂、钴等金属材料意义重大。如图是废旧钻酸锂(LiCoO2)(含少量铁、铝、铜等元素的化合物)回收工艺流程:
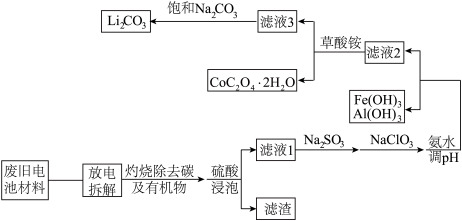
(1)“拆解”前需进入“放电”处理的目的是__ ;用食盐水浸泡是放电的常用方法,浸泡放电过程中产生的气体主要有__ 。
(2)上述流程中将CoO2-转化为Co3+的离子方程式为__ 。
(3)滤液1中加入Na2SO3的主要目的是__ ;加入NaClO3的主要目的是__ 。
(4)“沉钴”过程中,(NH4)2C2O4的加入量(图a)、沉淀反应的温度(图b)与钴的沉淀率关系如图所示:

根据图分析:沉钴时应控制n(C2O42-):n(Co2+)比为__ ,温度控制在__ ℃左右。

(1)“拆解”前需进入“放电”处理的目的是
(2)上述流程中将CoO2-转化为Co3+的离子方程式为
(3)滤液1中加入Na2SO3的主要目的是
(4)“沉钴”过程中,(NH4)2C2O4的加入量(图a)、沉淀反应的温度(图b)与钴的沉淀率关系如图所示:

根据图分析:沉钴时应控制n(C2O42-):n(Co2+)比为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)制取金属锌的流程如图所示。回答下列问题:
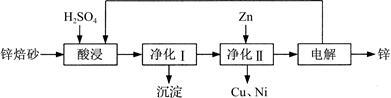
(1)酸浸时ZnFe2O4会生成两种盐,该反应的化学方程式为____ 。
(2)净化Ⅰ操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,使Fe3+转化为Fe(OH)3沉淀。
①写出酸性条件下H2O2与Fe2+反应的离子方程式:____ 。
②25 ℃时,pH=3的溶液中,c(Fe3+)=________ mol·L-1(已知25 ℃,Ksp[Fe( OH)3]=4.0×10-38)。
③净化Ⅰ生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是____________ 。
(3)若没有净化Ⅱ操作,则对锌的制备带来的影响是____ 。
(4)本流程中可以循环利用的物质除锌外还有________ 。

(1)酸浸时ZnFe2O4会生成两种盐,该反应的化学方程式为
(2)净化Ⅰ操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,使Fe3+转化为Fe(OH)3沉淀。
①写出酸性条件下H2O2与Fe2+反应的离子方程式:
②25 ℃时,pH=3的溶液中,c(Fe3+)=
③净化Ⅰ生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是
(3)若没有净化Ⅱ操作,则对锌的制备带来的影响是
(4)本流程中可以循环利用的物质除锌外还有
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐3】磷酸亚铁锂(LiFePO4)电池工作电压适中、放电功率高、在高温和高热环境下的稳定性高,是新能源汽车的动力电池之一、一种利用硫酸法生产钛白粉过程的副产物硫酸亚铁(含钛、铜、锰、铅、锌、钙、镁等杂质离子)制备磷酸亚铁锂的生产流程如图:
已知:FePO4可溶于pH小于2的酸性溶液。
回答下列问题:
(1)铁在元素周期中的位置是___________ ,FePO4·2H2O中Fe元素的化合价是___________ 。
(2)操作2的名称是___________ 。
(3)TiO2是一种白色颜料,用TiCl4制备TiO2·xH2O的化学方程式是___________ 。
(4)滤液2与磷酸、双氧水生成FePO4·2H2O的离子方程式为___________ ,向滤液2中加入NaOH溶液调节溶液的pH,将溶液的pH控制在2.0的原因是___________ 。
(5)聚丙烯的作用是___________ 。
(6)LiFePO4的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成4个正八面体和4个正四面体,电池充电时,LiFePO4作极___________ (“阴”或“阳”),脱出部分Li+,进而转化为Li1-xFePO4,Li1-xFePO4结构示意图如(b)所示,则其中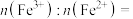
___________ 。

| 物质 | FeS | Mns | CuS | PbS | ZnS |
| Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-36 | 3.4×10-28 | 1.6×10-24 |
回答下列问题:
(1)铁在元素周期中的位置是
(2)操作2的名称是
(3)TiO2是一种白色颜料,用TiCl4制备TiO2·xH2O的化学方程式是
(4)滤液2与磷酸、双氧水生成FePO4·2H2O的离子方程式为
(5)聚丙烯的作用是
(6)LiFePO4的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成4个正八面体和4个正四面体,电池充电时,LiFePO4作极
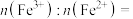

您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】实验室以碳酸锰矿(含MnCO3及少量Fe、Al、Si等氧化物)为原料制高纯MnCO3和MnO2的流程如下:

(1)焙烧时的温度为300~500℃,写出焙烧时MnCO3所发生反应的化学方程式:______ 。
(2)焙烧前需测定碳酸锰矿中MnCO3的含量,测定过程如下:称取0.2000g碳酸锰矿粉于锥形瓶中,加入15mL磷酸,加热并不断摇动至矿粉溶解,加入NH4NO3将溶液中的Mn2+转化为Mn(PO4) ,待冷却至室温后,加入40mL蒸馏水,滴加2滴N苯代邻胺基苯甲酸作指示剂,用0.02000mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点[滴定过程中Mn(PO4)
,待冷却至室温后,加入40mL蒸馏水,滴加2滴N苯代邻胺基苯甲酸作指示剂,用0.02000mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点[滴定过程中Mn(PO4) 与Fe2+反应生成Mn2+和Fe3+],消耗(NH4)2Fe(SO4)2标准溶液30.00mL。计算碳酸锰矿中MnCO3的含量
与Fe2+反应生成Mn2+和Fe3+],消耗(NH4)2Fe(SO4)2标准溶液30.00mL。计算碳酸锰矿中MnCO3的含量___________ (写出计算过程)。
(3)将过滤后所得溶液净化后可得MnSO4溶液。
①将净化后MnSO4溶液置于如图所示三颈烧瓶中,控制一定的温度,将沉淀剂滴加到烧瓶中,充分反应后过滤、洗涤、干燥可得MnCO3白色粉末。沉淀剂可以使用Na2CO3溶液、NH4HCO3溶液或NH4HCO3与氨水的混合溶液。实验小组经过比较后使用的是NH4HCO3与氨水的混合溶液。
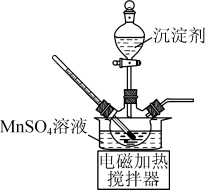
a.不使用Na2CO3溶液的原因是___________ 。
b.不使用NH4HCO3溶液的原因是___________ 。
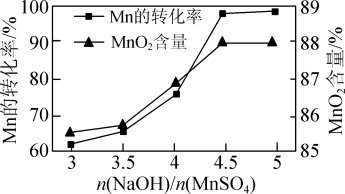
②已知MnSO4可发生如下反应:MnSO4+K2S2O8+4NaOH=MnO2↓+K2SO4+2Na2SO4+2H2O,MnSO4和K2S2O8的物质的量相同,改变NaOH的物质的量,测得Mn的转化率、MnO2的含量{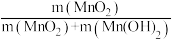 }与NaOH和MnSO4物质的量比值之间的关系如图所示。根据信息,补充完整制取纯净MnO2的实验方案:将20mL 1.0mol·L-1的MnSO4溶液和20mL 1.0mol·L-1的K2S2O8溶液混合,
}与NaOH和MnSO4物质的量比值之间的关系如图所示。根据信息,补充完整制取纯净MnO2的实验方案:将20mL 1.0mol·L-1的MnSO4溶液和20mL 1.0mol·L-1的K2S2O8溶液混合,___________ ,得到纯净的MnO2(实验中可使用的试剂是1.0mol·L-1 NaOH溶液、1.0mol·L-1 H2SO4溶液、1.0mol·L-1 BaCl2溶液)。

(1)焙烧时的温度为300~500℃,写出焙烧时MnCO3所发生反应的化学方程式:
(2)焙烧前需测定碳酸锰矿中MnCO3的含量,测定过程如下:称取0.2000g碳酸锰矿粉于锥形瓶中,加入15mL磷酸,加热并不断摇动至矿粉溶解,加入NH4NO3将溶液中的Mn2+转化为Mn(PO4)
 ,待冷却至室温后,加入40mL蒸馏水,滴加2滴N苯代邻胺基苯甲酸作指示剂,用0.02000mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点[滴定过程中Mn(PO4)
,待冷却至室温后,加入40mL蒸馏水,滴加2滴N苯代邻胺基苯甲酸作指示剂,用0.02000mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点[滴定过程中Mn(PO4) 与Fe2+反应生成Mn2+和Fe3+],消耗(NH4)2Fe(SO4)2标准溶液30.00mL。计算碳酸锰矿中MnCO3的含量
与Fe2+反应生成Mn2+和Fe3+],消耗(NH4)2Fe(SO4)2标准溶液30.00mL。计算碳酸锰矿中MnCO3的含量(3)将过滤后所得溶液净化后可得MnSO4溶液。
①将净化后MnSO4溶液置于如图所示三颈烧瓶中,控制一定的温度,将沉淀剂滴加到烧瓶中,充分反应后过滤、洗涤、干燥可得MnCO3白色粉末。沉淀剂可以使用Na2CO3溶液、NH4HCO3溶液或NH4HCO3与氨水的混合溶液。实验小组经过比较后使用的是NH4HCO3与氨水的混合溶液。

a.不使用Na2CO3溶液的原因是
b.不使用NH4HCO3溶液的原因是
②已知MnSO4可发生如下反应:MnSO4+K2S2O8+4NaOH=MnO2↓+K2SO4+2Na2SO4+2H2O,MnSO4和K2S2O8的物质的量相同,改变NaOH的物质的量,测得Mn的转化率、MnO2的含量{
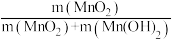 }与NaOH和MnSO4物质的量比值之间的关系如图所示。根据信息,补充完整制取纯净MnO2的实验方案:将20mL 1.0mol·L-1的MnSO4溶液和20mL 1.0mol·L-1的K2S2O8溶液混合,
}与NaOH和MnSO4物质的量比值之间的关系如图所示。根据信息,补充完整制取纯净MnO2的实验方案:将20mL 1.0mol·L-1的MnSO4溶液和20mL 1.0mol·L-1的K2S2O8溶液混合,
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】红矾钠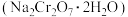 与铬酸钡
与铬酸钡 都是重要的化工产品.工业上以铬铁矿[主要成分为
都是重要的化工产品.工业上以铬铁矿[主要成分为 ,还含有少量
,还含有少量 和
和 ]为原料制备红矾钠与铬酸钡的工艺流程如图所示.
]为原料制备红矾钠与铬酸钡的工艺流程如图所示.

“氧化煅烧”中涉及的主要反应有:
主反应:
副反应: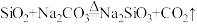 ;
;
回答下列问题:
(1) 中Cr的化合价为+3价,则Fe的化合价为
中Cr的化合价为+3价,则Fe的化合价为______ ;化学上可将某些盐写成氧化物的形式,如 可写成
可写成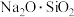 ,则
,则 可写成
可写成______ 。
(2)“氧化煅烧”是在回转窑中进行,煅烧时需不断搅拌,搅拌的作用是______ 。
(3)“氧化煅烧”时加入的纯碱是过量的,则“滤渣1”的主要成分是______ (填化学式)。
(4)“浓缩、酸化”时加硫酸酸化的目的是______ 。
(5)步骤Ⅶ采用“冷却结晶”的目的是______ 。
(6) 常用于颜料、陶瓷、橡胶等工业.实验室可用
常用于颜料、陶瓷、橡胶等工业.实验室可用 制备
制备 。
。
①制备
将 加入过量浓盐酸与无水乙醇的混合溶液中,水浴加热,充分反应生成
加入过量浓盐酸与无水乙醇的混合溶液中,水浴加热,充分反应生成 ,且逸出的气体中只有
,且逸出的气体中只有 ,该反应的化学方程式为
,该反应的化学方程式为______ 。
②制备
Cr(III)存在形态的物质的量分数随溶液 的分布如图所示。
的分布如图所示。

由步骤①得到的 溶液制得
溶液制得 晶体的实验方案:取步骤①得到的
晶体的实验方案:取步骤①得到的 溶液,______,低温烘干,得到
溶液,______,低温烘干,得到 晶体.[实验中需使用的试剂:
晶体.[实验中需使用的试剂:
 溶液、
溶液、 溶液、
溶液、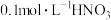 溶液、蒸馏水]
溶液、蒸馏水]
请补充完整实验步骤:______ 。
③测定 样品纯度
样品纯度
准确称取0.9g样品,溶于过量硫酸并配成250mL溶液.取25.00mL溶液,用足量 溶液将
溶液将 氧化为
氧化为 ,煮沸除去过量的
,煮沸除去过量的 ,冷却至室温.再加入过量KI溶液,以淀粉溶液为指示剂,用
,冷却至室温.再加入过量KI溶液,以淀粉溶液为指示剂,用 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液24.00mL.则
溶液24.00mL.则 样品的纯度为
样品的纯度为______ 。(保留四位有效数字)
已知反应: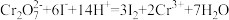 ;
; 。
。
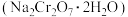 与铬酸钡
与铬酸钡 都是重要的化工产品.工业上以铬铁矿[主要成分为
都是重要的化工产品.工业上以铬铁矿[主要成分为 ,还含有少量
,还含有少量 和
和 ]为原料制备红矾钠与铬酸钡的工艺流程如图所示.
]为原料制备红矾钠与铬酸钡的工艺流程如图所示.
“氧化煅烧”中涉及的主要反应有:
主反应:

副反应:
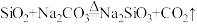 ;
;
回答下列问题:
(1)
 中Cr的化合价为+3价,则Fe的化合价为
中Cr的化合价为+3价,则Fe的化合价为 可写成
可写成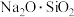 ,则
,则 可写成
可写成(2)“氧化煅烧”是在回转窑中进行,煅烧时需不断搅拌,搅拌的作用是
(3)“氧化煅烧”时加入的纯碱是过量的,则“滤渣1”的主要成分是
(4)“浓缩、酸化”时加硫酸酸化的目的是
(5)步骤Ⅶ采用“冷却结晶”的目的是
(6)
 常用于颜料、陶瓷、橡胶等工业.实验室可用
常用于颜料、陶瓷、橡胶等工业.实验室可用 制备
制备 。
。①制备

将
 加入过量浓盐酸与无水乙醇的混合溶液中,水浴加热,充分反应生成
加入过量浓盐酸与无水乙醇的混合溶液中,水浴加热,充分反应生成 ,且逸出的气体中只有
,且逸出的气体中只有 ,该反应的化学方程式为
,该反应的化学方程式为②制备

Cr(III)存在形态的物质的量分数随溶液
 的分布如图所示。
的分布如图所示。
由步骤①得到的
 溶液制得
溶液制得 晶体的实验方案:取步骤①得到的
晶体的实验方案:取步骤①得到的 溶液,______,低温烘干,得到
溶液,______,低温烘干,得到 晶体.[实验中需使用的试剂:
晶体.[实验中需使用的试剂:
 溶液、
溶液、 溶液、
溶液、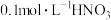 溶液、蒸馏水]
溶液、蒸馏水]请补充完整实验步骤:
③测定
 样品纯度
样品纯度准确称取0.9g样品,溶于过量硫酸并配成250mL溶液.取25.00mL溶液,用足量
 溶液将
溶液将 氧化为
氧化为 ,煮沸除去过量的
,煮沸除去过量的 ,冷却至室温.再加入过量KI溶液,以淀粉溶液为指示剂,用
,冷却至室温.再加入过量KI溶液,以淀粉溶液为指示剂,用 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液24.00mL.则
溶液24.00mL.则 样品的纯度为
样品的纯度为已知反应:
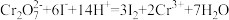 ;
; 。
。
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐3】过氧乙酸( )是无色透明液体,常用于速效漂白和消毒,氧化性比
)是无色透明液体,常用于速效漂白和消毒,氧化性比 强,与酸性
强,与酸性 相近。某课外实验小组同学用
相近。某课外实验小组同学用 溶液与乙酸酐制备高浓度过氧乙酸并对其含量测定,实验过程如下。
溶液与乙酸酐制备高浓度过氧乙酸并对其含量测定,实验过程如下。
 。
。Ⅰ.过氧化氢的浓缩:
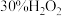 溶液浓缩至75%(
溶液浓缩至75%( 沸点150.2℃):浓缩装置如下图所示(连接用橡胶管和支持仪器以及抽气泵已省略):
沸点150.2℃):浓缩装置如下图所示(连接用橡胶管和支持仪器以及抽气泵已省略):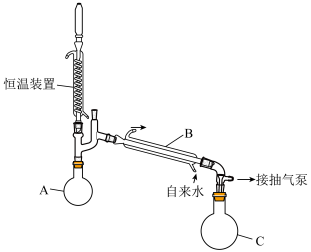
 溶液主要在
溶液主要在(2)该实验过程操作的正确顺序是
_______→_______→_______→_______→③→④
①水浴加热;②连接装置;③抽真空后向冷凝管中通水;
④自滴液漏斗往烧瓶中缓慢滴加
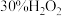 溶液;
溶液;⑤在滴液漏斗中装入
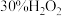 溶液;
溶液;⑥检查装置气密性。
Ⅱ.过氧乙酸的制备:如下图所示,搅拌器不断搅拌下,向三颈烧瓶中加入45mL乙酸酐,逐步滴加
 溶液25mL(过量),再加1mL浓硫酸,搅拌4小时,室温静置15小时即得47%的过氧乙酸溶液。
溶液25mL(过量),再加1mL浓硫酸,搅拌4小时,室温静置15小时即得47%的过氧乙酸溶液。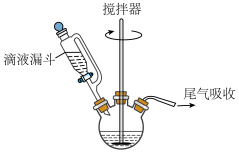
(4)实验中,利用搅拌器充分搅拌的作用是
(5)乙酸酐与
 反应的尾气可以用
反应的尾气可以用Ⅲ.过氧乙酸(含杂质)的含量测定:取适量样品按下图所示步骤依次进行实验,测定过氧乙酸的含量。

 溶液恰好除尽
溶液恰好除尽 的实验现象是
的实验现象是②第3步中过氧乙酸可被
 还原为乙酸,其离子方程式为
还原为乙酸,其离子方程式为③若实验中所取样品体积为
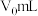 ,第3步中加入
,第3步中加入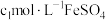 溶液
溶液 ,第4步滴定中消耗
,第4步滴定中消耗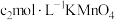 溶液
溶液 ,则过氧乙酸含量为
,则过氧乙酸含量为 。
。
您最近一年使用:0次



