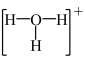
锰是国家紧缺战略矿产资源,广泛用于新能源、新材料等战略新兴产业,贵州地矿局研发的“气液喷溢沉积型锰矿”的找矿勘查关键技术体系,荣获贵州省2022年度十大科技创新成果。黔东地区集中分布的富锰矿床资源主体是菱锰矿( )。工业上可用菱锰矿生产锰的一种配合物
)。工业上可用菱锰矿生产锰的一种配合物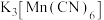 ,其主要应用于制药、电镀、造纸、钢铁生产。
,其主要应用于制药、电镀、造纸、钢铁生产。
(1)Mn元素在周期表中的位置为_____ ,基态Mn原子价电子排布式为_____ ,基态N原子核外电子空间运动状态有_____ 种。
(2)C、N、O三种元素中电负性最小的是_____ ,第一电离能最大的是_____ (填元素符号), 中的键角大小为
中的键角大小为_____ 。
(3)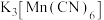 中Mn的化合价为+3价,则C的化合价为
中Mn的化合价为+3价,则C的化合价为_____ ,配体为_____ ,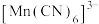 中
中 键与
键与 键的数目之比为
键的数目之比为_____ 。
 )。工业上可用菱锰矿生产锰的一种配合物
)。工业上可用菱锰矿生产锰的一种配合物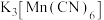 ,其主要应用于制药、电镀、造纸、钢铁生产。
,其主要应用于制药、电镀、造纸、钢铁生产。(1)Mn元素在周期表中的位置为
(2)C、N、O三种元素中电负性最小的是
 中的键角大小为
中的键角大小为(3)
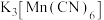 中Mn的化合价为+3价,则C的化合价为
中Mn的化合价为+3价,则C的化合价为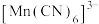 中
中 键与
键与 键的数目之比为
键的数目之比为
更新时间:2023-07-08 08:05:44
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】C和Si元素在化学中占有极其重要的地位。
(1)写出Si的基态原子核外电子排布式___________ 。C、Si和O元素的电负性由大至小的顺序为___________ 。
(2)SiC的晶体结构与晶体硅相似,其中C原子的杂化方式为___________ ,微粒间存在的作用力是___________ ;lmol硅晶体中有___________ molSi-Si键。
(3)氧化物MO的电子总数与SiC的相等,则M为___________ (填元素符号)。MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MO的熔点比CaO的高,其原因是___________ 。
(4)C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同。CO2中C与O原子间形成σ键和π键,SiO2中Si与О原子间不形成上述π键。从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述π键?___________ 。
(1)写出Si的基态原子核外电子排布式
(2)SiC的晶体结构与晶体硅相似,其中C原子的杂化方式为
(3)氧化物MO的电子总数与SiC的相等,则M为
(4)C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同。CO2中C与O原子间形成σ键和π键,SiO2中Si与О原子间不形成上述π键。从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述π键?
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】请在标有序号的空白处填空。
(1)可正确表示原子轨道的是_____ 。
A.2s B.2d C.3Px D.3f
(2)写出基态镓(31Ga)原子的电子排布式:__________________ 。
(3)下列物质变化,只与范德华力有关的是__________ 。
A.干冰熔化 B.乙酸汽化 C.乙醇溶于水 D.碘溶于四氯化碳
(4)下列物质中,只含有极性键的分子是___________ ,既含离子键又含共价键的化合物是_______ ;只存在σ键的分子是________ ,同时存在σ键和π键的分子是_____ 。
A.N2 B.CO2 C.CH2Cl2 D.C2H4 E.C2H6 F.CaCl2 G.NH4Cl
(5)Na、Mg、Al第一电离能的由大到小的顺序:__________________ ;
(1)可正确表示原子轨道的是
A.2s B.2d C.3Px D.3f
(2)写出基态镓(31Ga)原子的电子排布式:
(3)下列物质变化,只与范德华力有关的是
A.干冰熔化 B.乙酸汽化 C.乙醇溶于水 D.碘溶于四氯化碳
(4)下列物质中,只含有极性键的分子是
A.N2 B.CO2 C.CH2Cl2 D.C2H4 E.C2H6 F.CaCl2 G.NH4Cl
(5)Na、Mg、Al第一电离能的由大到小的顺序:
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】下表为元素周期表的一部分,其中字母代表相应的元素。

试回答下列问题:
(1)元素h的基态原子的核外电子排布式为_______ 。
(2)c、d、e、f元素原子的第一电离能( )由小到大的顺序为
)由小到大的顺序为_______ (用相应元素符号表示)。
(3)表中所列的元素之间可以形成多种化合物,其中邻甲基苯甲醛( )分子中碳原子轨道的杂化类型为
)分子中碳原子轨道的杂化类型为_____ 。1mol苯甲醛( )分子中含有σ键的物质的量为
)分子中含有σ键的物质的量为______ mol。
(4)一种由表中元素形成的离子与单质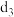 互为等电子体,其离子符号为
互为等电子体,其离子符号为_______ 。

试回答下列问题:
(1)元素h的基态原子的核外电子排布式为
(2)c、d、e、f元素原子的第一电离能(
 )由小到大的顺序为
)由小到大的顺序为(3)表中所列的元素之间可以形成多种化合物,其中邻甲基苯甲醛(
 )分子中碳原子轨道的杂化类型为
)分子中碳原子轨道的杂化类型为 )分子中含有σ键的物质的量为
)分子中含有σ键的物质的量为(4)一种由表中元素形成的离子与单质
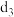 互为等电子体,其离子符号为
互为等电子体,其离子符号为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】NOx是空气的污染物,废水中的氨氮(以NH3、NH 存在)和硝态氮(以NO
存在)和硝态氮(以NO 、NO
、NO 存在)会引起水体富营养化,需经处理后才能排放。
存在)会引起水体富营养化,需经处理后才能排放。
(1)电解氧化吸收法可将废气中的 NOx转变为NO 。电解 0.1 mol·L-1NaCl 溶液时,溶液中相关成分的浓度变化与电流强度的关系如图-1 所示。向 0.1 mol·L-1NaCl 溶液中通入 NO,测得电流强度与 NO 的脱除率的关系如图-2 所示。
。电解 0.1 mol·L-1NaCl 溶液时,溶液中相关成分的浓度变化与电流强度的关系如图-1 所示。向 0.1 mol·L-1NaCl 溶液中通入 NO,测得电流强度与 NO 的脱除率的关系如图-2 所示。
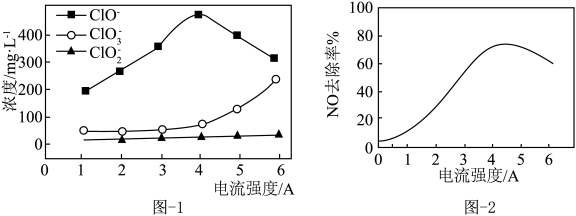
①电解NaCl溶液作吸收液时,若电流强度为4A,吸收NO 的反应离子方程式为_______ 。
②当电流强度大于 4A 后,NO去除率下降,其原因是_______ 。
(2)某氮肥厂处理氨氮废水的方案如图,回答下列问题:
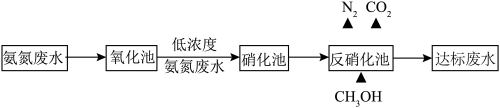
①“氧化池”中可用活性炭—臭氧可处理高浓度氨氮废水。氧化机理如图-3 所示。*表示吸附在活性炭表面的物种,·OH 为羟基自由基。其它条件不变,调节 pH,废水中氨氮去除率随 pH 的变化如图-4 所示。随 pH 增大氨氮去除率先明显增大后变化较小的可能原因是_______ 。

②“反硝化池”中发生的变化为:HNO3→ →N2。1 mol HNO3完全转化理论上消耗甲醇的质量为
→N2。1 mol HNO3完全转化理论上消耗甲醇的质量为_______ 。
(3)纳米Fe 可还原去除水中的硝酸盐污染物。
已知:i.纳米 Fe 具有很高的活性,易被氧化使表面形成氧化层
ii.纳米 Fe 将 还原为
还原为 的转化关系如下:
的转化关系如下:


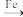

①纳米 Fe 的制备原理:FeSO4+2NaBH4+6H2O=2B(OH)3+Fe+7H2↑+Na2SO4; 已知电负性 H>B,则该反应中氧化剂是_______ (填化学式) 。
②检验还原后的溶液中存在 的实验方法是
的实验方法是_______ 。
③溶液初始 pH 较低有利于 的去除,其可能的原因是
的去除,其可能的原因是_______ 。
 存在)和硝态氮(以NO
存在)和硝态氮(以NO 、NO
、NO 存在)会引起水体富营养化,需经处理后才能排放。
存在)会引起水体富营养化,需经处理后才能排放。(1)电解氧化吸收法可将废气中的 NOx转变为NO
 。电解 0.1 mol·L-1NaCl 溶液时,溶液中相关成分的浓度变化与电流强度的关系如图-1 所示。向 0.1 mol·L-1NaCl 溶液中通入 NO,测得电流强度与 NO 的脱除率的关系如图-2 所示。
。电解 0.1 mol·L-1NaCl 溶液时,溶液中相关成分的浓度变化与电流强度的关系如图-1 所示。向 0.1 mol·L-1NaCl 溶液中通入 NO,测得电流强度与 NO 的脱除率的关系如图-2 所示。
①电解NaCl溶液作吸收液时,若电流强度为4A,吸收NO 的反应离子方程式为
②当电流强度大于 4A 后,NO去除率下降,其原因是
(2)某氮肥厂处理氨氮废水的方案如图,回答下列问题:

①“氧化池”中可用活性炭—臭氧可处理高浓度氨氮废水。氧化机理如图-3 所示。*表示吸附在活性炭表面的物种,·OH 为羟基自由基。其它条件不变,调节 pH,废水中氨氮去除率随 pH 的变化如图-4 所示。随 pH 增大氨氮去除率先明显增大后变化较小的可能原因是

②“反硝化池”中发生的变化为:HNO3→
 →N2。1 mol HNO3完全转化理论上消耗甲醇的质量为
→N2。1 mol HNO3完全转化理论上消耗甲醇的质量为(3)纳米Fe 可还原去除水中的硝酸盐污染物。
已知:i.纳米 Fe 具有很高的活性,易被氧化使表面形成氧化层
ii.纳米 Fe 将
 还原为
还原为 的转化关系如下:
的转化关系如下:
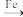

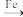

①纳米 Fe 的制备原理:FeSO4+2NaBH4+6H2O=2B(OH)3+Fe+7H2↑+Na2SO4; 已知电负性 H>B,则该反应中氧化剂是
②检验还原后的溶液中存在
 的实验方法是
的实验方法是③溶液初始 pH 较低有利于
 的去除,其可能的原因是
的去除,其可能的原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】C、N、O、Al、Si、Cl、Fe是七种常见元素
(1)N元素位于周期表第___________ 周期,第___________ 族,C元素的一种同位素可测定文物年代,这种同位素的符号是___________ 。
(2)用“>”、“<”或“= ”填空:
(3)SiO2及硅酸盐在自然界广泛存在,在日常生活、生产、科研及新型材料等方面有着重要的用途。高岭土[Al2(Si2O5)(OH)4]改写成氧化物的形式为___________ 。
(4)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2.写出该反应的离子方程式,并用单线桥标出电子转移的方向和数目___________ 。
(5)将铝片(表面除去氧化膜)与碳棒用导线连接后插入稀NaOH溶液中可以构成原电池,电池正极为___________ ,电池负极反应的电极方程式为___________ 。
(1)N元素位于周期表第
(2)用“>”、“<”或“= ”填空:
| 离子半径 | 得电子能力 | 酸性 | 金属性 |
| O2- | 16O | H2CO3 | Fe |
(4)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2.写出该反应的离子方程式,并用单线桥标出电子转移的方向和数目
(5)将铝片(表面除去氧化膜)与碳棒用导线连接后插入稀NaOH溶液中可以构成原电池,电池正极为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】Ⅰ.双氰胺结构简式如图。
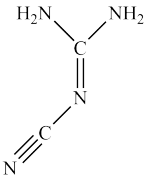
(1)双氰胺的晶体类型为_______ 。
(2)双氰胺所含元素中,_______ (填元素名称)元素基态原子核外未成对电子数最多。
(3)双氰胺分子中σ键和π键数目之比为_______ 。
Ⅱ.硼的最简单氢化物——乙硼烷球棍模型如下图,由它制取硼氢化锂的反应为2LiH+B2H6=2LiBH4
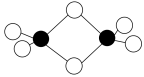
(4)乙硼烷分子中硼原子的杂化轨道类型为_______ 。
(5)BH 为正四面体结构,LiBH4中硼原子和氢原子之间的化学键为
为正四面体结构,LiBH4中硼原子和氢原子之间的化学键为_______ (填序号)。
A.离子键 B.金属键 C.氢键 D.配位键 E.极性键 F.非极性键
(6)根据以上反应判断,其中涉及元素的电负性从小到大的顺序为_______ (填元素符号)。
(7)碳的最简单氢化物是CH4,而硼的最简单氢化物不是BH3,其原因为_______ 。

(1)双氰胺的晶体类型为
(2)双氰胺所含元素中,
(3)双氰胺分子中σ键和π键数目之比为
Ⅱ.硼的最简单氢化物——乙硼烷球棍模型如下图,由它制取硼氢化锂的反应为2LiH+B2H6=2LiBH4

(4)乙硼烷分子中硼原子的杂化轨道类型为
(5)BH
 为正四面体结构,LiBH4中硼原子和氢原子之间的化学键为
为正四面体结构,LiBH4中硼原子和氢原子之间的化学键为A.离子键 B.金属键 C.氢键 D.配位键 E.极性键 F.非极性键
(6)根据以上反应判断,其中涉及元素的电负性从小到大的顺序为
(7)碳的最简单氢化物是CH4,而硼的最简单氢化物不是BH3,其原因为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】用VSEPR 理论判断:
| 物质 | 孤对电子对数 | 轨道杂化形式 | 空间构型 |
| SO3 | |||
PO | |||
| NCl3 | |||
| CO2 |
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】碳、氧、氮、镁、铬、铁、铜是几种重要的元素,请回答下列问题:
(1)查阅相关资料发现MgO的熔点比CuO的熔点高得多,其原因是_________________________________________________________________________________________ 。
(2)Fe与CO能形成一种重要的催化剂Fe(CO)5,该分子中σ键与π键个数比为________ 。请写出一个与CO互为等电子体的离子:________ 。
(3)金属铬是一种银白色、耐腐蚀的金属,铬元素的化合物种类繁多,如:Cr2(SO4)3、K2Cr2O7以及配离子[Cr(H2O)3(NH3)3]3+等。
①K2Cr2O7具有很强的氧化性,能直接将CH3CH2OH氧化成CH3COOH,CH3COOH分子中碳原子的杂化类型为________ ;乙醇和丙烷的相对分子质量相近,但乙醇的熔、沸点比丙烷高很多,试解释其主要原因:___________________________________________________________________________________ 。
②[Cr(H2O)3(NH3)3]3+中,中心离子的配位数为________ ,NH3的VSEPR模型为________ 。
(1)查阅相关资料发现MgO的熔点比CuO的熔点高得多,其原因是
(2)Fe与CO能形成一种重要的催化剂Fe(CO)5,该分子中σ键与π键个数比为
(3)金属铬是一种银白色、耐腐蚀的金属,铬元素的化合物种类繁多,如:Cr2(SO4)3、K2Cr2O7以及配离子[Cr(H2O)3(NH3)3]3+等。
①K2Cr2O7具有很强的氧化性,能直接将CH3CH2OH氧化成CH3COOH,CH3COOH分子中碳原子的杂化类型为
②[Cr(H2O)3(NH3)3]3+中,中心离子的配位数为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】Cu可形成多种配合物,某同学在探究配合物的形成时做了以下实验,根据下列信息回答问题:
(1)将无水硫酸铜溶解于水中,溶液呈蓝色,向其中加入浓氨水,产生蓝色沉淀的离子反应方程式___________ ,继续加入浓氨水,沉淀消失,沉淀溶解的离子反应方程式___________ 。
(2)根据以上实验过程,判断 和
和 与
与 的配位能力:
的配位能力:
___________ (填“>”“=”或“<”) 。
。
(3)再向深蓝色透明溶液加入乙醇,析出深蓝色的晶体。深蓝色晶体的化学式为___________ 。
(4)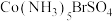 可形成两种钴的配合物。已知
可形成两种钴的配合物。已知 的配位数是6,为确定钴的配合物的结构,现对两种配合物进行了如下实验:在第一种配合物的溶液中加
的配位数是6,为确定钴的配合物的结构,现对两种配合物进行了如下实验:在第一种配合物的溶液中加 溶液时,产生白色沉淀,在第二种配合物的溶液中加
溶液时,产生白色沉淀,在第二种配合物的溶液中加 溶液时,则无明显现象。
溶液时,则无明显现象。
则第一种配合物的结构式可表示为___________ 。(提示: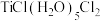 这种配合物的结构可表示为
这种配合物的结构可表示为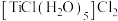 );若
);若 均为配体,则在第二种配合物的溶液中滴加
均为配体,则在第二种配合物的溶液中滴加 溶液,产生的现象是
溶液,产生的现象是___________ 。
(1)将无水硫酸铜溶解于水中,溶液呈蓝色,向其中加入浓氨水,产生蓝色沉淀的离子反应方程式
(2)根据以上实验过程,判断
 和
和 与
与 的配位能力:
的配位能力:
 。
。(3)再向深蓝色透明溶液加入乙醇,析出深蓝色的晶体。深蓝色晶体的化学式为
(4)
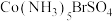 可形成两种钴的配合物。已知
可形成两种钴的配合物。已知 的配位数是6,为确定钴的配合物的结构,现对两种配合物进行了如下实验:在第一种配合物的溶液中加
的配位数是6,为确定钴的配合物的结构,现对两种配合物进行了如下实验:在第一种配合物的溶液中加 溶液时,产生白色沉淀,在第二种配合物的溶液中加
溶液时,产生白色沉淀,在第二种配合物的溶液中加 溶液时,则无明显现象。
溶液时,则无明显现象。则第一种配合物的结构式可表示为
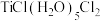 这种配合物的结构可表示为
这种配合物的结构可表示为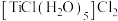 );若
);若 均为配体,则在第二种配合物的溶液中滴加
均为配体,则在第二种配合物的溶液中滴加 溶液,产生的现象是
溶液,产生的现象是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】请回答下列问题:
(1)(NH4)2SO4中含有化学键的类型为_________________________ 。
(2)KNO3中NO3-的立体构型为____________________ ,其中N原子的杂化方式为________ ,写出与NO 互为等电子体的另一种阴离子的化学式:
互为等电子体的另一种阴离子的化学式:_______________ 。
(3)已知配合物CrCl3·6H2O中心原子Cr3+的配位数为6,向含0.1 mol CrCl3·6H2O的溶液中滴加2 mol·L-1 AgNO3溶液,反应完全后共消耗AgNO3溶液50 mL,则该配合物的化学式为________________ ,Cr在基态时,价电子排布式为_____________________ 。
(4)LiBH4由Li+和BH4-构成,BH4-的立体构型是____________ ,根据化合物LiBH4判断,Li、B、H的电负性由大到小的顺序为____________ 。
(5)丙酮( )分子中C原子轨道杂化类型为
)分子中C原子轨道杂化类型为_____________ ;含有的π键与σ键数目之比为___________ 。
(6)第一电离能I 1(Zn)______ I 1(Cu)(填“大于”或“小于”),原因是_______________ 。
(1)(NH4)2SO4中含有化学键的类型为
(2)KNO3中NO3-的立体构型为
 互为等电子体的另一种阴离子的化学式:
互为等电子体的另一种阴离子的化学式:(3)已知配合物CrCl3·6H2O中心原子Cr3+的配位数为6,向含0.1 mol CrCl3·6H2O的溶液中滴加2 mol·L-1 AgNO3溶液,反应完全后共消耗AgNO3溶液50 mL,则该配合物的化学式为
(4)LiBH4由Li+和BH4-构成,BH4-的立体构型是
(5)丙酮(
 )分子中C原子轨道杂化类型为
)分子中C原子轨道杂化类型为(6)第一电离能I 1(Zn)
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】(1)BF3与一定量的水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:
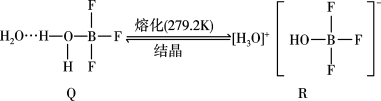
①晶体Q中各种微粒间的作用力不涉及____________ (填序号)。
a.离子键 b.共价键 c.配位键 d.金属键e.氢键 f.范德华力
②R中阳离子的空间构型为________ ,阴离子的中心原子轨道采用________ 杂化。
(2)已知苯酚( )具有弱酸性,其Ka=1.1×10-10,水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1×10-10,水杨酸第一级电离形成的离子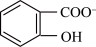 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)________ Ka(苯酚)(填“>”或“<”),其原因是________________ 。

①晶体Q中各种微粒间的作用力不涉及
a.离子键 b.共价键 c.配位键 d.金属键e.氢键 f.范德华力
②R中阳离子的空间构型为
(2)已知苯酚(
 )具有弱酸性,其Ka=1.1×10-10,水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1×10-10,水杨酸第一级电离形成的离子 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)
您最近一年使用:0次