水体中的含氮化合物是引起富营养化的主要污染物,分析监测水体中的硝酸(盐)和亚硝酸(盐)含量,控制水体中的含氮污染物,对水资源的循环利用意义重大。
(1)亚硝酸(HNO2)是一种弱酸,其电离平衡常数的表达式为_________ 。
(2)水体中亚硝酸的含量可以利用KI溶液进行分析测定。该测定反应中,含氮的生成物可以是NO、N2O、NH2OH、NH3等。
①NH2OH中,氮元素的化合价为________ 。
②某水样中含有亚硝酸盐,加入少量稀硫酸酸化后,用KI溶液测定,且选用淀粉溶液作指示剂,反应中含N的生成物为NO,反应的离子方程式为________ ,其中氧化产物为________ (写化学式)。
(1)亚硝酸(HNO2)是一种弱酸,其电离平衡常数的表达式为
(2)水体中亚硝酸的含量可以利用KI溶液进行分析测定。该测定反应中,含氮的生成物可以是NO、N2O、NH2OH、NH3等。
①NH2OH中,氮元素的化合价为
②某水样中含有亚硝酸盐,加入少量稀硫酸酸化后,用KI溶液测定,且选用淀粉溶液作指示剂,反应中含N的生成物为NO,反应的离子方程式为
23-24高二上·全国·课时练习 查看更多[1]
更新时间:2023-08-27 15:52:07
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】K2Cr2O7和H2O2在H2SO4溶液中混合时,可观察到下面两个现象:
①混合后5~10秒内,溶液由橙色变为暗蓝色;
②在80~150秒内由暗蓝色变为绿色,与此同时放出气泡。与之相应的两个反应为:
A.Cr2O +H2O2+H+
+H2O2+H+ CrO5+H2O
CrO5+H2O
B.CrO5+H+ Cr3++O2↑+H2O
Cr3++O2↑+H2O
(1)已知反应A不是氧化还原反应,则CrO5中Cr元素的价态为___________ 。
(2)反应B是否属于氧化还原反应?:___________ ,其理由是___________ 。
(3)将反应A和反应B相加,可以得到一个总化学方程式,该总反应中氧化剂是___________ 。
①混合后5~10秒内,溶液由橙色变为暗蓝色;
②在80~150秒内由暗蓝色变为绿色,与此同时放出气泡。与之相应的两个反应为:
A.Cr2O
 +H2O2+H+
+H2O2+H+ CrO5+H2O
CrO5+H2OB.CrO5+H+
 Cr3++O2↑+H2O
Cr3++O2↑+H2O(1)已知反应A不是氧化还原反应,则CrO5中Cr元素的价态为
(2)反应B是否属于氧化还原反应?:
(3)将反应A和反应B相加,可以得到一个总化学方程式,该总反应中氧化剂是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,具有强氧化性,无二次污染。湿法制备高铁酸钾(K2FeO4)的反应体系中有六种数粒:Fe(OH)3、ClO-、OH-、FeO 、Cl-、H2O。
、Cl-、H2O。
(1)写出并配平湿法制高铁酸钾的离子反应方程式:___ 。
(2)每生成1molFeO 转移
转移___ mol电子,若反应过程中转移了0.3mol电子,则还原产物的物质的量为___ mol。
(3)氧化性:FeO
___ ClO-(填“>”或“<”)。
(4)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力(转移的电子数)相当于多少克Cl2的氧化能力。NaClO的有效氯含量为___ ?
(5)实际在水处理过程中,K2FeO4中的铁元素转化为Fe(OH)3胶体,使水中悬浮物聚沉,如何通过实验证明生成了Fe(OH)3胶体___ ?
 、Cl-、H2O。
、Cl-、H2O。(1)写出并配平湿法制高铁酸钾的离子反应方程式:
(2)每生成1molFeO
 转移
转移(3)氧化性:FeO

(4)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力(转移的电子数)相当于多少克Cl2的氧化能力。NaClO的有效氯含量为
(5)实际在水处理过程中,K2FeO4中的铁元素转化为Fe(OH)3胶体,使水中悬浮物聚沉,如何通过实验证明生成了Fe(OH)3胶体
您最近一年使用:0次
【推荐3】氧化还原反应是化学反应中的三大基本反应之一,自然界中的燃烧反应、呼吸作用、光合作用,生产生活中的化学电池、金属冶炼、火箭发射等等都与氧化还原反应息息相关。研究氧化还原反应,对人类的进步具有极其重要的意义。
(1)用双线桥法表示下列反应电子转移的方向和数目
___________
(2)已知:___________ ___________
___________ ___________
___________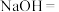 ___________
___________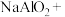 ___________
___________ ___________
___________
①配平方程式___________ 。
②若反应过程中转移5 电子,则生成
电子,则生成 的体积是
的体积是___________ L(标准状况)。
(3) 是一种高效多功能水处理剂,应用前景广阔。一种制备
是一种高效多功能水处理剂,应用前景广阔。一种制备 的方法可用化学方程式表示如下:
的方法可用化学方程式表示如下: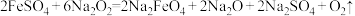 ,该反应中的还原剂是
,该反应中的还原剂是___________ ,还原产物是___________ 。
(4)某容器中发生一个化学反应,反应过程中存在 、
、 、
、 、
、 、
、 、
、 六种物质。在反应过程中测得
六种物质。在反应过程中测得 和
和 的物质的量随时间变化的曲线如图所示。写出该反应的离子方程式
的物质的量随时间变化的曲线如图所示。写出该反应的离子方程式___________ 。

(1)用双线桥法表示下列反应电子转移的方向和数目

(2)已知:___________
 ___________
___________ ___________
___________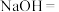 ___________
___________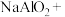 ___________
___________ ___________
___________
①配平方程式
②若反应过程中转移5
 电子,则生成
电子,则生成 的体积是
的体积是(3)
 是一种高效多功能水处理剂,应用前景广阔。一种制备
是一种高效多功能水处理剂,应用前景广阔。一种制备 的方法可用化学方程式表示如下:
的方法可用化学方程式表示如下: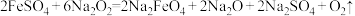 ,该反应中的还原剂是
,该反应中的还原剂是(4)某容器中发生一个化学反应,反应过程中存在
 、
、 、
、 、
、 、
、 、
、 六种物质。在反应过程中测得
六种物质。在反应过程中测得 和
和 的物质的量随时间变化的曲线如图所示。写出该反应的离子方程式
的物质的量随时间变化的曲线如图所示。写出该反应的离子方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】Ⅰ.已知t℃时,0.01mol/LNaOH溶液的pH=10,0.1mol/L的HA溶液中 =108。请回答下列问题:
=108。请回答下列问题:
(1)该温度下,水的离子积Kw=___________ 。
(2)该温度下,0.1mol/L的HA溶液中水电离出c(OH−)=___________ 。
(3)在室温下,蒸馏水稀释0.01mol/LHA溶液时,下列呈减小趋势的是___________(填序号)。
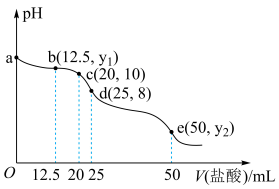
Ⅱ.常温下,用0.2000mol•L-1盐酸滴定25mL0.2000mol•L-1Na2CO3溶液(溶液均为新配制),其滴定曲线如图所示(已知:碳酸的电离常数Ka1=4×10-7,Ka2=5×10-11,忽略溶液混合时体积和温度的变化)。
回答下列问题:
(4)往0.2000mol•L-1Na2CO3溶液中滴入2~3滴无色酚酞,溶液颜色会由无色变为___________ 色,判断的依据___________ (用离子方程式表示)。
(5)b点混合溶液中主要的溶质有Na2CO3、NaCl和___________ (填化学式),此时 =
=___________ 。
(6)c点混合溶液中,c(Na+)、c(CO )、(HCO
)、(HCO )、c(OH-)、c(H+)由大到小的顺序为
)、c(OH-)、c(H+)由大到小的顺序为___________ 。
(7)d点混合溶液中,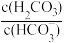 =
=___________ 。
 =108。请回答下列问题:
=108。请回答下列问题:(1)该温度下,水的离子积Kw=
(2)该温度下,0.1mol/L的HA溶液中水电离出c(OH−)=
(3)在室温下,蒸馏水稀释0.01mol/LHA溶液时,下列呈减小趋势的是___________(填序号)。
| A.水的电离程度 | B. |
| C.溶液中c(H+)和c(OH−)的乘积 | D.溶液中c(A−)·c(HA)的值 |
Ⅱ.常温下,用0.2000mol•L-1盐酸滴定25mL0.2000mol•L-1Na2CO3溶液(溶液均为新配制),其滴定曲线如图所示(已知:碳酸的电离常数Ka1=4×10-7,Ka2=5×10-11,忽略溶液混合时体积和温度的变化)。

回答下列问题:
(4)往0.2000mol•L-1Na2CO3溶液中滴入2~3滴无色酚酞,溶液颜色会由无色变为
(5)b点混合溶液中主要的溶质有Na2CO3、NaCl和
 =
=(6)c点混合溶液中,c(Na+)、c(CO
 )、(HCO
)、(HCO )、c(OH-)、c(H+)由大到小的顺序为
)、c(OH-)、c(H+)由大到小的顺序为(7)d点混合溶液中,
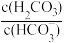 =
=
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】按要求完成下列问题。
(1)25°C时,pH试纸测得0.1 mol/L醋酸溶液的pH约为3,则估算出醋酸的电离常数约为___________ ; 向10 mL此溶液中加水稀释的 值将
值将___________ (填“增大”、“减小”或“无法确定”)
(2)常温下,已知H2A为二元弱酸,溶液M由20 mLl mol·L-1NaHA溶液与20 mL 1mol·L-1NaOH溶液等体积混合而得,则溶液M的pH___________ 7(填“>”“<”或“=”), 溶液M中各微粒的浓度关系正确的是___________ 。
A. c(A2-)+c(HA-)+c(OH-)=c(Na+ )+c(H+)
B. c(HA-)+c(H2A)+c(H+)=c(OH-)
C. c(A2-)+c(HA-)+c(H2A)=lmol·L-l
D. c(Na+)> c(A2-)> c(OH-)>c(H+)
(1)25°C时,pH试纸测得0.1 mol/L醋酸溶液的pH约为3,则估算出醋酸的电离常数约为
 值将
值将(2)常温下,已知H2A为二元弱酸,溶液M由20 mLl mol·L-1NaHA溶液与20 mL 1mol·L-1NaOH溶液等体积混合而得,则溶液M的pH
A. c(A2-)+c(HA-)+c(OH-)=c(Na+ )+c(H+)
B. c(HA-)+c(H2A)+c(H+)=c(OH-)
C. c(A2-)+c(HA-)+c(H2A)=lmol·L-l
D. c(Na+)> c(A2-)> c(OH-)>c(H+)
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡。请回答下列问题:
(1)常温下,物质的量浓度均为0.1mol·L-1的六种溶液
①Na2CO3、②NaCl、③NaOH、④(NH4)2SO4、⑤CH3COONa、⑥NH4NO3 , pH从大到小排列顺序为__________ (填序号)。
(2)已知T℃时,Kw=1×10-12,在该温度时,将pH=9的NaOH溶液bL与pH=2的H2SO4溶液aL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=3, 则a:b=__________ 。
(3)现有HA、HB两种酸。室温下用0.1mol· L-1NaOH溶液分别滴定20.00mL浓度均为0.1mol·L-1的HA、HB两种酸的溶液,滴定过程中溶液的pH随滴入的NaOH溶液体积的变化如下图。

①由图可知;酸性HA______ HB,b 点对应的溶液中c(HB)_____ c(B-)(填“>”“<”或“=”)。
②室温下HB的电离平衡常数Ka的数量级为________ 。
(1)常温下,物质的量浓度均为0.1mol·L-1的六种溶液
①Na2CO3、②NaCl、③NaOH、④(NH4)2SO4、⑤CH3COONa、⑥NH4NO3 , pH从大到小排列顺序为
(2)已知T℃时,Kw=1×10-12,在该温度时,将pH=9的NaOH溶液bL与pH=2的H2SO4溶液aL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=3, 则a:b=
(3)现有HA、HB两种酸。室温下用0.1mol· L-1NaOH溶液分别滴定20.00mL浓度均为0.1mol·L-1的HA、HB两种酸的溶液,滴定过程中溶液的pH随滴入的NaOH溶液体积的变化如下图。

①由图可知;酸性HA
②室温下HB的电离平衡常数Ka的数量级为
您最近一年使用:0次



