氨气可作为脱硝剂。
(1)在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应: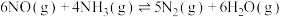 。
。
①能说明该反应已达到平衡状态的标志是___________
a.反应速率
b.容器内压强不再随时间而发生变化
c.容器内N2的物质的量分数不再随时间而发生变化
d.容器内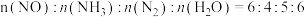
e.12mol N―H键断裂的同时生成5mol N≡N键
f.混合气体的总质量不随时间的变化而变化
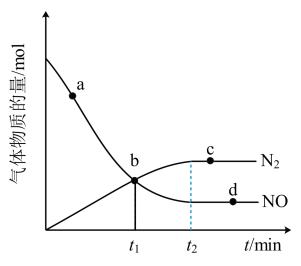
②某次实验中测得容器内NO及N2的物质的量随时间变化如图所示,图中b点对应的速率关系是
___________ 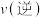 (填>、<或=)
(填>、<或=)
(2)298K时,若已知生成标准状况下2.24L 时放出热量为4.62kJ。写出合成氨反应的热化学方程式
时放出热量为4.62kJ。写出合成氨反应的热化学方程式___________ 。在该温度下,取1mol 和3mol
和3mol 放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量总小于92.4kJ,其原因是
放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量总小于92.4kJ,其原因是___________ 。
(3)一定条件下,在2L密闭容器内,反应
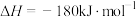 ,
,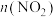 随时间变化如下表:
随时间变化如下表:
①用 表示0~2s内该反应的平均速率为
表示0~2s内该反应的平均速率为___________ 。在第5s时, 的转化率为
的转化率为___________ 。(转化率是指某一反应物转化的百分率。)
②根据上表可以看出,随着反应进行,反应速率逐渐减小,其原因是___________ 。
(1)在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:
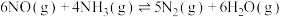 。
。①能说明该反应已达到平衡状态的标志是
a.反应速率

b.容器内压强不再随时间而发生变化
c.容器内N2的物质的量分数不再随时间而发生变化
d.容器内
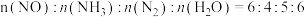
e.12mol N―H键断裂的同时生成5mol N≡N键
f.混合气体的总质量不随时间的变化而变化
②某次实验中测得容器内NO及N2的物质的量随时间变化如图所示,图中b点对应的速率关系是

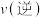 (填>、<或=)
(填>、<或=)
(2)298K时,若已知生成标准状况下2.24L
 时放出热量为4.62kJ。写出合成氨反应的热化学方程式
时放出热量为4.62kJ。写出合成氨反应的热化学方程式 和3mol
和3mol 放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量总小于92.4kJ,其原因是
放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量总小于92.4kJ,其原因是(3)一定条件下,在2L密闭容器内,反应

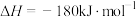 ,
,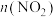 随时间变化如下表:
随时间变化如下表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
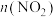 /mol /mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
 表示0~2s内该反应的平均速率为
表示0~2s内该反应的平均速率为 的转化率为
的转化率为②根据上表可以看出,随着反应进行,反应速率逐渐减小,其原因是
更新时间:2023-08-25 13:35:16
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】消除含氮化合物的污染是环境保护的重要研究课题。
⑴一定条件下,某反应过程中的物质和能量变化如图所示(a、b均大于0)。

①该反应的热化学方程式为_____ 。
②2000 ℃时,向容积为2 L的密闭容器中充入10 mol N2与5 mol O2,达到平衡后NO的物质的量为2 mol。该温度下,若开始时向上述容器中充入的N2与O2均为1 mol,则达到平衡后N2的转化率为_____ 。
⑵NO2与CO在催化剂条件下的反应为:4CO(g)+2NO2(g) 4CO2(g)+N2(g),下列能说明该反应已达到化学平衡状态的是
4CO2(g)+N2(g),下列能说明该反应已达到化学平衡状态的是_____ (填字母)。
A.CO2(g)和N2(g)的比例保持不变
B.恒温恒容,混合气体的颜色不再变化
C.恒温恒压,气体的体积不再变化
D.v(NO2)正=2v(N2)正
⑶电极生物膜电解脱硝是电化学和微生物工艺的组合。某微生物膜能利用阴极电解产生的活性原子将NO 还原为N2,工作原理如图所示。
还原为N2,工作原理如图所示。
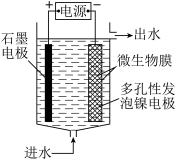
写出活性原子与NO 反应的离子方程式
反应的离子方程式_____ 。
②若阳极生成标准状况下2.24 L气体,理论上可除去NO 的物质的量为
的物质的量为_____ mol。
⑴一定条件下,某反应过程中的物质和能量变化如图所示(a、b均大于0)。

①该反应的热化学方程式为
②2000 ℃时,向容积为2 L的密闭容器中充入10 mol N2与5 mol O2,达到平衡后NO的物质的量为2 mol。该温度下,若开始时向上述容器中充入的N2与O2均为1 mol,则达到平衡后N2的转化率为
⑵NO2与CO在催化剂条件下的反应为:4CO(g)+2NO2(g)
 4CO2(g)+N2(g),下列能说明该反应已达到化学平衡状态的是
4CO2(g)+N2(g),下列能说明该反应已达到化学平衡状态的是A.CO2(g)和N2(g)的比例保持不变
B.恒温恒容,混合气体的颜色不再变化
C.恒温恒压,气体的体积不再变化
D.v(NO2)正=2v(N2)正
⑶电极生物膜电解脱硝是电化学和微生物工艺的组合。某微生物膜能利用阴极电解产生的活性原子将NO
 还原为N2,工作原理如图所示。
还原为N2,工作原理如图所示。
写出活性原子与NO
 反应的离子方程式
反应的离子方程式②若阳极生成标准状况下2.24 L气体,理论上可除去NO
 的物质的量为
的物质的量为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】(1)X、Y两元素的原子,当它们分别获得两个电子形成稀有气体元素电子层结构时,X放出的热量大于Y放出的热量;Z、W两元素的原子,当它们分别失去一个电子形成稀有气体元素原子的电子层结构时,吸收能量W大于Z。则X、Y,Z、W四种元素间哪两种元素形成离子化合物可能性最大_______ 。(填X,Y,Z,W)
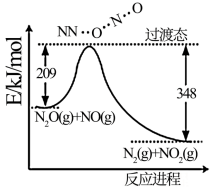
(2)由N2O和NO反应生成N2和NO2的能量变化如图所示,若生成1molN2,其∆H=_______ kJ·mol-1。
(3) 溶液与
溶液与 锌粉在量热计中充分反应。测得反应前温度为20.1℃,反应后最高温度为30.1℃。
锌粉在量热计中充分反应。测得反应前温度为20.1℃,反应后最高温度为30.1℃。
已知:反应前后,溶液的比热容均近似为4.18J g-1
g-1 ℃-1、溶液的密度均近似为1.00g
℃-1、溶液的密度均近似为1.00g cm-3忽略溶液体积、质量变化和金属吸收的热量。反应
cm-3忽略溶液体积、质量变化和金属吸收的热量。反应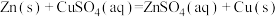 的∆H=
的∆H=_______ kJ/mol
(4)称取等质量为(ag)胆矾两份。把一份溶于bg水中,测知其溶解时吸收Q1kJ热量;把另一份脱水后溶于bg水中,测得其溶解时放热Q2kJ。从以上数据可知,1mol胆矾脱水需_______ kJ热量。
(5)氢卤酸的能量关系如图所示下列说法正确的是_______

A.已知HF气体溶于水放热,则HF的∆H1<0
B.相同条件下,HCl的∆H2比HBr的小
C.相同条件下,HCl的∆H3+∆H4比HI的大
D.一定条件下,气态原子生成1molH-X键放出akJ能量,则该条件下∆H2=+akJ/mol
(2)由N2O和NO反应生成N2和NO2的能量变化如图所示,若生成1molN2,其∆H=

(3)
 溶液与
溶液与 锌粉在量热计中充分反应。测得反应前温度为20.1℃,反应后最高温度为30.1℃。
锌粉在量热计中充分反应。测得反应前温度为20.1℃,反应后最高温度为30.1℃。已知:反应前后,溶液的比热容均近似为4.18J
 g-1
g-1 ℃-1、溶液的密度均近似为1.00g
℃-1、溶液的密度均近似为1.00g cm-3忽略溶液体积、质量变化和金属吸收的热量。反应
cm-3忽略溶液体积、质量变化和金属吸收的热量。反应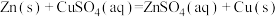 的∆H=
的∆H=(4)称取等质量为(ag)胆矾两份。把一份溶于bg水中,测知其溶解时吸收Q1kJ热量;把另一份脱水后溶于bg水中,测得其溶解时放热Q2kJ。从以上数据可知,1mol胆矾脱水需
(5)氢卤酸的能量关系如图所示下列说法正确的是

A.已知HF气体溶于水放热,则HF的∆H1<0
B.相同条件下,HCl的∆H2比HBr的小
C.相同条件下,HCl的∆H3+∆H4比HI的大
D.一定条件下,气态原子生成1molH-X键放出akJ能量,则该条件下∆H2=+akJ/mol
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】I.在一定条件下,可逆反应A+B mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,问:
mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,问:

(1)温度T1________ T2(填“大于”“等于”或“小于”)。
(2)正反应是________ 反应(填“吸热”或“放热”)。
(3)如果A、B、C均为气体,则m________ 2(填“大于”“等于”或“小于”)。
(4)当温度和容积不变时,如在平衡体系中加入一定量的某稀有气体,则体系的压强________ (填“增大”“减小”或“不变”),平衡________ 移动(填“向正反应方向”“向逆反应方向”或“不”)。
II.合成氨工业中氢气可由天然气和水蒸气反应制备,其主要反应为:CH4+2H2O=CO2+4H2。
已知:CH4(g)+2O2(g)═CO2(g)+2H2O(l) △H =﹣890 kJ/mol
2H2(g)+O2(g)═2H2O(l) △H =﹣571.6 kJ/mol
H2O(g)=H2O(l) △H =﹣44 kJ/mol
写出由天然气和水蒸气反应制备H2的热化学方程式:_________ 。
 mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,问:
mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,问:
(1)温度T1
(2)正反应是
(3)如果A、B、C均为气体,则m
(4)当温度和容积不变时,如在平衡体系中加入一定量的某稀有气体,则体系的压强
II.合成氨工业中氢气可由天然气和水蒸气反应制备,其主要反应为:CH4+2H2O=CO2+4H2。
已知:CH4(g)+2O2(g)═CO2(g)+2H2O(l) △H =﹣890 kJ/mol
2H2(g)+O2(g)═2H2O(l) △H =﹣571.6 kJ/mol
H2O(g)=H2O(l) △H =﹣44 kJ/mol
写出由天然气和水蒸气反应制备H2的热化学方程式:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】合成氨工业是贵州省开磷集团的重要支柱产业之一。氨是一种重要的化工原料,在工农业生产中有广泛的应用。
(1)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2(g)+3H2(g) 2NH3(g)。该可逆反应达到平衡的标志是
2NH3(g)。该可逆反应达到平衡的标志是___ 。
a.3v正(H2)=2v逆(NH3)
b.单位时间生成mmolN2的同时生成3mmolH2
c.容器内的总压强不再随时间而变化
d.混合气体的密度不再随时间变化
(2)工业上可用天然气原料来制取合成氨的原料气氢气。某研究性学习小组的同学模拟工业制取氢气的
原理,在一定温度下,体积为2L的恒容密闭容器中测得如下表所示数据。请回答下列问题:
①写出工业用天然气原料制取氢气的化学方程式:___ 。
②分析表中数据,判断5min时反应是否处于平衡状态?___ (填“是”或“否”),前5min反应的平均反应速率v(CH4)=___ 。
③反应在7~10min内,CO的物质的量减少的原因可能是___ (填字母)。
a.减少CH4的物质的量 b.降低温度 c.升高温度 d.充入H2
(1)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2(g)+3H2(g)
 2NH3(g)。该可逆反应达到平衡的标志是
2NH3(g)。该可逆反应达到平衡的标志是a.3v正(H2)=2v逆(NH3)
b.单位时间生成mmolN2的同时生成3mmolH2
c.容器内的总压强不再随时间而变化
d.混合气体的密度不再随时间变化
(2)工业上可用天然气原料来制取合成氨的原料气氢气。某研究性学习小组的同学模拟工业制取氢气的
原理,在一定温度下,体积为2L的恒容密闭容器中测得如下表所示数据。请回答下列问题:
| 时间/min | CH4(mol) | H2O(mol) | CO(mol) | H2(mol) |
| 0 | 0.40 | 1.00 | 0 | 0 |
| 5 | a | 0.80 | c | 0.60 |
| 7 | 0.20 | b | 0.20 | d |
| 10 | 0.21 | 0.81 | 0.19 | 0.64 |
①写出工业用天然气原料制取氢气的化学方程式:
②分析表中数据,判断5min时反应是否处于平衡状态?
③反应在7~10min内,CO的物质的量减少的原因可能是
a.减少CH4的物质的量 b.降低温度 c.升高温度 d.充入H2
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:

(1)该反应的化学方程式为_______ 。
(2)反应开始至2min,用X表示的平均反应速率为_______ 。
(3)下列叙述能说明上述反应达到化学平衡状态的是_______ (填字母)。
A.混合气体的总物质的量不随时间的变化而变化
B.单位时间内每消耗3mol X,同时生成2mol Z
C.混合气体的总质量不随时间的变化而变化
(4)在密闭容器里,通入a mol X(g)和b mol Y(g),发生上述反应,当改变下列条件时,反应速率会发生什么变化(选填“增大”“减小”或“不变”)
①降低温度:_______ 。
②保持容器的体积不变,增加X(g)的物质的量:_______ 。
③增大容器的体积:_______ 。

(1)该反应的化学方程式为
(2)反应开始至2min,用X表示的平均反应速率为
(3)下列叙述能说明上述反应达到化学平衡状态的是
A.混合气体的总物质的量不随时间的变化而变化
B.单位时间内每消耗3mol X,同时生成2mol Z
C.混合气体的总质量不随时间的变化而变化
(4)在密闭容器里,通入a mol X(g)和b mol Y(g),发生上述反应,当改变下列条件时,反应速率会发生什么变化(选填“增大”“减小”或“不变”)
①降低温度:
②保持容器的体积不变,增加X(g)的物质的量:
③增大容器的体积:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】在800℃2L密闭容器中,反应2NO+O2 2NO2,n(NO)随时间的变化如下表:
2NO2,n(NO)随时间的变化如下表:
(1)如图表示各物质浓度的变化曲线。
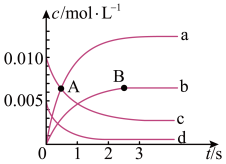
A点处,v(正)__ v(逆),A点正反应速率__ B点正反应速率。(用“>”、“<”、“=”填空)
(2)图中表示O2变化的曲线是__ 。用NO2表示从0~2s内该反应的平均速率v=__ 。
(3)能使该反应的反应速率增大的是__ 。
A.及时分离出NO2气体 B.升高温度
C.减小O2的浓度 D.选择高效的催化剂
(4)能说明该反应已经达到平衡状态的是__ 。
A.容器内压强保持不变 B.v(NO)=2v(O2)
C.容器内的密度保持不变 D.v逆(NO2)=2v正(O2)
 2NO2,n(NO)随时间的变化如下表:
2NO2,n(NO)随时间的变化如下表:时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |

A点处,v(正)
(2)图中表示O2变化的曲线是
(3)能使该反应的反应速率增大的是
A.及时分离出NO2气体 B.升高温度
C.减小O2的浓度 D.选择高效的催化剂
(4)能说明该反应已经达到平衡状态的是
A.容器内压强保持不变 B.v(NO)=2v(O2)
C.容器内的密度保持不变 D.v逆(NO2)=2v正(O2)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】2022年北京冬奥会首次采用氢能作为火炬燃料,体现绿色奥运理念。工业上利用天然气制备氢气,还能得到乙烯、乙炔等化工产品,有关反应原理如下:
反应1:

反应2: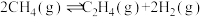

请回答下列问题:
(1)已知几种物质的燃烧热( )数据如下:
)数据如下:
①写出表示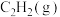 燃烧热的热化学方程式:
燃烧热的热化学方程式:_______ 。
②已知反应1的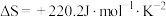 ,则下列所给温度能使该反应自发进行的是
,则下列所给温度能使该反应自发进行的是_______ (填标号)。
A.0℃ B.25℃ C.1250℃ D.2000℃
(2)在恒温恒容密闭容器中充入适量 发生上述反应1和反应2,下列情况不能说明上述反应达到平衡状态的是_______(填字母)。
发生上述反应1和反应2,下列情况不能说明上述反应达到平衡状态的是_______(填字母)。
(3) 的速率方程为
的速率方程为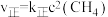 ,
, (
( 、
、 为正、逆反应速率常数,与温度有关)。其他条件相同,
为正、逆反应速率常数,与温度有关)。其他条件相同, ℃达到平衡时
℃达到平衡时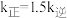 ,
, ℃达到平衡时
℃达到平衡时 。由此推知,
。由此推知,
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(4)一定温度下,在总压强保持恒定为121kPa时,向某密闭容器中充入 和
和 组成的混合气体(
组成的混合气体( 不参与反应),测得
不参与反应),测得 的平衡转化率与通入气体中
的平衡转化率与通入气体中 的物质的量分数的关系如图所示。
的物质的量分数的关系如图所示。

①图中随着通入气体中 的物质的量分数的增大,甲烷的平衡转化率降低的主要原因是
的物质的量分数的增大,甲烷的平衡转化率降低的主要原因是_______ 。
②已知M点乙炔的选择性为75%[乙炔的选择性 ]。该温度下,反应2的平衡常数
]。该温度下,反应2的平衡常数
_______ kPa(结果保留2位有效数字, 是以分压表示的平衡常数,分压=总压×物质的量分数)。
是以分压表示的平衡常数,分压=总压×物质的量分数)。
反应1:


反应2:
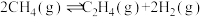

请回答下列问题:
(1)已知几种物质的燃烧热(
 )数据如下:
)数据如下:| 物质 |  | 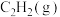 | 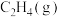 |  |
燃烧热( )/(kJ/mol) )/(kJ/mol) | -890.3 | -1299.5 | -1411.0 | -285.8 |
①写出表示
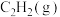 燃烧热的热化学方程式:
燃烧热的热化学方程式:②已知反应1的
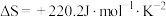 ,则下列所给温度能使该反应自发进行的是
,则下列所给温度能使该反应自发进行的是A.0℃ B.25℃ C.1250℃ D.2000℃
(2)在恒温恒容密闭容器中充入适量
 发生上述反应1和反应2,下列情况不能说明上述反应达到平衡状态的是_______(填字母)。
发生上述反应1和反应2,下列情况不能说明上述反应达到平衡状态的是_______(填字母)。| A.气体总压强不随时间变化 | B.气体密度不随时间变化 |
| C.气体平均摩尔质量不随时间变化 | D. 体积分数不随时间变化 体积分数不随时间变化 |
 的速率方程为
的速率方程为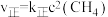 ,
, (
( 、
、 为正、逆反应速率常数,与温度有关)。其他条件相同,
为正、逆反应速率常数,与温度有关)。其他条件相同, ℃达到平衡时
℃达到平衡时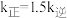 ,
, ℃达到平衡时
℃达到平衡时 。由此推知,
。由此推知,
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(4)一定温度下,在总压强保持恒定为121kPa时,向某密闭容器中充入
 和
和 组成的混合气体(
组成的混合气体( 不参与反应),测得
不参与反应),测得 的平衡转化率与通入气体中
的平衡转化率与通入气体中 的物质的量分数的关系如图所示。
的物质的量分数的关系如图所示。
①图中随着通入气体中
 的物质的量分数的增大,甲烷的平衡转化率降低的主要原因是
的物质的量分数的增大,甲烷的平衡转化率降低的主要原因是②已知M点乙炔的选择性为75%[乙炔的选择性
 ]。该温度下,反应2的平衡常数
]。该温度下,反应2的平衡常数
 是以分压表示的平衡常数,分压=总压×物质的量分数)。
是以分压表示的平衡常数,分压=总压×物质的量分数)。
您最近一年使用:0次
【推荐2】Ⅰ.已知:①C(石墨)+O2(g)=CO2(g)ΔH1=-393.5kJ/mol
②2H2(g)+O2(g)=2H2O(1)ΔH2=-571.6kJ/mol
③2C2H2(g)+5O2(g)=4CO2(g)+2H2O(1)ΔH3=-2599.2kJ/mol
则由C(石墨)和H2(g)反应生成1molC2H2(g)的焓变ΔH=__ 。
Ⅱ.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
回答下列问题:
(1)该反应为__ 反应(填“吸热”“放热”)。
(2)能 判断该反应已达化学平衡状态的依据是__ (填序号)。
a.容器中压强不变
b.混合气体中c(CO)不变
c.容器中气体平均摩尔质量不变
d.1molH-H键断裂的同时断裂2molH-O键
(3)某温度下,在2L的密闭容器中,加入1molCO2和1molH2充分反应达平衡时,CO平衡浓度为0.25mol/L,试通过计算判断此时的温度为__ ℃。
(4)在830℃温度下,某时刻测得c(CO2)=0.5mol/L,c(H2O)=0.5mol/L,c(CO)=1mol/L,c(H2)=1.5mol/L,则此时v(正)___ v(逆)(填“>”、“<”或“=”)
(5)在830℃温度下,向该平衡体系中再充入一定量的氢气,CO2的转化率__ (填“增大”、“减小”、“不变”)。相同条件的1L密闭容器中,充入lmolCO2、lmolH2和lmolH2O,则达到平衡时,混合物中CO2的物质的量分数可能是___ 。(填序号)
A.16.67% B.22.2% C.33.3% D.36.8%
Ⅲ.CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
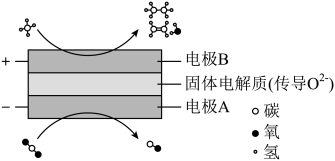
根据图示,写出阴极的反应式为___ 。
②2H2(g)+O2(g)=2H2O(1)ΔH2=-571.6kJ/mol
③2C2H2(g)+5O2(g)=4CO2(g)+2H2O(1)ΔH3=-2599.2kJ/mol
则由C(石墨)和H2(g)反应生成1molC2H2(g)的焓变ΔH=
Ⅱ.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)
 CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:| T/°C | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应为
(2)
a.容器中压强不变
b.混合气体中c(CO)不变
c.容器中气体平均摩尔质量不变
d.1molH-H键断裂的同时断裂2molH-O键
(3)某温度下,在2L的密闭容器中,加入1molCO2和1molH2充分反应达平衡时,CO平衡浓度为0.25mol/L,试通过计算判断此时的温度为
(4)在830℃温度下,某时刻测得c(CO2)=0.5mol/L,c(H2O)=0.5mol/L,c(CO)=1mol/L,c(H2)=1.5mol/L,则此时v(正)
(5)在830℃温度下,向该平衡体系中再充入一定量的氢气,CO2的转化率
A.16.67% B.22.2% C.33.3% D.36.8%
Ⅲ.CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:

根据图示,写出阴极的反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】研究化学反应能量变化、化学反应速率和化学反应限度,在实际工业生产和生活中有着重要的意义。回答下列问题:
(1)科学家提出可利用FeO吸收和利用CO2,其原理为:
已知:C(s)+2H2O(g)=CO2(g)+2H2(g) △H=+113.4kJ·mol-1
3FeO(s)+H2O(g)=Fe3 O4(s)+H2(g) △H=+18. 7 kJ·mol-1
则反应6FeO(s)+CO2(g)=2Fe3O4(s)+C(s)的△H=__________________ 。
(2)发射航天火箭常用肼(N2H4)与N2O4作燃料与助燃剂。肼(N2H4)与N2O4的反应为2N2H4(g)+ N2O4(g)=3N2(g)+4H2O(g) △H=-a kJ·mol-1。
已知反应中相关的化学键键能数据如下:
则完全断裂1molN2O4(g)分子中的化学键需要吸收的能量是__________ kJ。
(3)在体积均为1.0L的两个恒容密闭容器中加入足量相同的碳粉,再分别通入0.1molCO2和0.2 mol CO2,在不同温度下发生反应CO2(g)+C(s) 2CO(g),平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示。
2CO(g),平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示。
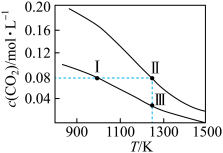
①该反应△H__________ 0(填“>”或“<”),在__________ (填“高温”“低温”或“任意温度”)下可自发进行。
②该反应的平衡常数:K(Ⅱ)__________ K(Ⅲ),反应速率:v正(I) __________ v逆 (Ⅲ)。(填“>”“<”或“=”)
③恒温恒容条件下,下列说法中能说明该反应达到化学平衡状态的是_________ (填标号)。
a.混合气体的密度不变
b.混合气体的平均相对分子质量不变
C.v逆(CO2)=2v正(CO)
d.单位时间内,生成2 n mol CO2的同时生成 m mol CO
④在平衡状态I时,平衡常数为__________ mol·L-1,体系中CO2和CO的分压之比为__________ (气体分压=气体总压×体积分数)。
(1)科学家提出可利用FeO吸收和利用CO2,其原理为:
已知:C(s)+2H2O(g)=CO2(g)+2H2(g) △H=+113.4kJ·mol-1
3FeO(s)+H2O(g)=Fe3 O4(s)+H2(g) △H=+18. 7 kJ·mol-1
则反应6FeO(s)+CO2(g)=2Fe3O4(s)+C(s)的△H=
(2)发射航天火箭常用肼(N2H4)与N2O4作燃料与助燃剂。肼(N2H4)与N2O4的反应为2N2H4(g)+ N2O4(g)=3N2(g)+4H2O(g) △H=-a kJ·mol-1。
已知反应中相关的化学键键能数据如下:
| 化学键 |  |  |  |  |
| 键能/kJ·mol-1 | b | c | d | e |
则完全断裂1molN2O4(g)分子中的化学键需要吸收的能量是
(3)在体积均为1.0L的两个恒容密闭容器中加入足量相同的碳粉,再分别通入0.1molCO2和0.2 mol CO2,在不同温度下发生反应CO2(g)+C(s)
 2CO(g),平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示。
2CO(g),平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示。
①该反应△H
②该反应的平衡常数:K(Ⅱ)
③恒温恒容条件下,下列说法中能说明该反应达到化学平衡状态的是
a.混合气体的密度不变
b.混合气体的平均相对分子质量不变
C.v逆(CO2)=2v正(CO)
d.单位时间内,生成2 n mol CO2的同时生成 m mol CO
④在平衡状态I时,平衡常数为
您最近一年使用:0次
【推荐1】在容积固定的密闭容器中,发生反应CO (g) + H2O(g)  CO2(g) + H2(g),化学平衡常数K和温度t的关系如下表:
CO2(g) + H2(g),化学平衡常数K和温度t的关系如下表:
请回答下列问题:
(1)该反应的化学平衡常数表达式为K =______________ ;
(2)该反应为_______ 反应(填“吸热”或“放热”。)
(3)能判断该反应达到化学平衡状态的是_______ (填字母)。
a.容器中总压强不变 b.混合气体中c(CO)不变
c.H2消耗的速率与H2O消耗的速率相等 d.c(CO2)= c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为________ ℃。
(5)830℃ 时:若起始时c(CO)=2 mol•L﹣1,c(H2O)=3 mol•L﹣1,平衡时CO的转化率为60%,水蒸气的转化率为_______ 。若只将起始时c(H2O)改为6 mol•L﹣1,则水蒸气的转化率为_______ 。某时刻混合体系中各气体的浓度为c(CO2)=0.4 mol•L﹣1、c(CO)=0.6 mol•L﹣1、c(H2O)=3 mol•L﹣1,c(H2)=2 mol•L﹣1请判定该体系中反应进行的方向:_______ (填“正向进行”“逆向进行”或“达到平衡”)。
 CO2(g) + H2(g),化学平衡常数K和温度t的关系如下表:
CO2(g) + H2(g),化学平衡常数K和温度t的关系如下表:t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
请回答下列问题:
(1)该反应的化学平衡常数表达式为K =
(2)该反应为
(3)能判断该反应达到化学平衡状态的是
a.容器中总压强不变 b.混合气体中c(CO)不变
c.H2消耗的速率与H2O消耗的速率相等 d.c(CO2)= c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为
(5)830℃ 时:若起始时c(CO)=2 mol•L﹣1,c(H2O)=3 mol•L﹣1,平衡时CO的转化率为60%,水蒸气的转化率为
您最近一年使用:0次
【推荐2】在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+ O2 (g)  2SO3(g) △H< 0。查阅资料知:SO3熔点16.83℃,沸点44.8℃。
2SO3(g) △H< 0。查阅资料知:SO3熔点16.83℃,沸点44.8℃。
(1)600℃时,在一容积为2 L的密闭容器中,将二氧化硫和氧气混合,反应过程中SO2,O2,SO3物质的量变化如图。

①据图判断,该反应处于平衡状态的时间是_______ 。
②计算600℃下,该反应的化学平衡常数 K=_______ 。
③据图判断,反应进行至20 min时,曲线发生变化的原因是________________ (用文字表达)。
(2)某化学研究学习小组用下图的装置组装设计了一个实验,以测定SO2转化为SO3的转化率,仪器的连接顺序是a→h→i→b→c→f→g→d→e。

①为提高SO2的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是____ 。
②在Ⅰ处用大火加热烧瓶时SO2的转化率会_______ 。(选填“增大”“不变”或“减小”)
③用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重 m g,则本实验中SO2的转化率为_____________ 。
 2SO3(g) △H< 0。查阅资料知:SO3熔点16.83℃,沸点44.8℃。
2SO3(g) △H< 0。查阅资料知:SO3熔点16.83℃,沸点44.8℃。(1)600℃时,在一容积为2 L的密闭容器中,将二氧化硫和氧气混合,反应过程中SO2,O2,SO3物质的量变化如图。

①据图判断,该反应处于平衡状态的时间是
②计算600℃下,该反应的化学平衡常数 K=
③据图判断,反应进行至20 min时,曲线发生变化的原因是
(2)某化学研究学习小组用下图的装置组装设计了一个实验,以测定SO2转化为SO3的转化率,仪器的连接顺序是a→h→i→b→c→f→g→d→e。

①为提高SO2的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是
②在Ⅰ处用大火加热烧瓶时SO2的转化率会
③用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重 m g,则本实验中SO2的转化率为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
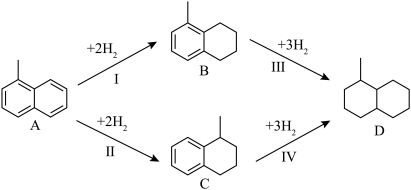
【推荐3】双环芳烃加氢生成四氢萘类物质,是缓解柴油产能过剩问题的一种经济有效的方法。其中用1-甲基萘(A)制备四氢萘类物质B和C,反应过程中伴有生成十氢萘(D)的副反应,涉及的反应如图所示(该反应条件下,各物质均为气态):
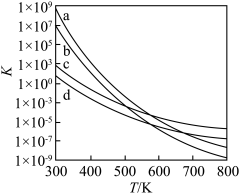
(1)以上四个反应的平衡常数随温度变化的关系如图所示: 、
、 、
、 的焓变分别为
的焓变分别为 、
、 、
、 ,则
,则
___________ 0(填“>”或“<”), 的数值范围是
的数值范围是___________ (填标号)。
A.<-1 B.-1~0 C.0~1 D.>1
(2)650K,以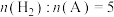 充料,反应达平衡时物质A、B、C、D的物质的量分数
充料,反应达平衡时物质A、B、C、D的物质的量分数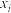 [例如:
[例如: ]随体系压强的变化关系如图所示:
]随体系压强的变化关系如图所示: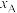 和
和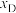 随压强p变化的曲线分别是
随压强p变化的曲线分别是___________ 、___________ ,判断的理由是___________ 。
②其他条件不变,若增大 的比例,则
的比例,则 的值将
的值将___________ (填“增大”“减小”或“不变”)。
③当压强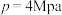 时,
时, 的平衡转化率
的平衡转化率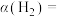
___________ ,反应 压强平衡常数
压强平衡常数
___________  (列出计算式即可)。
(列出计算式即可)。
(1)以上四个反应的平衡常数随温度变化的关系如图所示:
 、
、 、
、 的焓变分别为
的焓变分别为 、
、 、
、 ,则
,则
 的数值范围是
的数值范围是A.<-1 B.-1~0 C.0~1 D.>1
(2)650K,以
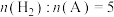 充料,反应达平衡时物质A、B、C、D的物质的量分数
充料,反应达平衡时物质A、B、C、D的物质的量分数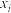 [例如:
[例如: ]随体系压强的变化关系如图所示:
]随体系压强的变化关系如图所示: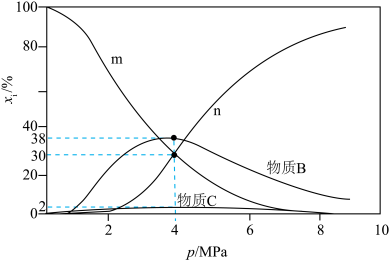
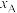 和
和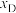 随压强p变化的曲线分别是
随压强p变化的曲线分别是②其他条件不变,若增大
 的比例,则
的比例,则 的值将
的值将③当压强
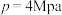 时,
时, 的平衡转化率
的平衡转化率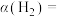
 压强平衡常数
压强平衡常数
 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次



