镍、钴是重要的战略物资,但资源匮乏。一种利用酸浸出法从冶金厂废炉渣中提取镍和钴的工艺流程如图:
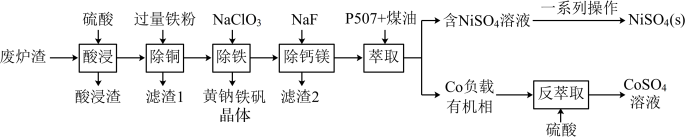
已知:
i.酸浸液中的金属阳离子有Ni2+、Co2+、Cu2+、Mg2+、Ca2+等;
ii.NiSO4在水中的溶解度随温度升高而增大;
iii.已知:Ksp(CaF2)=1×10-10、Ksp(MgF2)=7.5×10-11
(1)提高“酸浸”速率的方法有___________ 。(任写一条)
(2)基态Fe2+的价层电子排布图为___________ 。Fe的晶胞结构如图所示,已知NA表示阿伏加德罗常数的值,若晶胞参数为anm,则Fe晶胞的密度为___________ g·cm-3(用含NA和a的代数式表示)。

(3)黄钠铁矾的化学式为Na2Fe6(SO4)4(OH)12,“除铁”的离子方程式为___________ 。
(4)“除钙镁”时,随pH降低,NaF用量急剧增加,原因是___________ (结合平衡理论解释)。要使Ca2+、Mg2+完全沉淀,则溶液中F-的浓度c(F-)最小为___________ 。
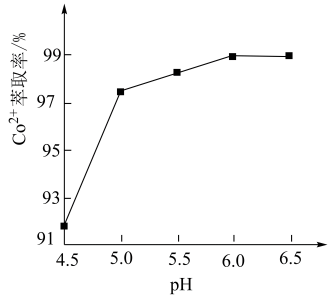
(5)萃取、反萃取:向除杂后的溶液中,加入某有机酸萃取剂(HA)2,发生反应:Co2++n(HA)2 CoA2·(n-1)(HA)2+2H+,实验测得:当溶液pH处于4.5~6.5范围内,Co2+萃取率随溶液pH的增大而增大(如图所示),其原因是
CoA2·(n-1)(HA)2+2H+,实验测得:当溶液pH处于4.5~6.5范围内,Co2+萃取率随溶液pH的增大而增大(如图所示),其原因是___________ 。反萃取是用反萃取剂使被萃取物从负载有机相返回水相的过程,为萃取的逆过程。反萃取剂可以选择下列哪种物质___________ (填选项)。
A.NaOH溶液 B.H2SO4溶液 C.ZnSO4溶液
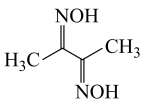
(6)丁二酮肟是检验Ni2的灵敏试剂,1mol丁二酮肟分子含有σ键数目为_______ (NA是阿伏加德罗常数的值)。从NiSO4溶液中获得精制硫酸镍NiSO4(s)所需采取的一系列操作是___________ 、过滤、洗涤、干燥。

已知:
i.酸浸液中的金属阳离子有Ni2+、Co2+、Cu2+、Mg2+、Ca2+等;
ii.NiSO4在水中的溶解度随温度升高而增大;
iii.已知:Ksp(CaF2)=1×10-10、Ksp(MgF2)=7.5×10-11
(1)提高“酸浸”速率的方法有
(2)基态Fe2+的价层电子排布图为

(3)黄钠铁矾的化学式为Na2Fe6(SO4)4(OH)12,“除铁”的离子方程式为
(4)“除钙镁”时,随pH降低,NaF用量急剧增加,原因是
(5)萃取、反萃取:向除杂后的溶液中,加入某有机酸萃取剂(HA)2,发生反应:Co2++n(HA)2
 CoA2·(n-1)(HA)2+2H+,实验测得:当溶液pH处于4.5~6.5范围内,Co2+萃取率随溶液pH的增大而增大(如图所示),其原因是
CoA2·(n-1)(HA)2+2H+,实验测得:当溶液pH处于4.5~6.5范围内,Co2+萃取率随溶液pH的增大而增大(如图所示),其原因是A.NaOH溶液 B.H2SO4溶液 C.ZnSO4溶液

(6)丁二酮肟是检验Ni2的灵敏试剂,1mol丁二酮肟分子含有σ键数目为

更新时间:2023-08-23 20:23:44
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】北宋沈括《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧。挹其水熬之则成胆矾,烹胆矾则成铜。熬胆矾铁釜,久之亦化为铜。”回答下列问题:
(1)基态Cu原子的电子排布式为___________ ; 量子力学把电子在原子核外的一个空间运动状态称为一个原子轨道,基态Cu原子核外电子有___________ 个空间运动状态。
(2)胆矾的化学式为CuSO4●5H2O, 其中SO 的空间构型为
的空间构型为___________
(3)Cu2+能与乙二胺四乙酸根阴离子 形成配离子,组成该阴离子的H、C、N、O四种元素的电负性由大到小的顺序是
形成配离子,组成该阴离子的H、C、N、O四种元素的电负性由大到小的顺序是___________ ,第一电离能最大的是___________ ;C、N原子的轨道杂化类型分别为___________ 、___________ 。
(4)某种合金的晶胞结构如图所示,晶体中K原子的配位数为___________ ;已知金属原子半径r(Na)和r(K),计算晶体的空间利用率: ___________ (假设原子是刚性球体)。(用代数式表示)

(1)基态Cu原子的电子排布式为
(2)胆矾的化学式为CuSO4●5H2O, 其中SO
 的空间构型为
的空间构型为(3)Cu2+能与乙二胺四乙酸根阴离子
 形成配离子,组成该阴离子的H、C、N、O四种元素的电负性由大到小的顺序是
形成配离子,组成该阴离子的H、C、N、O四种元素的电负性由大到小的顺序是(4)某种合金的晶胞结构如图所示,晶体中K原子的配位数为

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】化学学习和研究离不开元素周期表。下表为元素周期表的一部分,表中①-⑩分别代表一种元素。回答下列问题:
(1)上述元素中,有一种元素在自然界中形成的物质种类最多,该元素在周期表中的位置是_______ 。
(2)⑧、⑨、⑩元素的离子半径由大到小的顺序为________________ (用离子符号表示)。
(3)写出由①、⑥、⑧三种元素形成的一种离子化合物的电子式__________________ 。
(4)上述元素中有一种元素的氧化物和氢氧化物都有两性,面出该元素的原子结构示意图______________ ;高温条件下,该元素的单质与铁红能发生反应,此反应常用于野外焊接钢轨,则该反应的能量变化可用图__________________ 表示。(填“甲“或“乙”)

(5)已知W+X→Y+Z,且W、X、Y、Z分别是由①、⑤、⑥三种元素中的两种形成的10电子粒子,写出并配平上述反应式_________ 。
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ||
| 3 | ⑧ | ⑨ | ⑩ |
(2)⑧、⑨、⑩元素的离子半径由大到小的顺序为
(3)写出由①、⑥、⑧三种元素形成的一种离子化合物的电子式
(4)上述元素中有一种元素的氧化物和氢氧化物都有两性,面出该元素的原子结构示意图

(5)已知W+X→Y+Z,且W、X、Y、Z分别是由①、⑤、⑥三种元素中的两种形成的10电子粒子,写出并配平上述反应式
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】Fe、Ni均为Ⅷ族元素,与C、N、O、P等组成的化合物有广泛的用途。回答下列问题:
(1)基态Ni2+的价层电子轨道表达式为________ ,C、N、O的第一电离能从小到大的顺序为________ 。
(2)N、P可形成一些复杂离子,如(CH3)3NH+、NO2+、PCl6-等。
①(CH3)3NH+ 中N原子的杂化类型为___ ,NO2+的空间构型为______________ 。
②PCl5是一种白色固体,在加压下于148℃时液化,形成一种能导电的熔体。熔体能导电的原因是___________ 。
(3)Fe、Ni易与CO形成配合物,Fe(CO)5中σ键与π键个数比为______ ,Ni(CO)4熔点-25℃,沸点43℃,不溶于水,溶于乙醇、苯等有机溶剂,Ni(CO)4为______ 晶体。
(4)FeO、NiO的晶体类型与结构和NaCl相同。
① 熔点FeO_____ NiO(填“>”、“<”或“=”)。
② FeO 晶胞如下图,Fe2+的配位数为_______ 。
③ FeO在氧气中加热,部分Fe2+被氧化为Fe3+,晶体结构产生铁离子缺位的缺陷,其组成变为FexO(x<1),测得晶胞边长为a cm,密度为⍴g·cm-3,则x=_______ 。

(1)基态Ni2+的价层电子轨道表达式为
(2)N、P可形成一些复杂离子,如(CH3)3NH+、NO2+、PCl6-等。
①(CH3)3NH+ 中N原子的杂化类型为
②PCl5是一种白色固体,在加压下于148℃时液化,形成一种能导电的熔体。熔体能导电的原因是
(3)Fe、Ni易与CO形成配合物,Fe(CO)5中σ键与π键个数比为
(4)FeO、NiO的晶体类型与结构和NaCl相同。
① 熔点FeO
② FeO 晶胞如下图,Fe2+的配位数为
③ FeO在氧气中加热,部分Fe2+被氧化为Fe3+,晶体结构产生铁离子缺位的缺陷,其组成变为FexO(x<1),测得晶胞边长为a cm,密度为⍴g·cm-3,则x=

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】雷氏盐是一种铬的配合物(结构简式如图1),常用作分析试剂,制备反应为 (雷氏盐)
(雷氏盐) 。回答下列相关问题:
。回答下列相关问题:

(1) 的核外电子排布式为
的核外电子排布式为______ ;其基态原子核外电子的空间运动状态有______ 种;氟和氯处于同一主族, 的熔点为1100℃,
的熔点为1100℃, 的熔点为83℃,前者比后者高得多,是因为
的熔点为83℃,前者比后者高得多,是因为______ 。
(2)雷氏盐中与铬形成配位键的原子是______ ;中心原子的配位数为______ 。
(3) 中氮原子的杂化方式为
中氮原子的杂化方式为______ ,其立体构型的名称为______ 。
(4) 所含元素中电负性最小的是
所含元素中电负性最小的是______ (填元素符号,下同),它们的基态原子的第一电离能最大的是______ 。
(5)金属铬的晶胞结构如图2所示,设晶胞边长为 ,则铬的原子半径为
,则铬的原子半径为______  。
。
 (雷氏盐)
(雷氏盐) 。回答下列相关问题:
。回答下列相关问题:
(1)
 的核外电子排布式为
的核外电子排布式为 的熔点为1100℃,
的熔点为1100℃, 的熔点为83℃,前者比后者高得多,是因为
的熔点为83℃,前者比后者高得多,是因为(2)雷氏盐中与铬形成配位键的原子是
(3)
 中氮原子的杂化方式为
中氮原子的杂化方式为(4)
 所含元素中电负性最小的是
所含元素中电负性最小的是(5)金属铬的晶胞结构如图2所示,设晶胞边长为
 ,则铬的原子半径为
,则铬的原子半径为 。
。
您最近一年使用:0次
【推荐2】2020年10月,中国载人深潜器“奋斗者”号在马里亚纳海沟成功下潜突破1万米,“奋斗者”号选择了中国自主研发的全新高强高韧钛合金作为外壳材料,金属钛可用钙钛矿冶炼。请回答下列问题:
(1)Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是_____ 。
(2)钙钛矿(CaTiO3)的晶胞有A型和B型,将A型晶胞体心的Ti4+移至原点可得到B型晶胞。

①钛酸钙其中Ti4+的核外电子排布式为____ ;钛酸钙中两种阳离子中半径较大的是____ 。若某B型钙钛矿的晶胞密度为ρg/cm3,NA为阿伏加德罗常数的值,晶胞中氧离子之间的最短距离为___ cm(用含ρ和NA的代数式表示)。
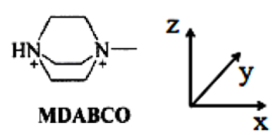
②某有机钙钛矿MDABCO-NH4I3具有A型钛酸钙晶胞结构。MDABCO(如图)所含元素电负性由大到小为_____ ,N原子的杂化轨道类型为_____ 。若在MDABCO-NH4I3的晶胞中MDABCO的分数坐标为(0,0,0),I-的一种分数坐标为( ,
, ,0),则
,0),则 的分数坐标为
的分数坐标为______ ,与MDABCO距离最近的I-有_____ 个。
(1)Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是
| 化合物 | TiF4 | TiCl4 | TiBr4 | TiI4 |
| 熔点/℃ | 377 | ﹣24.12 | 38.3 | 155 |
(2)钙钛矿(CaTiO3)的晶胞有A型和B型,将A型晶胞体心的Ti4+移至原点可得到B型晶胞。

①钛酸钙其中Ti4+的核外电子排布式为
②某有机钙钛矿MDABCO-NH4I3具有A型钛酸钙晶胞结构。MDABCO(如图)所含元素电负性由大到小为
 ,
, ,0),则
,0),则 的分数坐标为
的分数坐标为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐3】元素 、
、 、
、 、
、 、
、 、
、 均为原子序数小于18的常见元素,且原子序数依次增大。已知
均为原子序数小于18的常见元素,且原子序数依次增大。已知 原子最外层电子数与核外电子总数之比为
原子最外层电子数与核外电子总数之比为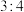 ,
, 原子的最外层电子数与次外层电子数之比为
原子的最外层电子数与次外层电子数之比为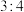 ;
; 比
比 的原子序数小1;
的原子序数小1; 与
与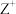 的电子层结构相同;化合物
的电子层结构相同;化合物 在常温下为气体。请回答下列问题:
在常温下为气体。请回答下列问题:
(1)写出 的简单离子的结构示意图:
的简单离子的结构示意图:______ 。
(2)由 、
、 、
、 三种元素形成的盐的化学式为
三种元素形成的盐的化学式为____________ 。
(3) 与
与 可形成2种分子,分别为10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式:
可形成2种分子,分别为10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式:____________ 。
(4)写出 的单质的一种工业用途:
的单质的一种工业用途:____________ 。
(5)如图表示由上述元素中的某两种元素组成的气体分子在密闭容器中,一定条件下充分反应前后的转化关系,该转化过程的化学方程式为____________ 。

(6) 是由
是由 、
、 、
、 、
、 四种元素组成的一种化合物,已知
四种元素组成的一种化合物,已知 既能与盐酸反应,又能与
既能与盐酸反应,又能与 溶液反应,还能和氯水反应,写出
溶液反应,还能和氯水反应,写出 与氯水反应的离子方程式:
与氯水反应的离子方程式:__________________ 。
 、
、 、
、 、
、 、
、 、
、 均为原子序数小于18的常见元素,且原子序数依次增大。已知
均为原子序数小于18的常见元素,且原子序数依次增大。已知 原子最外层电子数与核外电子总数之比为
原子最外层电子数与核外电子总数之比为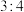 ,
, 原子的最外层电子数与次外层电子数之比为
原子的最外层电子数与次外层电子数之比为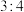 ;
; 比
比 的原子序数小1;
的原子序数小1; 与
与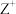 的电子层结构相同;化合物
的电子层结构相同;化合物 在常温下为气体。请回答下列问题:
在常温下为气体。请回答下列问题:(1)写出
 的简单离子的结构示意图:
的简单离子的结构示意图:(2)由
 、
、 、
、 三种元素形成的盐的化学式为
三种元素形成的盐的化学式为(3)
 与
与 可形成2种分子,分别为10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式:
可形成2种分子,分别为10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式:(4)写出
 的单质的一种工业用途:
的单质的一种工业用途:(5)如图表示由上述元素中的某两种元素组成的气体分子在密闭容器中,一定条件下充分反应前后的转化关系,该转化过程的化学方程式为

(6)
 是由
是由 、
、 、
、 、
、 四种元素组成的一种化合物,已知
四种元素组成的一种化合物,已知 既能与盐酸反应,又能与
既能与盐酸反应,又能与 溶液反应,还能和氯水反应,写出
溶液反应,还能和氯水反应,写出 与氯水反应的离子方程式:
与氯水反应的离子方程式:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】BaCl2可用于电子、仪表等工业。以毒重石(主要成分BaCO3,含少量CaCO3、MgSO4、Fe2O3、SiO2等杂质)为原料,模拟工业提取BaCl2·2H2O的流程如下:

已知:(1)Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
(2)离子浓度小于至1×10-5认为沉淀完全。
(1)滤渣I的成分为________ (填化学式),过滤所需玻璃仪器有______________ 。
(2)加入NaOH溶液后所得滤液III中,含有的Mg2+浓度为_____ ;加入H2C2O4时应避免过量,其原因是__________________________________ 。
(3)BaCl2母液中除了含有Ba+、Cl-外,还含有大量的______ (填离子符号)。有人从“绿色化学”角度设想将“母液”沿虚线进行循环使用,请分析在实际工业生产中是否可行,_______ (填“可行”或“不可行”),理由是_______________________ 。
(4)滤渣III是结石的主要成分,现将滤渣III 经过洗涤干燥后在有氧环境下进行热重分析,取146.0g灼烧,所得参数如下表。
滤渣III 的成分是__________ (填化学式);200~470℃时发生反应的化学方程式为___________ 。

已知:(1)Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
(2)离子浓度小于至1×10-5认为沉淀完全。
| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.0 | 3.7 |
(1)滤渣I的成分为
(2)加入NaOH溶液后所得滤液III中,含有的Mg2+浓度为
(3)BaCl2母液中除了含有Ba+、Cl-外,还含有大量的
(4)滤渣III是结石的主要成分,现将滤渣III 经过洗涤干燥后在有氧环境下进行热重分析,取146.0g灼烧,所得参数如下表。
| 温度(℃) | 常温 | 190〜200 | 470〜480 |
| 质量(g) | 146.0 | 128.0 | 100.0 |
滤渣III 的成分是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】氧桥三核铁(Ⅲ)配合物是一种结构新颖、性质优异的配合物,其化学式为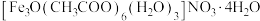 ,是一种红棕色晶体。其制备、元素分析及结构研究如下:
,是一种红棕色晶体。其制备、元素分析及结构研究如下:
(一)晶体制备:
将硝酸铁固体在80℃加热条件下溶于去离子水得到溶液,将此溶液逐滴滴入乙酸钠溶液中,充分反应,室温充分冷却、抽滤、洗涤、转移、烘干、称量并记录。
资料显示:硝酸铁固体在溶于水时部分水解、缩合成一种重要的中间体 。
。
(1)硝酸铁固体溶解时可以选用的加热方式是___________ ,加热的目的是___________ 。
(2)试写出由 生成中间体的离子方程式:
生成中间体的离子方程式:___________ 。
(二)铁含量测定:
准确称取a g产品配制成250 mL溶液,取25.00 mL溶液于锥形瓶中,加入盐酸酸化使配合物酸解为 ,再加入2滴磺基水杨酸钠(NaH2SSA)指示剂,用c mol/L EDTA二钠盐(
,再加入2滴磺基水杨酸钠(NaH2SSA)指示剂,用c mol/L EDTA二钠盐( )溶液滴定至终点,重复三次,平均消耗EDTA二钠盐溶液的体积为V mL。已知滴定过程中发生的反应如下:
)溶液滴定至终点,重复三次,平均消耗EDTA二钠盐溶液的体积为V mL。已知滴定过程中发生的反应如下:
 ;
;
 。
。
(3)该测定实验无需使用的实验仪器有___________ (填序号)。___________ 。
(5)产品中铁元素的含量是___________ (用含a、c、V的符号表示并化成百分数)。
(三)结构研究:
用X-射线衍射法测得氧桥三核铁(Ⅲ)配合物阳离子的结构如图1,对该晶体进行热重分析获得的热重曲线如图2:___________ 。
(7)由热重曲线可知,当升温至170℃时失去2分子水,研究发现这部分水属于配合物外界,简述该配合物中外界水较内界水易失去的原因可能是___________ 。
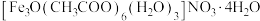 ,是一种红棕色晶体。其制备、元素分析及结构研究如下:
,是一种红棕色晶体。其制备、元素分析及结构研究如下:(一)晶体制备:
将硝酸铁固体在80℃加热条件下溶于去离子水得到溶液,将此溶液逐滴滴入乙酸钠溶液中,充分反应,室温充分冷却、抽滤、洗涤、转移、烘干、称量并记录。
资料显示:硝酸铁固体在溶于水时部分水解、缩合成一种重要的中间体
 。
。(1)硝酸铁固体溶解时可以选用的加热方式是
(2)试写出由
 生成中间体的离子方程式:
生成中间体的离子方程式:(二)铁含量测定:
准确称取a g产品配制成250 mL溶液,取25.00 mL溶液于锥形瓶中,加入盐酸酸化使配合物酸解为
 ,再加入2滴磺基水杨酸钠(NaH2SSA)指示剂,用c mol/L EDTA二钠盐(
,再加入2滴磺基水杨酸钠(NaH2SSA)指示剂,用c mol/L EDTA二钠盐( )溶液滴定至终点,重复三次,平均消耗EDTA二钠盐溶液的体积为V mL。已知滴定过程中发生的反应如下:
)溶液滴定至终点,重复三次,平均消耗EDTA二钠盐溶液的体积为V mL。已知滴定过程中发生的反应如下: ;
; 。
。(3)该测定实验无需使用的实验仪器有

(5)产品中铁元素的含量是
(三)结构研究:
用X-射线衍射法测得氧桥三核铁(Ⅲ)配合物阳离子的结构如图1,对该晶体进行热重分析获得的热重曲线如图2:

(7)由热重曲线可知,当升温至170℃时失去2分子水,研究发现这部分水属于配合物外界,简述该配合物中外界水较内界水易失去的原因可能是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】次氯酸溶液是常用的消毒剂漂白剂。某学习小组根据需要欲制备浓度不小于0.8 mol·L-1的次氯酸溶液。
[查阅资料]
资料1:常温常压下,Cl2O为棕黄色气体,沸点为3.8℃,42℃以上会分解生成Cl2和O2,Cl2O易溶于水并与水立即发生化合反应生成HClO。
资料2:将氯气和空气(不参与反应)按体积比1∶3混合通入潮湿的碳酸钠中发生反应:2Cl2+2Na2CO3+H2O=Cl2O+2NaCl+2NaHCO3,用水吸收Cl2O(不含Cl2)制得次氯酸。
[装置及实验]用以下装置制备次氯酸溶液
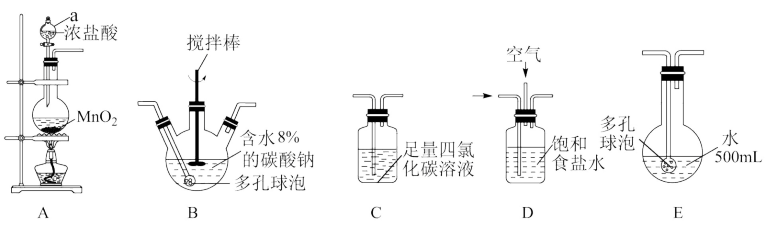
回答下列问题:
(1)仪器a名称___________ 。
(2)装置A中反应的化学方程式是___________ 。其中氧化剂与还原剂的物质的量之比为___________ 。
(3)各装置的连接顺序为A→___________→___________→___________→E。___________
(4)装置E中反应的化学方程式是___________ 。反应过程中,装置B需放在冷水中,其目的是___________ 。
(5)装置C的主要作用是___________ 。
(6)此方法相对于用氯气直接溶于水制备次氯酸溶液的优点是:___________ 。(答出一条即可)
[查阅资料]
资料1:常温常压下,Cl2O为棕黄色气体,沸点为3.8℃,42℃以上会分解生成Cl2和O2,Cl2O易溶于水并与水立即发生化合反应生成HClO。
资料2:将氯气和空气(不参与反应)按体积比1∶3混合通入潮湿的碳酸钠中发生反应:2Cl2+2Na2CO3+H2O=Cl2O+2NaCl+2NaHCO3,用水吸收Cl2O(不含Cl2)制得次氯酸。
[装置及实验]用以下装置制备次氯酸溶液

回答下列问题:
(1)仪器a名称
(2)装置A中反应的化学方程式是
(3)各装置的连接顺序为A→___________→___________→___________→E。
(4)装置E中反应的化学方程式是
(5)装置C的主要作用是
(6)此方法相对于用氯气直接溶于水制备次氯酸溶液的优点是:
您最近一年使用:0次



