氮氧化物对环境有着巨大的危害,一种利用尿素[CO(NH2)2]脱硝的反应原理为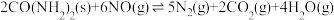 △H<0,回答下列问题:
△H<0,回答下列问题:
(1)T℃时,往2L的恒容密闭容器中加入5molCO(NH2)2(s)和3 mol NO(g),容器内混合气体总物质的量随时间的变化如图所示。
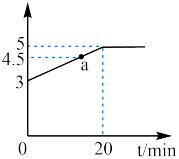
①20min末,容器内N2的物质的量为_______ mol;0~20min内,NO的平均反应速率为_______ mol·L-l·min-l。
②a点时v正_______ (填“>”、“<”或“=”)v逆,此时NO的转化率为_______ %;平衡时与初始时容器内的压强比为_______ 。
(2)向恒温恒容的密闭容器中,加入一定量的CO(NH2)2(s)和NO(g),能够说明该反应达到平衡的是_______(填标号)。
(3)汽车尾气中含有CO和NO等有害气体,三元催化转化器可将汽车尾气中的CO和NO转化为CO2和N2,每生成14gN2,反应放出373kJ热量,该反应的热化学方程式为_______ 。
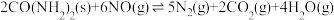 △H<0,回答下列问题:
△H<0,回答下列问题:(1)T℃时,往2L的恒容密闭容器中加入5molCO(NH2)2(s)和3 mol NO(g),容器内混合气体总物质的量随时间的变化如图所示。

①20min末,容器内N2的物质的量为
②a点时v正
(2)向恒温恒容的密闭容器中,加入一定量的CO(NH2)2(s)和NO(g),能够说明该反应达到平衡的是_______(填标号)。
| A.混合气体的密度不再改变 | B.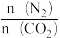 不再改变 不再改变 |
| C.混合气体中,H2O的物质的量分数不再改变 | D.3v正(NO)=v逆(CO2) |
更新时间:2023-08-31 08:04:23
|
相似题推荐
【推荐1】中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%〜50%。减少CO2排放是一项重要课题。CO2经催化加氢可以生成低碳有机物,主要有以下反应:
反应 Ⅰ: CO2(g)+4H2(g) CH4(g)+2H20(g) △H=-203.0kJ·mol-1
CH4(g)+2H20(g) △H=-203.0kJ·mol-1
反应 Ⅱ:2CO2(g)+6H2(g) C2H4(g)+4H20(g) △H=-127.8kJ·mol-1
C2H4(g)+4H20(g) △H=-127.8kJ·mol-1
反应Ⅲ: CO2(g)+3H2(g) CH3OH(g)+H20(g) △H=-49.0kJ·mol-1
CH3OH(g)+H20(g) △H=-49.0kJ·mol-1
请回答下列问题:
(1)已知:H2的燃烧热为285.8kJ·mol-1,且H2O(g) H20(1) △H=-44.0kJ·mol-1。则表示C2H4燃烧热的热化学方程式为:
H20(1) △H=-44.0kJ·mol-1。则表示C2H4燃烧热的热化学方程式为:______________________ 。
(2)恒温恒容条件下,在密闭容器中通入等物质的的C02和H2,若只发生反应Ⅲ,下列描述能说明已经达到平衡状态的是____________________ (填序号)。
A.反应热保持不变
B.容器内的平均相对分子质量保持不变
C.水分子中断裂2NA个H-0键,同时氢分子中断裂3NA个H-H键
D.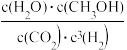 保持不变
保持不变
(3)在一恒容密闭容器中,通入一定量的C02和H2发生反应Ⅲ,测得在相同时间、不同温度下,C02的转化率a(C02)的变化如图所示,回答问题:
①若温度维持在400℃更长时间,C02的转化率将________ 85% (填“>”、“=”或“<”,下同)。
②反应速率:B点的v(逆)___________ E点的v(逆)

(4)为分析催化剂对反应Ⅰ和反应Ⅱ的选择性,在1L密闭容器中充入amolCO2和bmol H2 在催化剂作用下发生反应,测得平衡时有关物质的物质的量随温度变化如下图所示。
①该催化剂在较高温度时主要选择___________ (填“反应Ⅰ”或“反应Ⅱ”),T1℃时,反应Ⅱ的平衡常数K=___________ (只列算式不计算)
②一定能提高CO2转化为C2H4的转化率并加快反应速率的措施:___________ (填选项)
A.升高温度并控制在T2℃左右
B.增大CO2和H2的初始投料比
C.投料比不变,增加反应物浓度
D.将生成的乙烯(C2H4)及时移出
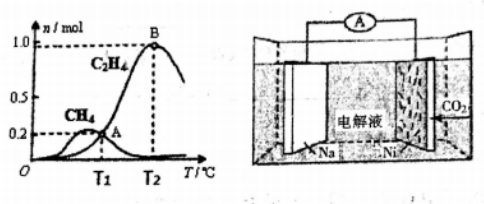
(5)利用“Na-CO2电池将CO2变废为宝。我国科学家研发了一种室温下“可呼吸”的 Na-CO2二次电池。将NaCl04溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为3C02+4Na 2Na2CO3+C,其工作原理如上图所示:
2Na2CO3+C,其工作原理如上图所示:
①放电时,正极的电极反应式为____________________________________________ 。
②充电时___________ C02。 (填“吸收”或“释放”)
反应 Ⅰ: CO2(g)+4H2(g)
 CH4(g)+2H20(g) △H=-203.0kJ·mol-1
CH4(g)+2H20(g) △H=-203.0kJ·mol-1反应 Ⅱ:2CO2(g)+6H2(g)
 C2H4(g)+4H20(g) △H=-127.8kJ·mol-1
C2H4(g)+4H20(g) △H=-127.8kJ·mol-1反应Ⅲ: CO2(g)+3H2(g)
 CH3OH(g)+H20(g) △H=-49.0kJ·mol-1
CH3OH(g)+H20(g) △H=-49.0kJ·mol-1请回答下列问题:
(1)已知:H2的燃烧热为285.8kJ·mol-1,且H2O(g)
 H20(1) △H=-44.0kJ·mol-1。则表示C2H4燃烧热的热化学方程式为:
H20(1) △H=-44.0kJ·mol-1。则表示C2H4燃烧热的热化学方程式为:(2)恒温恒容条件下,在密闭容器中通入等物质的的C02和H2,若只发生反应Ⅲ,下列描述能说明已经达到平衡状态的是
A.反应热保持不变
B.容器内的平均相对分子质量保持不变
C.水分子中断裂2NA个H-0键,同时氢分子中断裂3NA个H-H键
D.
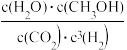 保持不变
保持不变 (3)在一恒容密闭容器中,通入一定量的C02和H2发生反应Ⅲ,测得在相同时间、不同温度下,C02的转化率a(C02)的变化如图所示,回答问题:
①若温度维持在400℃更长时间,C02的转化率将
②反应速率:B点的v(逆)

(4)为分析催化剂对反应Ⅰ和反应Ⅱ的选择性,在1L密闭容器中充入amolCO2和bmol H2 在催化剂作用下发生反应,测得平衡时有关物质的物质的量随温度变化如下图所示。
①该催化剂在较高温度时主要选择
②一定能提高CO2转化为C2H4的转化率并加快反应速率的措施:
A.升高温度并控制在T2℃左右
B.增大CO2和H2的初始投料比
C.投料比不变,增加反应物浓度
D.将生成的乙烯(C2H4)及时移出

(5)利用“Na-CO2电池将CO2变废为宝。我国科学家研发了一种室温下“可呼吸”的 Na-CO2二次电池。将NaCl04溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为3C02+4Na
 2Na2CO3+C,其工作原理如上图所示:
2Na2CO3+C,其工作原理如上图所示:①放电时,正极的电极反应式为
②充电时
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】为了实现“将全球温度上升幅度控制在2℃以内”的目标,科学家正在研究温室气体CO2的转化和利用。
(1)海洋是地球上碳元素的最大“吸收池”
①溶于海水中的CO2主要以四种无机碳形式存在,分别为CO2、H2CO3、CO32-和_________ (填离子符号)。
②在海洋中,可通过如图所示的途径来固碳。则发生光合作用时,CO2与H2O反应生成(CH2O)x和O2的化学方程式为__________________ 。

(2)有科学家提出可利用FeO来吸收CO2,已知:
C(s)+2H2O(g) CO2(g)+2H2(g) △H=+113.4 kJ·mol-1
CO2(g)+2H2(g) △H=+113.4 kJ·mol-1
3FeO(s)+H2O(g) Fe3O4(s)+H2(g) △H=+18.7 kJ·mol-1
Fe3O4(s)+H2(g) △H=+18.7 kJ·mol-1
则6FeO(s)+CO2(g) 2Fe3O4(s)+C(s) △H=
2Fe3O4(s)+C(s) △H=_____ kJ·mol-1。
(3)以CO2为原料可制备甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g),向一恒容密闭容器中充入1moCO2(g)和3molH2(g),测得CO2(g)和CH3OH(g)的浓度随时间的变化如图所示。
CH3OH(g)+H2O(g),向一恒容密闭容器中充入1moCO2(g)和3molH2(g),测得CO2(g)和CH3OH(g)的浓度随时间的变化如图所示。

①若A点的正反应速率用v正(CO2)来表示,A点的逆反应速率用v逆(CO2)来表示,则v正(CO2)_______ (填“>”“ <”或“=”)v逆(CO2)。
②0~3min内,氢气的平均反应速率v(H2)_______________ 。
(4)在一定条件下,二氧化碳转化为甲烷:CO2(g)+4H2(g) CH4(g)+2 H2O(g),△H。向一密闭容积正充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时测得c(CO2)= 0.2 mol·L-1,c(H2) =0.8 mol·L-1,c(H2O)=1.6mol·L-1。则该温度下上述反应的平衡常数K=
CH4(g)+2 H2O(g),△H。向一密闭容积正充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时测得c(CO2)= 0.2 mol·L-1,c(H2) =0.8 mol·L-1,c(H2O)=1.6mol·L-1。则该温度下上述反应的平衡常数K= ________ 。若200℃时该反应的平衡常数K=64.8,则该反应的△H_____ (填“>’’或“<”)O。
(1)海洋是地球上碳元素的最大“吸收池”
①溶于海水中的CO2主要以四种无机碳形式存在,分别为CO2、H2CO3、CO32-和
②在海洋中,可通过如图所示的途径来固碳。则发生光合作用时,CO2与H2O反应生成(CH2O)x和O2的化学方程式为

(2)有科学家提出可利用FeO来吸收CO2,已知:
C(s)+2H2O(g)
 CO2(g)+2H2(g) △H=+113.4 kJ·mol-1
CO2(g)+2H2(g) △H=+113.4 kJ·mol-1 3FeO(s)+H2O(g)
 Fe3O4(s)+H2(g) △H=+18.7 kJ·mol-1
Fe3O4(s)+H2(g) △H=+18.7 kJ·mol-1则6FeO(s)+CO2(g)
 2Fe3O4(s)+C(s) △H=
2Fe3O4(s)+C(s) △H=(3)以CO2为原料可制备甲醇:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),向一恒容密闭容器中充入1moCO2(g)和3molH2(g),测得CO2(g)和CH3OH(g)的浓度随时间的变化如图所示。
CH3OH(g)+H2O(g),向一恒容密闭容器中充入1moCO2(g)和3molH2(g),测得CO2(g)和CH3OH(g)的浓度随时间的变化如图所示。
①若A点的正反应速率用v正(CO2)来表示,A点的逆反应速率用v逆(CO2)来表示,则v正(CO2)
②0~3min内,氢气的平均反应速率v(H2)
(4)在一定条件下,二氧化碳转化为甲烷:CO2(g)+4H2(g)
 CH4(g)+2 H2O(g),△H。向一密闭容积正充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时测得c(CO2)= 0.2 mol·L-1,c(H2) =0.8 mol·L-1,c(H2O)=1.6mol·L-1。则该温度下上述反应的平衡常数K=
CH4(g)+2 H2O(g),△H。向一密闭容积正充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时测得c(CO2)= 0.2 mol·L-1,c(H2) =0.8 mol·L-1,c(H2O)=1.6mol·L-1。则该温度下上述反应的平衡常数K=
您最近一年使用:0次
【推荐3】甲醇既是重要的化工原料,又可作为燃料,以CO2为原料在催化剂作用下合成甲醇,有如下可能发生的反应。回答下列问题:
(1)CO2与氢气或水蒸气反应均能制得甲醇,相关数据如下表,实际生产中应选用_______ 反应(填A或B);原因是_______ 。
(2)二氧化碳加氢制甲醇的总反应可表示为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH=-49kJ·mol-1。该反应一般认为通过如下步骤来实现:
①CO2(g)+H2(g)=CO(g)+H2O(g) ΔH1=+41kJ·mol-1
②CO(g)+2H2(g)=CH3OH(g) ∆H2=________ kJ·mol-1
若反应①为慢反应(慢反应的活化能较高),图中能体现上述反应能量变化的是________ (填标号)。

(3)在溶积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变得情况下,考察温度对反应的影响,实验结果如图所示(注:T1、T2均大于300°C);

下列说法正确的是_______ (填序号)。
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)= mol·L-1·min-1
mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时=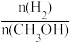 增大
增大
(4)甲醇燃料电池(如图),具备低温快速启动、燃料洁净环保以及电池结构简单等优点。使得甲醇燃料电池可能成为未来便携式电子产品应用的主流。

①在图中用箭头画出电子转移方向_______ 。
②写出电池负极电极反应式_______ 。
(1)CO2与氢气或水蒸气反应均能制得甲醇,相关数据如下表,实际生产中应选用
| 反应(25°C、101kPa) | ΔH/kJ·mol-1 | ΔS/J·mol-1·K-1 | K |
A:CO2(g)+3H2(g) CH3OH(g)+H2O(g) CH3OH(g)+H2O(g) | -48.97 | -177.16 | 6.8×10-3 |
B:CO2(g)+2H2O(g) CH3OH(g)+ CH3OH(g)+ O2(g) O2(g) | +676.48 | -43.87 | <1.0×10-5 |
①CO2(g)+H2(g)=CO(g)+H2O(g) ΔH1=+41kJ·mol-1
②CO(g)+2H2(g)=CH3OH(g) ∆H2=
若反应①为慢反应(慢反应的活化能较高),图中能体现上述反应能量变化的是

(3)在溶积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变得情况下,考察温度对反应的影响,实验结果如图所示(注:T1、T2均大于300°C);

下列说法正确的是
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)=
 mol·L-1·min-1
mol·L-1·min-1②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时=
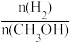 增大
增大(4)甲醇燃料电池(如图),具备低温快速启动、燃料洁净环保以及电池结构简单等优点。使得甲醇燃料电池可能成为未来便携式电子产品应用的主流。

①在图中用箭头画出电子转移方向
②写出电池负极电极反应式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】运用化学反应原理研究碳、氮、硫等单质及其化合物的反应有重要意义;
(1)甲醇是重要的可再生燃料。已知在常温常压下:
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ∆H=-1275.6kJ/mol
2CO(g)+O2(g)=2CO2(g) ∆H=-556.0kJ/mol
H2O(g)=H2O(l) ∆H=-44.0kJ/mol
甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_________ 。
(2)利用催化氧化反应将转化为是工业上生产硫酸的关键步骤.
①一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生上述反应,能说明该反应已达到平衡状态的是________ 。
a.体系的密度不发生变化
b.体系中硫元素的质量百分含量不再变化
c.SO2与SO3的体积比保持不变
d.容器内的气体分子总数不再变化
e.单位时间内转移4 mol电子,同时消耗2molSO3
②T℃时,在1L密闭容器中充入0.6 molSO3,下图表示SO3物质的量随时间的变化曲线。达到平衡时,用SO2表示的化学反应速率为________ ;SO3的转化率为________ (保留小数点后-位):T℃时,反应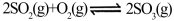 的平衡常数为
的平衡常数为_______ ;T℃其他条件不变,在8min时压缩容器体积至0.5 L,则n(SO3)的变化曲线为________ (填字母)。
(3)有人设想以N2和H2为反应物,以溶有A物质的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示。
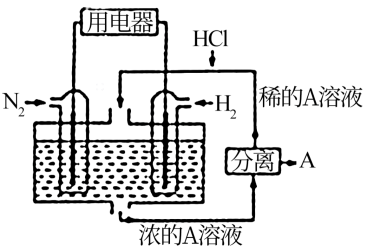
电池正极的电极反应式是_____ 电解质溶液的pH______ (填写增大、减小、不变),A.物质是______ (写化学式)。
(1)甲醇是重要的可再生燃料。已知在常温常压下:
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ∆H=-1275.6kJ/mol
2CO(g)+O2(g)=2CO2(g) ∆H=-556.0kJ/mol
H2O(g)=H2O(l) ∆H=-44.0kJ/mol
甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为
(2)利用催化氧化反应将转化为是工业上生产硫酸的关键步骤.
①一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生上述反应,能说明该反应已达到平衡状态的是
a.体系的密度不发生变化
b.体系中硫元素的质量百分含量不再变化
c.SO2与SO3的体积比保持不变
d.容器内的气体分子总数不再变化
e.单位时间内转移4 mol电子,同时消耗2molSO3
②T℃时,在1L密闭容器中充入0.6 molSO3,下图表示SO3物质的量随时间的变化曲线。达到平衡时,用SO2表示的化学反应速率为
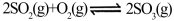 的平衡常数为
的平衡常数为
(3)有人设想以N2和H2为反应物,以溶有A物质的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示。

电池正极的电极反应式是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】合成氨是人类科学技术的一项重大突破。完成下列填空:
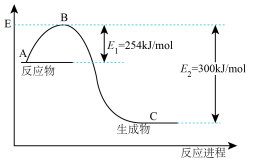
(1)如图表示未用催化剂时, 和
和 反应生成
反应生成 时的能量变化。写出该反应的热化学方程式:
时的能量变化。写出该反应的热化学方程式:___________ 。在如图画出加入正催化剂后,反应的能量变化示意图______ 。
(2)该反应的熵变 ,则a
,则a___________ 0(填“>”或“<”),该反应能自发进行的温度(T)范围是___________ (用含a的不等式表示)。
(3)在恒温、恒容密闭容器中进行上述反应,能说明该反应已达到平衡状态的是___________。(选填编号)
(4)在温度分别为 、
、 时,固定
时,固定 的投入量,起始
的投入量,起始 的物质的量与平衡时
的物质的量与平衡时 的物质的量分数关系如图。
的物质的量分数关系如图。
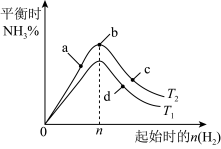
图像中 和
和 的关系是:
的关系是:
___________  。(选填“>”、“<”或“=”)
。(选填“>”、“<”或“=”)
a、b、c、d四点中, 转化率最高的是:
转化率最高的是:___________ 。
(5)某温度下,向一4L恒容密闭容器中充入 和
和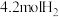 。20min后,
。20min后, 的浓度为
的浓度为 ,用
,用 表示的20min内平均反应速率为
表示的20min内平均反应速率为___________ ,此时浓度商(Q)的数值为___________ 。若此时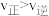 ,则Q
,则Q___________ K(填“>”、“<”或“=”,K表示该温度下反应的平衡常数)
(6)电化学法合成氨是常温合成氨的重要研究领域。如图是一种电化学合成氨过程的示意图。
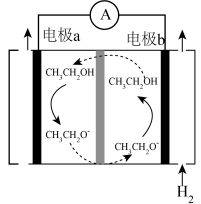
该装置的电极a是___________ 极,b电极的电极反应式为___________ 。

(1)如图表示未用催化剂时,
 和
和 反应生成
反应生成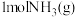 时的能量变化。写出该反应的热化学方程式:
时的能量变化。写出该反应的热化学方程式:(2)该反应的熵变
 ,则a
,则a(3)在恒温、恒容密闭容器中进行上述反应,能说明该反应已达到平衡状态的是___________。(选填编号)
A.容器内 、 、 、 、 的浓度之比为1∶3∶2 的浓度之比为1∶3∶2 |
B. 质量分数保持不变 质量分数保持不变 |
| C.容器内气体压强保持不变 |
| D.混合气体的密度保持不变 |
 、
、 时,固定
时,固定 的投入量,起始
的投入量,起始 的物质的量与平衡时
的物质的量与平衡时 的物质的量分数关系如图。
的物质的量分数关系如图。
图像中
 和
和 的关系是:
的关系是:
 。(选填“>”、“<”或“=”)
。(选填“>”、“<”或“=”)a、b、c、d四点中,
 转化率最高的是:
转化率最高的是:(5)某温度下,向一4L恒容密闭容器中充入
 和
和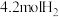 。20min后,
。20min后, 的浓度为
的浓度为 ,用
,用 表示的20min内平均反应速率为
表示的20min内平均反应速率为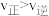 ,则Q
,则Q(6)电化学法合成氨是常温合成氨的重要研究领域。如图是一种电化学合成氨过程的示意图。

该装置的电极a是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】二氧化碳催化加氢制甲醇,不仅有利于减少温室气体二氧化碳,而且还可以获得大量的重要有机化工原料甲醇。回答下列问题:
(1)二氧化碳加氢制甲醇的总反应可表示为:CO2(g)+3H2(g) CH3OH(g)+H2O(g)平衡常数K,该反应一般认为通过如下步骤来实现:
CH3OH(g)+H2O(g)平衡常数K,该反应一般认为通过如下步骤来实现:
i.CO2(g)+H2(g) CO(g)+H2O(g) ΔH=+41kJ/mol 平衡常数K1
CO(g)+H2O(g) ΔH=+41kJ/mol 平衡常数K1
ii.CO(g)+2H2(g) CH3OH(g) ΔH=-90kJ/mol 平衡常数K2
CH3OH(g) ΔH=-90kJ/mol 平衡常数K2
则总反应的ΔH=___________ kJ/mol;平衡常数K=___________ (用K1、K2表示)。
(2)碳及其化合物间的转化广泛存在于自然界及人类的生产和生活中。
已知25℃,100kPa时:1mol葡萄糖[C6H12O6(s)]完全燃烧生成CO2(g)和H2O(l),放出2804kJ热量。
CO(g)+ O2(g)=CO2(g) ΔH=-283kJ·mol-1。
O2(g)=CO2(g) ΔH=-283kJ·mol-1。
回答问题:
①25℃时,CO2(g)与H2O(l)经光合作用生成葡萄糖[C6H12O6(s)]和O2(g)的热化学方程式为___________ 。
②25℃,100kPa时,气态分子断开1mol化学键的焓变称为键焓。已知O=O、C≡O键的键焓分别为495kJ·mol-1、799kJ·mol-1,CO2(g)分子中碳氧键的键焓为___________ kJ·mol-1。
(3)若T1时时将6mo1CO2和8mo1H2充入容积为2L的密闭容器中发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),H2的物质的量变化如下表所示。
CH3OH(g)+H2O(g),H2的物质的量变化如下表所示。
①在T1℃条件下0-5min内,以CO2表示的该反应速率v(CO2)=___________ ,该条件下的平衡常数K=___________ 。
②若15min时,保持T1不变,向该容器中再加入该四种反应混合物各1mol,则此时反应___________ 移动(填“正向”、“逆向”或“不”),反应速率v(CO2、正)___________ 反应速率v(CO2、逆)(填“>”、“<”、“=”)。
(1)二氧化碳加氢制甲醇的总反应可表示为:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)平衡常数K,该反应一般认为通过如下步骤来实现:
CH3OH(g)+H2O(g)平衡常数K,该反应一般认为通过如下步骤来实现:i.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH=+41kJ/mol 平衡常数K1
CO(g)+H2O(g) ΔH=+41kJ/mol 平衡常数K1ii.CO(g)+2H2(g)
 CH3OH(g) ΔH=-90kJ/mol 平衡常数K2
CH3OH(g) ΔH=-90kJ/mol 平衡常数K2则总反应的ΔH=
(2)碳及其化合物间的转化广泛存在于自然界及人类的生产和生活中。
已知25℃,100kPa时:1mol葡萄糖[C6H12O6(s)]完全燃烧生成CO2(g)和H2O(l),放出2804kJ热量。
CO(g)+
 O2(g)=CO2(g) ΔH=-283kJ·mol-1。
O2(g)=CO2(g) ΔH=-283kJ·mol-1。回答问题:
①25℃时,CO2(g)与H2O(l)经光合作用生成葡萄糖[C6H12O6(s)]和O2(g)的热化学方程式为
②25℃,100kPa时,气态分子断开1mol化学键的焓变称为键焓。已知O=O、C≡O键的键焓分别为495kJ·mol-1、799kJ·mol-1,CO2(g)分子中碳氧键的键焓为
(3)若T1时时将6mo1CO2和8mo1H2充入容积为2L的密闭容器中发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),H2的物质的量变化如下表所示。
CH3OH(g)+H2O(g),H2的物质的量变化如下表所示。| 物质的量/mol | T1/℃ | T2/℃ | |||||
| 0 | 5min | 10min | 15min | 20min | 25min | 30min | |
| H2 | 8.0 | 3.5 | 2.0 | 2.0 | 15 | 1.0 | 1.0 |
②若15min时,保持T1不变,向该容器中再加入该四种反应混合物各1mol,则此时反应
您最近一年使用:0次



