用惰性电极电解500mL一定浓度的硫酸铜溶液,通电一段时间后,需要加入0.1mol的碱式碳酸铜[Cu2(OH)2CO3],才能恢复到电解前的浓度,电解过程中转移的电子为
| A.0.4mol | B.0.6mol | C.0.8mol | D.无法确定 |
更新时间:2023-09-04 20:58:26
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】Na2S2O3可作为漂白布匹后的“脱氯剂”。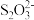 和Cl2反应的产物之一为
和Cl2反应的产物之一为 。下列说法正确的是
。下列说法正确的是
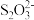 和Cl2反应的产物之一为
和Cl2反应的产物之一为 。下列说法正确的是
。下列说法正确的是A.该反应中的氧化剂是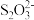 |
B.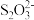 在强酸性条件下发生反应生成能使品红褪色的物质 在强酸性条件下发生反应生成能使品红褪色的物质 |
C.上述反应中,每生成1 mol ,可脱去1mol Cl2 ,可脱去1mol Cl2 |
| D.SO2也可用做纺织工业的漂白剂,但不能用于食品加工工业 |
您最近一年使用:0次
【推荐2】氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:aHClO3═bO2↑+cCl2↑+dHClO4+eH2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色。下列说法正确的是
| A.由反应可确定:氧化性:HClO4>HClO3 |
| B.变蓝的淀粉碘化钾试纸褪色是因为可能发生了:4Cl2+I2+6H2O═12H++8Cl-+2IO3- |
| C.若氯酸分解所得混合气体,1 mol混合气体质量为47.6 g,则反应方程式可表示为26HClO3 ═15O2↑+8Cl2↑+10HClO4+8H2O |
| D.若化学计量数a=8,b=3,则该反应转移电子数为20e- |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】研究人员设计出一种新型太阳能催化电解装置,利用过渡金属化合物作催化剂制得合成气,同时减少温室气体的排放。下列说法不正确的是


| A.M是光电池的负极 |
| B.阳极电极反应式为2H2O-4e-=O2↑+ 4H+ |
| C.该装置工作一段时间后,H3PO4与KH2PO4混合液的pH增大 |
| D.A极收集到0.5 mol合成气时,B极收集到0.25mol氧气 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】下列有关叙述不正确的是
| A.华为mate系列手机采用的大容量高密度电池是一种二次电池 |
| B.铅蓄电池充电时,标示“+”的接线柱连接电源正极 |
| C.港珠澳大桥桥底镶嵌锌块,锌作负极,以防大桥被腐蚀 |
| D.电解精炼铜工业中,阳极溶解的铜与阴极析出的铜质量相等 |
您最近一年使用:0次
【推荐1】ClO2是一种高效安全的杀菌消毒剂。用氯化钠电解法生成ClO2的工艺原理示意图如图,发生器内电解生成ClO2。下列说法正确的是( )


| A.a气体是氯气,b气体是氢气 |
| B.为使a、b气体恰好完全反应,理论上每生产1molClO2需要补充56L(标准状况)b气体 |
| C.ClO2发生器中的还原反应为:2ClO3-+12H++10e-=Cl2↑+6H2O |
| D.氯化钠电解槽内每生成2mola气体,转移2mole- |
您最近一年使用:0次
【推荐2】由于锂电池中不含有重金属镉,与镍镉电池相比,大大减少了对环境的污染。一种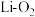 电池的电解质为DMSO有机液体,能传导Li+,电池反应为
电池的电解质为DMSO有机液体,能传导Li+,电池反应为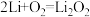 ,开发新型高效催化剂是提高循环寿命和往返效率的重要环节,充电时某一电极可溶性催化剂RM催化过程如图∶
,开发新型高效催化剂是提高循环寿命和往返效率的重要环节,充电时某一电极可溶性催化剂RM催化过程如图∶
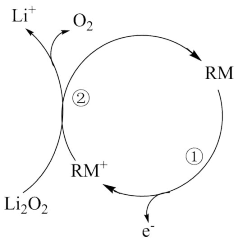
下列说法错误的是
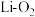 电池的电解质为DMSO有机液体,能传导Li+,电池反应为
电池的电解质为DMSO有机液体,能传导Li+,电池反应为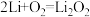 ,开发新型高效催化剂是提高循环寿命和往返效率的重要环节,充电时某一电极可溶性催化剂RM催化过程如图∶
,开发新型高效催化剂是提高循环寿命和往返效率的重要环节,充电时某一电极可溶性催化剂RM催化过程如图∶
下列说法错误的是
A.放电时,正极反应为 |
B.充电时,每转移2mole ,阳极质量减少46g ,阳极质量减少46g |
| C.上述催化过程在阴极上发生,电解质换成氢氧化钠水溶液效率更高 |
D.催化过程②的反应为∶ |
您最近一年使用:0次

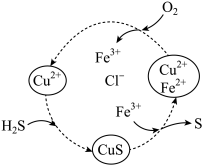
 Mg+Cl2
Mg+Cl2 以制备高附加值化学品是实现碳中和的有效方法之一,将
以制备高附加值化学品是实现碳中和的有效方法之一,将 的原理如图所示。下列说法正确的是
的原理如图所示。下列说法正确的是
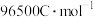 ,法拉第常数与电子物质的量
,法拉第常数与电子物质的量 的乘积等于电量。
的乘积等于电量。 时,理论上可还原
时,理论上可还原 (标准状况下)
(标准状况下) ,则处理
,则处理 (标准状况下)
(标准状况下) 的电量
的电量

