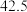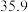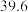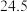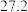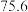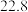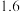已知X、Y、Z、W、R、M为原子序数依次增大的元素,其中X、Y、Z、W、R为短周期主族元素,且位于三个不同周期,Y的某种核素可用于测定文物的年代,W的最外层电子数是最内层的3倍,W与R同主族,元素M是地壳中含量排名第二的金属元素。回答下列问题:
(1)写出 的电子式:
的电子式:_____ 。
(2)W的简单氢化物的熔沸点比R的高,原因是_____ 。
(3)Y、Z、R的最高价氧化物对应水化物的酸性最弱的是_____ (填化学式)。
X、Y、Z、R组成的某种酸的水溶液可用于检测溶液中的 ,该酸的化学式为
,该酸的化学式为_____ 。
(4)X、Y、W组成的某种常见物质常用于制作消毒剂,该物质的燃烧热为1366.8 ,写出该物质燃烧的热化学方程式:
,写出该物质燃烧的热化学方程式:_____ 。
(5) 与
与 的反应是可逆反应,该反应的平衡常数的表达式为
的反应是可逆反应,该反应的平衡常数的表达式为_____ ;增加 的量,
的量, 的平衡转化率如何变化?
的平衡转化率如何变化?_____ 。
(1)写出
 的电子式:
的电子式:(2)W的简单氢化物的熔沸点比R的高,原因是
(3)Y、Z、R的最高价氧化物对应水化物的酸性最弱的是
X、Y、Z、R组成的某种酸的水溶液可用于检测溶液中的
 ,该酸的化学式为
,该酸的化学式为(4)X、Y、W组成的某种常见物质常用于制作消毒剂,该物质的燃烧热为1366.8
 ,写出该物质燃烧的热化学方程式:
,写出该物质燃烧的热化学方程式:(5)
 与
与 的反应是可逆反应,该反应的平衡常数的表达式为
的反应是可逆反应,该反应的平衡常数的表达式为 的量,
的量, 的平衡转化率如何变化?
的平衡转化率如何变化?
更新时间:2023-10-15 11:22:30
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】碳及其化合物在化工生产中有着广泛的应用。
I.为解决大气中CO2的含量增大的问题,某科学家提出如下构想:
把工厂排出的富含CO2的废气经净化吹入碳酸钾溶液吸收,然后再把CO2从溶液中提取出来,在合成塔中经化学反应使废气中的CO2转变为燃料甲醇。
部分技术流程如下:
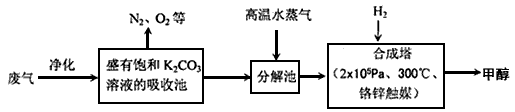
⑴合成塔中反应的化学方程式为____________ ;△H<0。该反应为可逆反应,从平衡移动原理分析,低温有利于提高原料气的平衡转化率。而实际生产中采用300℃的温度,除考虑温度对反应速率的影响外,还主要考虑了___________________________________________________________________ 。
(2)从合成塔分离出甲醇的原理与下列_______ 操作的原理比较相符(填字母)
A.过滤B.分液C.蒸馈D.结晶
(3)如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4。写出CO2(g)与H2(g)反应生CH4(g)与液态水的热化学方程式:
已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-890.3kJ/mol
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ/mol
_______________________________________________________________________ 。
II.甲烷燃烧会放出大量的热,可作为能源应用于人类的生产和生活。
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l);△H1=-1214.6kJ/mol
②CO2(g)=CO(g)+1/2O2(g);△H2=+283.0kJ/mol
则表示甲烷燃烧热的热化学方程式______________________________ 。
III.某兴趣小组模拟工业合成甲醇的反应:CO(g)+2H2(g) CH3OH(g),在容积固定为2L的密闭容器中充入1mol CO 2mol H2,加入合适的催化剂(催化剂体积忽略不计)后开始反应。测得容器内的压强随时间变化如下:
CH3OH(g),在容积固定为2L的密闭容器中充入1mol CO 2mol H2,加入合适的催化剂(催化剂体积忽略不计)后开始反应。测得容器内的压强随时间变化如下:
(1)从反应开始到20min时,以CO表示反应速率为_____________________ 。
(2)下列描述能说明反应达到平衡的是_______________________
A.装置内气体颜色不再改变B.容器内气体的平均摩尔质量保持不变
C.容器内气体的压强保持不变D.容器内气体密度保持不变
(3)该温度下平衡常数K=____ ,若达到平衡后加入少量CH3OH(g),此时平衡常数K值将____ (填“增大”、“减小”或“不变”)
(4)该反应达到平衡后,再向容器中充入1mol CO 2mol H2,此时CO的转化率将__________ (填“增大”、“减小”或“不变”)
I.为解决大气中CO2的含量增大的问题,某科学家提出如下构想:
把工厂排出的富含CO2的废气经净化吹入碳酸钾溶液吸收,然后再把CO2从溶液中提取出来,在合成塔中经化学反应使废气中的CO2转变为燃料甲醇。
部分技术流程如下:

⑴合成塔中反应的化学方程式为
(2)从合成塔分离出甲醇的原理与下列
A.过滤B.分液C.蒸馈D.结晶
(3)如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4。写出CO2(g)与H2(g)反应生CH4(g)与液态水的热化学方程式:
已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-890.3kJ/mol
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ/mol
II.甲烷燃烧会放出大量的热,可作为能源应用于人类的生产和生活。
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l);△H1=-1214.6kJ/mol
②CO2(g)=CO(g)+1/2O2(g);△H2=+283.0kJ/mol
则表示甲烷燃烧热的热化学方程式
III.某兴趣小组模拟工业合成甲醇的反应:CO(g)+2H2(g)
 CH3OH(g),在容积固定为2L的密闭容器中充入1mol CO 2mol H2,加入合适的催化剂(催化剂体积忽略不计)后开始反应。测得容器内的压强随时间变化如下:
CH3OH(g),在容积固定为2L的密闭容器中充入1mol CO 2mol H2,加入合适的催化剂(催化剂体积忽略不计)后开始反应。测得容器内的压强随时间变化如下:| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
| 压强/Mpa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
(1)从反应开始到20min时,以CO表示反应速率为
(2)下列描述能说明反应达到平衡的是
A.装置内气体颜色不再改变B.容器内气体的平均摩尔质量保持不变
C.容器内气体的压强保持不变D.容器内气体密度保持不变
(3)该温度下平衡常数K=
(4)该反应达到平衡后,再向容器中充入1mol CO 2mol H2,此时CO的转化率将
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】甲醇(CH3OH)又称“木醇”或“木精”,沸点64.7℃,是无色有酒精气味易挥发的液体。甲醇有毒,误饮5~10 mL能双目失明,大量饮用会导致死亡。甲醇是重要的化学工业基础原料和液体燃料,可用于制造甲醛和农药。
(1)工业上可利用CO2和H2生产甲醇,方程式如下:
CO2(g)+3H2(g)=CH3OH(1)+H2O(g) △H=Q1 kJ·mol-1
又查资料得知:①CH3OH(1)+ O2(g)=CO2(g)+2H2(g) △H=Q2 kJ·mol-1
O2(g)=CO2(g)+2H2(g) △H=Q2 kJ·mol-1
②H2O(g)=H2O(1) △H=Q3 kJ·mol-1,则表示甲醇燃烧热的热化学方程式为___ 。
(2)甲醇燃料电池是符合绿色化学理念的新型燃料电池,如图是以甲醇燃料电池(甲池)为电源的电解装置。已知:A、B、C、D、E、F都是惰性电极,丙中为0.1 mol·L-1 CuSO4溶液(假设反应前后溶液体积不变),当向甲池通入物质a和b时,D极附近呈红色。
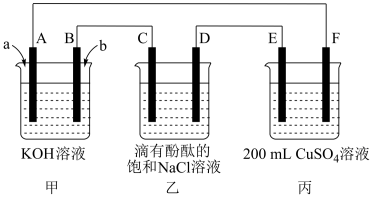
①物质b的化学式为___ ,A电极的电极反应式为___ 。
②乙装置中总反应的离子方程式为___ 。
③当乙装置中C电极收集到224 mL(标况下)气体时,丙中溶液的pH=___ 。
(1)工业上可利用CO2和H2生产甲醇,方程式如下:
CO2(g)+3H2(g)=CH3OH(1)+H2O(g) △H=Q1 kJ·mol-1
又查资料得知:①CH3OH(1)+
 O2(g)=CO2(g)+2H2(g) △H=Q2 kJ·mol-1
O2(g)=CO2(g)+2H2(g) △H=Q2 kJ·mol-1②H2O(g)=H2O(1) △H=Q3 kJ·mol-1,则表示甲醇燃烧热的热化学方程式为
(2)甲醇燃料电池是符合绿色化学理念的新型燃料电池,如图是以甲醇燃料电池(甲池)为电源的电解装置。已知:A、B、C、D、E、F都是惰性电极,丙中为0.1 mol·L-1 CuSO4溶液(假设反应前后溶液体积不变),当向甲池通入物质a和b时,D极附近呈红色。

①物质b的化学式为
②乙装置中总反应的离子方程式为
③当乙装置中C电极收集到224 mL(标况下)气体时,丙中溶液的pH=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】化学反应中均伴随着能量的变化,回答下列问题:
(1)某同学进行如下实验,图①和②中温度计示数降低的是_______ ;
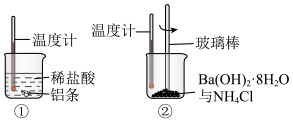
(2)有机物M可转化成N,转化过程如下,则M、N相比,较稳定的是_______ ;
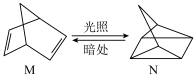
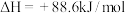
(3)已知 在一定条件下可发生如图的一系列反应,下列说法正确的是_______;
在一定条件下可发生如图的一系列反应,下列说法正确的是_______;
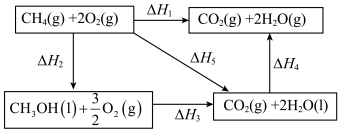
(4)金属Ni可活化 放出
放出 ,其反应历程如图所示:
,其反应历程如图所示:
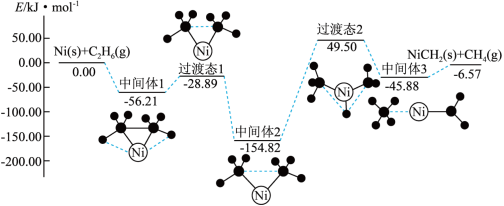
下列关于活化历程的说法正确的是_______。
(5) 与
与 经催化重整,制得合成气:
经催化重整,制得合成气: 已知上述反应中相关的化学键键能数据如下,则该反应的
已知上述反应中相关的化学键键能数据如下,则该反应的
_______ kJ/mol。
(6)在25℃、101kPa下,1g乙烷气体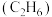 燃烧生成
燃烧生成 和液态水时放热QkJ,则表示乙烷燃烧热的热化学方程式为
和液态水时放热QkJ,则表示乙烷燃烧热的热化学方程式为_______ 。
(7)中和热的测定实验中,取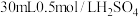 溶液与50mL0.5mol/LNaOH溶液进行中和反应,三次实验温度平均升高4℃,已知溶液的比热容近似为
溶液与50mL0.5mol/LNaOH溶液进行中和反应,三次实验温度平均升高4℃,已知溶液的比热容近似为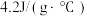 ,溶液的密度均近似为
,溶液的密度均近似为 。通过计算可得稀硫酸和稀NaOH溶液的中和热
。通过计算可得稀硫酸和稀NaOH溶液的中和热
_______ kJ/mol。
(1)某同学进行如下实验,图①和②中温度计示数降低的是

(2)有机物M可转化成N,转化过程如下,则M、N相比,较稳定的是

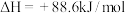
(3)已知
 在一定条件下可发生如图的一系列反应,下列说法正确的是_______;
在一定条件下可发生如图的一系列反应,下列说法正确的是_______;
A. | B.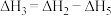 |
C. | D. |
(4)金属Ni可活化
 放出
放出 ,其反应历程如图所示:
,其反应历程如图所示:
下列关于活化历程的说法正确的是_______。
| A.中间体1→中间体2的过程是放热过程 |
| B.加入催化剂可降低该反应的反应热,加快反应速率 |
C.1molNi和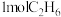 的总能量小于 的总能量小于 和 和 的总能量 的总能量 |
| D.中间体2→中间体3的过程是决速步骤 |
(5)
 与
与 经催化重整,制得合成气:
经催化重整,制得合成气: 已知上述反应中相关的化学键键能数据如下,则该反应的
已知上述反应中相关的化学键键能数据如下,则该反应的
| 化学键 |  |  |  | 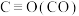 |
| 键能/(kJ/mol) | 413 | 745 | 436 | 1075 |
(6)在25℃、101kPa下,1g乙烷气体
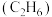 燃烧生成
燃烧生成 和液态水时放热QkJ,则表示乙烷燃烧热的热化学方程式为
和液态水时放热QkJ,则表示乙烷燃烧热的热化学方程式为(7)中和热的测定实验中,取
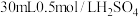 溶液与50mL0.5mol/LNaOH溶液进行中和反应,三次实验温度平均升高4℃,已知溶液的比热容近似为
溶液与50mL0.5mol/LNaOH溶液进行中和反应,三次实验温度平均升高4℃,已知溶液的比热容近似为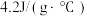 ,溶液的密度均近似为
,溶液的密度均近似为 。通过计算可得稀硫酸和稀NaOH溶液的中和热
。通过计算可得稀硫酸和稀NaOH溶液的中和热
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】化学反应速率和限度与生产、生活密切相关。
Ⅰ.某同学探究外界条件对 分解速率的影响。
分解速率的影响。
实验所用试剂: 溶液、蒸馏水、
溶液、蒸馏水、 粉末、
粉末、 粉末。
粉末。
(1)本实验待测数据可以是___________ 。
(2)实验1、3的目的是在其他条件相同时,研究___________ 对 分解速率的影响。
分解速率的影响。
(3)实验3、4所测得的数据,能否比较 和
和 的催化效果?
的催化效果?___________ (填“能”或“不能”),请说明理由___________ 。
(4)实验3、5是在其他条件相同时,探究浓度对该化学反应速率的影响。m处取用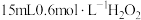 溶液,还应添加的试剂及用量为
溶液,还应添加的试剂及用量为___________ 。(混合后溶液体积变化忽略不计)
Ⅱ.某温度下,在容积恒定为 的密闭容器中充入
的密闭容器中充入 和
和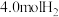 ,一段时间后反应
,一段时间后反应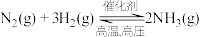 达到平衡状态,实验数据如下表所示:
达到平衡状态,实验数据如下表所示:
(5)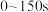 内的平均反应速率
内的平均反应速率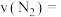
___________ ,250s时, 的转化率为
的转化率为___________ 。
(6)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g),B(g)所需的能量,用符号E表示,单位为 。
。 的键能为
的键能为 的键能为
的键能为 ,
, 的键能为
的键能为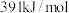 ,则生成
,则生成 过程中
过程中___________ (填“吸收”或“放出”)的能量为___________  。
。
(7)为加快反应速率,可以采取的措施是___________ (填字母)。
a.降低温度 b.减小容器容积
d.恒压时充入 气 d.恒容时充入
气 d.恒容时充入 气
气
(8)下列情况不能说明该反应一定达到平衡的是___________ (填字母)。
a.
b.混合气体的密度不再变化
c.混合气体的平均相对分子质量不再变化
d.体系压强不再变化
Ⅰ.某同学探究外界条件对
 分解速率的影响。
分解速率的影响。实验所用试剂:
 溶液、蒸馏水、
溶液、蒸馏水、 粉末、
粉末、 粉末。
粉末。| 实验序号 |  溶液 溶液 | 温度 | 催化剂 | |
| 浓度(mol/L) |  | |||
| 1 | 0.6 | 30 | 室温 | 无 |
| 2 | 0.6 | 30 | 50℃ | 无 |
| 3 | 0.6 | 30 | 室温 |  |
| 4 | 0.6 | 30 | 室温 |  |
| 5 | 0.3 | m | 室温 |  |
(2)实验1、3的目的是在其他条件相同时,研究
 分解速率的影响。
分解速率的影响。(3)实验3、4所测得的数据,能否比较
 和
和 的催化效果?
的催化效果?(4)实验3、5是在其他条件相同时,探究浓度对该化学反应速率的影响。m处取用
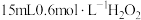 溶液,还应添加的试剂及用量为
溶液,还应添加的试剂及用量为Ⅱ.某温度下,在容积恒定为
 的密闭容器中充入
的密闭容器中充入 和
和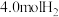 ,一段时间后反应
,一段时间后反应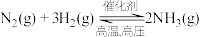 达到平衡状态,实验数据如下表所示:
达到平衡状态,实验数据如下表所示: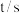 | 0 | 50 | 150 | 250 | 350 |
 | 0 | 0.24 | 0.30 | 0.40 | 0.40 |
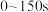 内的平均反应速率
内的平均反应速率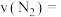
 的转化率为
的转化率为(6)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g),B(g)所需的能量,用符号E表示,单位为
 。
。 的键能为
的键能为 的键能为
的键能为 ,
, 的键能为
的键能为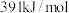 ,则生成
,则生成 过程中
过程中 。
。(7)为加快反应速率,可以采取的措施是
a.降低温度 b.减小容器容积
d.恒压时充入
 气 d.恒容时充入
气 d.恒容时充入 气
气(8)下列情况不能说明该反应一定达到平衡的是
a.

b.混合气体的密度不再变化
c.混合气体的平均相对分子质量不再变化
d.体系压强不再变化
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】2021年10月27日,以“探索与展望第五次工业革命中时尚产业的方向和绿色共识”为主题的2021气候创新·时尚峰会在柯桥举行。大会倡导绿色、低碳、循环、可持续的发展方式,共同构建新型世界纺织产业命运共同体。
(1)已知下列热化学方程式:
ⅰ.
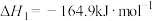
ⅱ.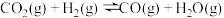

已知在某种催化剂的作用下, 的正反应的活化能
的正反应的活化能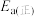 为
为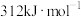 ,则该反应逆反应的活化能
,则该反应逆反应的活化能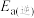 为
为_________  。
。
(2)将 的混合气体充入反应器中,气体总压强为
的混合气体充入反应器中,气体总压强为 ,平衡时
,平衡时 、
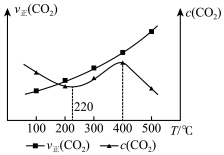
、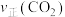 与温度的关系如图所示。
与温度的关系如图所示。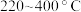 时,
时, 的浓度随温度升高而增大的原因是
的浓度随温度升高而增大的原因是______________________ 。
(3)在使用某种催化剂催化 加氢合成乙烯的反应时,所得产物含
加氢合成乙烯的反应时,所得产物含 、
、 、
、 等副产物。若在催化剂中添加
等副产物。若在催化剂中添加 、
、 、
、 助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得
助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得 转化率和各产物的物质的量分数如下表。
转化率和各产物的物质的量分数如下表。
欲提高单位时间内乙烯的产量,在催化剂中添加________ 助剂效果最好;加入助剂能提高单位时间内乙烯产量的根本原因是______________________________________ 。
(4)在 时,向容积为
时,向容积为 的恒容密闭容器中充入
的恒容密闭容器中充入 和一定量的
和一定量的 发生反应:
发生反应: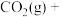
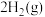
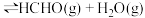
 。起始时体系总压为
。起始时体系总压为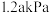 。平衡时体系总压
。平衡时体系总压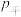 与起始时
与起始时 的关系如图所示:
的关系如图所示:
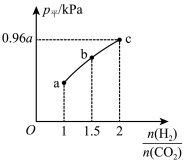
①若 时反应到达c点,则
时反应到达c点,则
_________  。
。
②b点时反应的化学平衡常数
_________ 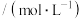 。
。
③c点时,再加入 和
和 各
各 ,则
,则 的转化率
的转化率________ (填“增大”、“不变”或“减小”)。
(1)已知下列热化学方程式:
ⅰ.

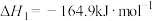
ⅱ.
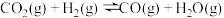

已知在某种催化剂的作用下,
 的正反应的活化能
的正反应的活化能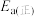 为
为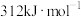 ,则该反应逆反应的活化能
,则该反应逆反应的活化能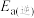 为
为 。
。(2)将
 的混合气体充入反应器中,气体总压强为
的混合气体充入反应器中,气体总压强为 ,平衡时
,平衡时 、
、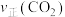 与温度的关系如图所示。
与温度的关系如图所示。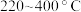 时,
时, 的浓度随温度升高而增大的原因是
的浓度随温度升高而增大的原因是
(3)在使用某种催化剂催化
 加氢合成乙烯的反应时,所得产物含
加氢合成乙烯的反应时,所得产物含 、
、 、
、 等副产物。若在催化剂中添加
等副产物。若在催化剂中添加 、
、 、
、 助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得
助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得 转化率和各产物的物质的量分数如下表。
转化率和各产物的物质的量分数如下表。助剂 |
| 各产物在所有产物中的占比/% | ||
|
| 其他 | ||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
欲提高单位时间内乙烯的产量,在催化剂中添加
(4)在
 时,向容积为
时,向容积为 的恒容密闭容器中充入
的恒容密闭容器中充入 和一定量的
和一定量的 发生反应:
发生反应: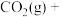
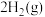
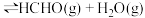
 。起始时体系总压为
。起始时体系总压为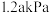 。平衡时体系总压
。平衡时体系总压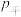 与起始时
与起始时 的关系如图所示:
的关系如图所示:
①若
 时反应到达c点,则
时反应到达c点,则
 。
。②b点时反应的化学平衡常数

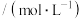 。
。③c点时,再加入
 和
和 各
各 ,则
,则 的转化率
的转化率
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】合成气(主要成分为CO、 及少量CO、
及少量CO、 )在工业上有广泛用途。
)在工业上有广泛用途。
(1) △H<0也称为水煤气变换反应(简称WGS),主要应用在制氢工业和合成氨工业。在金属催化剂Au(Ⅲ)表面上发生的所有基元反应步骤的活化能数值(单位:kJ/mol)如表,其中*表示催化剂表面活性位,X*表示金属表面活性位吸附物种。其他条件一定时,决定WGS反应速率的基元反应为
△H<0也称为水煤气变换反应(简称WGS),主要应用在制氢工业和合成氨工业。在金属催化剂Au(Ⅲ)表面上发生的所有基元反应步骤的活化能数值(单位:kJ/mol)如表,其中*表示催化剂表面活性位,X*表示金属表面活性位吸附物种。其他条件一定时,决定WGS反应速率的基元反应为_______ (填编号),基元反应 的焓变△H=
的焓变△H=_______ kJ/mol。由表中数据计算WGS反应的焓变△H=_______ kJ/mol。
(2)合成甲醇的主要反应为: △H<0。将CO与
△H<0。将CO与 混合气体充入密闭容器中,投料比
混合气体充入密闭容器中,投料比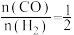 ,测得平衡时混合气体中
,测得平衡时混合气体中 的物质的量分数[
的物质的量分数[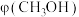 ]与温度(T)、压强(p)之间的关系如图所示。
]与温度(T)、压强(p)之间的关系如图所示。

①图像中
_______  (填“>”、“<”或“=”,下同)。温度为
(填“>”、“<”或“=”,下同)。温度为 和
和 时对应的平衡常数分别为
时对应的平衡常数分别为 、
、 ,则
,则
_______  。
。
② 、
、 时,CO的转化率为
时,CO的转化率为_______ (保留3位有效数字)﹔压强平衡常数
_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,用含 的代数式表示)。在该条件下,若CO、
的代数式表示)。在该条件下,若CO、 、
、 气体的起始物质的量之比为2∶1∶2,则反应开始时
气体的起始物质的量之比为2∶1∶2,则反应开始时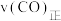
_______ 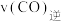 。
。
③恒温恒容条件下,下列叙述不能说明反应达到化学平衡状态的是_______ 。
A.CO、 的物质的量浓度不再随时间的变化而变化
的物质的量浓度不再随时间的变化而变化
B.混合气体的平均摩尔质量不再随时间的变化而变化
C.混合气体的密度不再随时间的变化而变化
D.若将容器改为绝热恒容容器时,平衡常数K不随时间变化而变化
 及少量CO、
及少量CO、 )在工业上有广泛用途。
)在工业上有广泛用途。(1)
 △H<0也称为水煤气变换反应(简称WGS),主要应用在制氢工业和合成氨工业。在金属催化剂Au(Ⅲ)表面上发生的所有基元反应步骤的活化能数值(单位:kJ/mol)如表,其中*表示催化剂表面活性位,X*表示金属表面活性位吸附物种。其他条件一定时,决定WGS反应速率的基元反应为
△H<0也称为水煤气变换反应(简称WGS),主要应用在制氢工业和合成氨工业。在金属催化剂Au(Ⅲ)表面上发生的所有基元反应步骤的活化能数值(单位:kJ/mol)如表,其中*表示催化剂表面活性位,X*表示金属表面活性位吸附物种。其他条件一定时,决定WGS反应速率的基元反应为 的焓变△H=
的焓变△H=| 基元反应 | 正逆反应活化能 | ||
 | 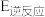 | ||
| ① | 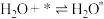 | 0 | 67 |
| ② | 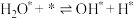 | 150 | 0 |
| ③ |  | 71 | 67 |
| ④ | 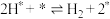 | 74 | 25 |
| ⑤ | 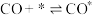 | 0 | 42 |
| ⑥ |  | 37 | 203 |
| ⑦ | 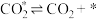 | 17 | 0 |
 △H<0。将CO与
△H<0。将CO与 混合气体充入密闭容器中,投料比
混合气体充入密闭容器中,投料比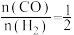 ,测得平衡时混合气体中
,测得平衡时混合气体中 的物质的量分数[
的物质的量分数[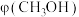 ]与温度(T)、压强(p)之间的关系如图所示。
]与温度(T)、压强(p)之间的关系如图所示。
①图像中

 (填“>”、“<”或“=”,下同)。温度为
(填“>”、“<”或“=”,下同)。温度为 和
和 时对应的平衡常数分别为
时对应的平衡常数分别为 、
、 ,则
,则
 。
。②
 、
、 时,CO的转化率为
时,CO的转化率为
 的代数式表示)。在该条件下,若CO、
的代数式表示)。在该条件下,若CO、 、
、 气体的起始物质的量之比为2∶1∶2,则反应开始时
气体的起始物质的量之比为2∶1∶2,则反应开始时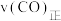
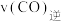 。
。③恒温恒容条件下,下列叙述不能说明反应达到化学平衡状态的是
A.CO、
 的物质的量浓度不再随时间的变化而变化
的物质的量浓度不再随时间的变化而变化B.混合气体的平均摩尔质量不再随时间的变化而变化
C.混合气体的密度不再随时间的变化而变化
D.若将容器改为绝热恒容容器时,平衡常数K不随时间变化而变化
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】短周期主族元素A、B、C、D、E、F、G的原子序数依次增大,在元素周期表中A的原子半径最小,B与C相邻且 的最外层电子数是次外层的3倍,D为同周期中金属性最强的元素,C、F同主族,E是地壳中含量最多的金属元素。回答下列问题:
的最外层电子数是次外层的3倍,D为同周期中金属性最强的元素,C、F同主族,E是地壳中含量最多的金属元素。回答下列问题:
(1)C在元素周期表中的位置为第_______ 周期_______ 族,G的元素符号是_______ 。
(2)B的原子结构示意图为_______
(3)比较 和
和 离子半径大小:
离子半径大小:_______ (用离子符号表示);
(4)比较 和
和 简单氢化物的热稳定性强弱:
简单氢化物的热稳定性强弱:_______ (用化学式表示)。
(5) 和
和 的最高价氧化物的水化物酸性较强的是
的最高价氧化物的水化物酸性较强的是_______ (用化学式表示)。
(6) 的氧化物与
的氧化物与 的最高价氧化物对应水化物的溶液反应的离子方程式为
的最高价氧化物对应水化物的溶液反应的离子方程式为_______ 。
 的最外层电子数是次外层的3倍,D为同周期中金属性最强的元素,C、F同主族,E是地壳中含量最多的金属元素。回答下列问题:
的最外层电子数是次外层的3倍,D为同周期中金属性最强的元素,C、F同主族,E是地壳中含量最多的金属元素。回答下列问题:(1)C在元素周期表中的位置为第
(2)B的原子结构示意图为
(3)比较
 和
和 离子半径大小:
离子半径大小:(4)比较
 和
和 简单氢化物的热稳定性强弱:
简单氢化物的热稳定性强弱:(5)
 和
和 的最高价氧化物的水化物酸性较强的是
的最高价氧化物的水化物酸性较强的是(6)
 的氧化物与
的氧化物与 的最高价氧化物对应水化物的溶液反应的离子方程式为
的最高价氧化物对应水化物的溶液反应的离子方程式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】下表为元素周期表的一部分。
回答下列问题:
(1)表中元素原子半径最大的是(写元素符号)___ ,Y原子的电子排布式是__ ,Z原子核外电子能量最高的电子亚层是___ 。
(2)下列事实能说明Y元素的非金属性比S元素强的是___ ;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1mol Y单质比1mol S得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(3)CCl4是一种常见的有机溶剂,写出其电子式___ ,判断其属于含有___ (填“极性”、“非极性”)共价键的____ 分子(填“极性”或“非极性”)。SiH4的沸点比CH4高,原因是___ 。
(4)碳酸钠溶液中滴入酚酞,溶液显红色,请用离子方程式说明产生该现象的原因:___ ,在上述红色的溶液中加入少许氯化钙固体,溶液颜色变浅,请用平衡理论解释产生该现象的原因____ 。
| 碳 | 氮 | Y | |
| X | 硫 | Z |
回答下列问题:
(1)表中元素原子半径最大的是(写元素符号)
(2)下列事实能说明Y元素的非金属性比S元素强的是
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1mol Y单质比1mol S得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(3)CCl4是一种常见的有机溶剂,写出其电子式
(4)碳酸钠溶液中滴入酚酞,溶液显红色,请用离子方程式说明产生该现象的原因:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐3】如图是元素周期表的一部分,回答下列问题:
(1)元素Ga在元素周期表中的位置为:第________ 周期第________ 族。
(2)Sn的最高正价为________ ,Cl的最高价氧化物对应的水化物的化学式为________ ,Bi的最高价氧化物的化学式为________ 。
(3)根据元素周期律,推断:
①最后一列部分元素氢化物热稳定性最高的是________ (填元素符号)。
②H3AsO4、H2SeO4的酸性强弱:H3AsO4________ H2SeO4(填“>”或“<”下同)。
(4)H2O2的电子式为_______________________ AS的原子结构示意图为__________________________
(5)3.01×1023个OH-含有质子的物质的量为________ mol,这些OH-和________ gNa+含有的电子数相同。
(6)标准状况下,1.92g某气体的体积为672mL,则该气体的摩尔质量为________ ;
(7)等质量的SO2和SO3的物质的量之比________ ;氧原子个数比为________ ;
| B | C | N | O | F |
| Al | Si | P | S | Cl |
| Ga | Ge | As | Se | Br |
| In | Sn | Sb | Te | I |
| Tl | Pb | Bi | Po | At |
(2)Sn的最高正价为
(3)根据元素周期律,推断:
①最后一列部分元素氢化物热稳定性最高的是
②H3AsO4、H2SeO4的酸性强弱:H3AsO4
(4)H2O2的电子式为
(5)3.01×1023个OH-含有质子的物质的量为
(6)标准状况下,1.92g某气体的体积为672mL,则该气体的摩尔质量为
(7)等质量的SO2和SO3的物质的量之比
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】回答下列问题:
(1)符号“3px”没有给出的信息是___________
A.能层 B.能级 C.电子云在空间的伸展方向 D.电子的自旋方向
(2)下列比较正确的是___________
A.酸性:H3PO4<H3AsO4 B.熔点:SiH4>CH4
C.离子半径:r(Al3+)>r(O2-) D.键角:H2O>NH3
(3)下列实验事实不能用氢键来解释的是___________
A.CH4比SiH4稳定
B.乙醇能与水以任意比互溶
C.邻羟基苯甲醛的沸点低于对羟基苯甲醛
D.接近沸点的水蒸气的相对分子质量测量值大于18
E.冰的密度比液态水的密度小
(4)X元素的原子最外层电子排布式为(n+1)sn(n+1)pn+1,则X的氢化物的化学式是___________
(5)某元素基态原子4s轨道上有1个电子,则该元素基态原子价电子排布可能是___________
(6)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般d0或d10排布无颜色,d1~d9排布有颜色。如[Co(H2O)6]2+显粉红色。据此判断:[Mn(H2O)6]2+___________ (填“无”或“有”)颜色。
(7)过渡金属易与CO形成羰基配合物,如Ni(CO)4、Fe(CO)5等,配合物[Ni(CO)4]常温下为液态,易溶于CCl4、苯等有机溶剂。
① [Ni(CO)4]固态时属于___________ 分子(填极性或非极性)。
②[Ni(CO)4]中Ni与CO的___________ 原子形成配位键。不考虑空间构型,[Ni(CO)4]的结构可用示意图表示为___________ (用“→”表示出配位键) 。
③Ni(CO)4分子中π键与σ键个数比为___________ 。
④Fe(CO)5在一定条件下发生分解反应:Fe(CO)5(s)=Fe(s)+5CO(g)。反应过程中,断裂的化学键类型是___________ ,形成的化学键类型是金属键。
(1)符号“3px”没有给出的信息是
A.能层 B.能级 C.电子云在空间的伸展方向 D.电子的自旋方向
(2)下列比较正确的是
A.酸性:H3PO4<H3AsO4 B.熔点:SiH4>CH4
C.离子半径:r(Al3+)>r(O2-) D.键角:H2O>NH3
(3)下列实验事实不能用氢键来解释的是
A.CH4比SiH4稳定
B.乙醇能与水以任意比互溶
C.邻羟基苯甲醛的沸点低于对羟基苯甲醛
D.接近沸点的水蒸气的相对分子质量测量值大于18
E.冰的密度比液态水的密度小
(4)X元素的原子最外层电子排布式为(n+1)sn(n+1)pn+1,则X的氢化物的化学式是
(5)某元素基态原子4s轨道上有1个电子,则该元素基态原子价电子排布可能是
(6)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般d0或d10排布无颜色,d1~d9排布有颜色。如[Co(H2O)6]2+显粉红色。据此判断:[Mn(H2O)6]2+
(7)过渡金属易与CO形成羰基配合物,如Ni(CO)4、Fe(CO)5等,配合物[Ni(CO)4]常温下为液态,易溶于CCl4、苯等有机溶剂。
① [Ni(CO)4]固态时属于
②[Ni(CO)4]中Ni与CO的
③Ni(CO)4分子中π键与σ键个数比为
④Fe(CO)5在一定条件下发生分解反应:Fe(CO)5(s)=Fe(s)+5CO(g)。反应过程中,断裂的化学键类型是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】在化学实验和科学研究中,水是一种常用的试剂。
(1)水分子中的氧原子在基态时的价电子排布式为_______ 。
(2)水分子在特定条件下容易得到一个H+而形成水合氢离子(H3O+)。对上述过程的下列描述不合理的是_______。
(3)在冰晶体中,每个水分子与相邻的_______ 个水分子形成氢键,水分子间还存在_______ ,H2O的VSEPR模型为_______ 。
(4)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配位离子。请写出生成此配位离子的离子方程式:_______ 。1mol此配离子含有共价键数目为_______ 。
(1)水分子中的氧原子在基态时的价电子排布式为
(2)水分子在特定条件下容易得到一个H+而形成水合氢离子(H3O+)。对上述过程的下列描述不合理的是_______。
| A.微粒的形状发生了改变 | B.氧原子的杂化类型发生了改变 |
| C.微粒的化学性质发生了改变 | D.微粒中的键角发生了改变 |
(4)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配位离子。请写出生成此配位离子的离子方程式:
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】我国科学家研发的全球首套“液态阳光”项目使双碳目标更近一步。该项目通过太阳能发电电解水制氢,再将 加氢合成
加氢合成 。
。
(1)太阳能电池板的主要材料为单晶硅。
①单晶硅属于_______ 晶体。
②单晶硅的熔点低于金刚石的,原因是_______ 。
(2)在催化剂作用下, 与
与 反应得到
反应得到 。
。
① 分子的空间结构为
分子的空间结构为_______ 。
② 和
和 分子中
分子中 键数目之比为
键数目之比为_______ 。
③ 比
比 在水中的溶解度大,这是因为
在水中的溶解度大,这是因为_______ 。
(3) 催化剂可实现
催化剂可实现 高选择性加氢合成
高选择性加氢合成 ,其晶胞结构如图所示。
,其晶胞结构如图所示。
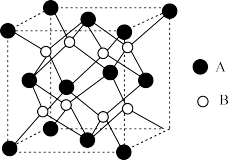
①B代表_______ (填“ ”或“
”或“ ”),理由是
”),理由是_______ 。
② 晶胞的棱长分别为
晶胞的棱长分别为 、
、 、
、 ,其晶体密度为
,其晶体密度为_______  (列算式)。已知:
(列算式)。已知: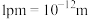 ,
, 为阿伏加德罗常数的值
为阿伏加德罗常数的值
 加氢合成
加氢合成 。
。(1)太阳能电池板的主要材料为单晶硅。
①单晶硅属于
②单晶硅的熔点低于金刚石的,原因是
(2)在催化剂作用下,
 与
与 反应得到
反应得到 。
。①
 分子的空间结构为
分子的空间结构为②
 和
和 分子中
分子中 键数目之比为
键数目之比为③
 比
比 在水中的溶解度大,这是因为
在水中的溶解度大,这是因为(3)
 催化剂可实现
催化剂可实现 高选择性加氢合成
高选择性加氢合成 ,其晶胞结构如图所示。
,其晶胞结构如图所示。
①B代表
 ”或“
”或“ ”),理由是
”),理由是②
 晶胞的棱长分别为
晶胞的棱长分别为 、
、 、
、 ,其晶体密度为
,其晶体密度为 (列算式)。已知:
(列算式)。已知: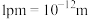 ,
, 为阿伏加德罗常数的值
为阿伏加德罗常数的值
您最近一年使用:0次