回答下列问题:
(1)氢气是一种清洁能源,氢气的制取。与储存是氢能源利用领域的研究热点。
已知:



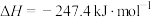


以甲烷为原料制取氢气是工业上常用的制氢方法。 (g)与
(g)与 (g)反应生成
(g)反应生成 (g)和
(g)和 (g)的热化学方程式为
(g)的热化学方程式为___________ 。
(2)用 催化还原
催化还原 可以消除氮氧化物的污染。例如:
可以消除氮氧化物的污染。例如:
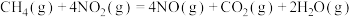
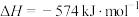
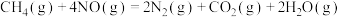

若用标准状况下4.48L 还原
还原 至
至 整个过程中转移的电子总数为
整个过程中转移的电子总数为___________ (阿伏加德罗常数的值用 表示),放出的热量为
表示),放出的热量为___________ 。
(3)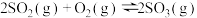 反应过程的能量变化如图所示。
反应过程的能量变化如图所示。
已知1mol (g)氧化为1mol
(g)氧化为1mol  的
的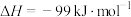 。请回答下列问题:
。请回答下列问题:
①图中ΔH=___________  。
。
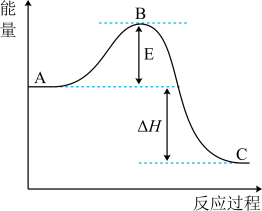
②将2mol 和1mol
和1mol  充入体积不变的密闭容器中,在一定条件下达平衡时,
充入体积不变的密闭容器中,在一定条件下达平衡时, 为0.6mol,如果此时移走1mol
为0.6mol,如果此时移走1mol  和0.5mol
和0.5mol  在相同温度下再达平衡时
在相同温度下再达平衡时 的物质的量
的物质的量___________ (填选项)。
A.0.3mol B.0.6mol C.小于0.3mol D.大于0.3mol小于0.6mol
(1)氢气是一种清洁能源,氢气的制取。与储存是氢能源利用领域的研究热点。
已知:



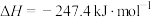


以甲烷为原料制取氢气是工业上常用的制氢方法。
 (g)与
(g)与 (g)反应生成
(g)反应生成 (g)和
(g)和 (g)的热化学方程式为
(g)的热化学方程式为(2)用
 催化还原
催化还原 可以消除氮氧化物的污染。例如:
可以消除氮氧化物的污染。例如: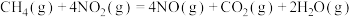
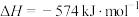
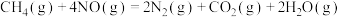

若用标准状况下4.48L
 还原
还原 至
至 整个过程中转移的电子总数为
整个过程中转移的电子总数为 表示),放出的热量为
表示),放出的热量为(3)
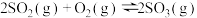 反应过程的能量变化如图所示。
反应过程的能量变化如图所示。
已知1mol
 (g)氧化为1mol
(g)氧化为1mol  的
的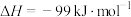 。请回答下列问题:
。请回答下列问题:①图中ΔH=
 。
。②将2mol
 和1mol
和1mol  充入体积不变的密闭容器中,在一定条件下达平衡时,
充入体积不变的密闭容器中,在一定条件下达平衡时, 为0.6mol,如果此时移走1mol
为0.6mol,如果此时移走1mol  和0.5mol
和0.5mol  在相同温度下再达平衡时
在相同温度下再达平衡时 的物质的量
的物质的量A.0.3mol B.0.6mol C.小于0.3mol D.大于0.3mol小于0.6mol
更新时间:2023-10-24 08:50:24
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
①CO(g)+2H2(g) CH3OH(g) ΔH1<0 K1
CH3OH(g) ΔH1<0 K1
②2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH2<0 K2
CH3OCH3(g)+H2O(g) ΔH2<0 K2
③CO(g)+H2O(g) CO2(g)+H2(g) ΔH3<0 K3
CO2(g)+H2(g) ΔH3<0 K3
(1)则反应3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的ΔH=
CH3OCH3(g)+CO2(g)的ΔH=___________ (用含ΔH1、ΔH2、ΔH3的代数式表示),K=___________ (用含K1、K2、K3的代数式表示)。
(2)反应②达平衡后采取下列措施,能提高CH3OCH3产率的有___________ (填字母,下同)。
A.加入CH3OH B.升高温度 C.增大压强 D.移出H2O E.使用催化剂
(3)以下说法能说明反应3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)达到平衡状态的
CH3OCH3(g)+CO2(g)达到平衡状态的___________ 。
A.H2和CO2的浓度之比为3∶1
B.单位时间内断裂3个H—H同时断裂1个C=O
C.恒温恒容条件下,气体的密度保持不变
D.恒温恒压条件下,气体的平均摩尔质量保持不变
E.绝热体系中,体系的温度保持不变
(4)200 ℃时,向恒容密闭容器中充入一定量的CH3OH(g)发生反应:
2CH3OH(g) CH3OCH3(g)+H2O(g),测得CH3OH(g)的浓度随时间(t)的变化如下表:
CH3OCH3(g)+H2O(g),测得CH3OH(g)的浓度随时间(t)的变化如下表:
①10~30 min内,用CH3OCH3(g)表示该反应的平均速率为___________ 。
②反应达平衡时,容器内的压强为P0.该反应在200 ℃时的平衡常数Kp=___________ (以分压表示,分压=总压×物质的量分数)。
③200℃时,向该容器中投入三种成分的浓度如下:
该时刻,正、逆反应速率的大小关系为:v正(CH3OH)___________ v逆(CH3OH)(填“>”“<”或“=”)。
①CO(g)+2H2(g)
 CH3OH(g) ΔH1<0 K1
CH3OH(g) ΔH1<0 K1②2CH3OH(g)
 CH3OCH3(g)+H2O(g) ΔH2<0 K2
CH3OCH3(g)+H2O(g) ΔH2<0 K2③CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH3<0 K3
CO2(g)+H2(g) ΔH3<0 K3(1)则反应3H2(g)+3CO(g)
 CH3OCH3(g)+CO2(g)的ΔH=
CH3OCH3(g)+CO2(g)的ΔH=(2)反应②达平衡后采取下列措施,能提高CH3OCH3产率的有
A.加入CH3OH B.升高温度 C.增大压强 D.移出H2O E.使用催化剂
(3)以下说法能说明反应3H2(g)+3CO(g)
 CH3OCH3(g)+CO2(g)达到平衡状态的
CH3OCH3(g)+CO2(g)达到平衡状态的A.H2和CO2的浓度之比为3∶1
B.单位时间内断裂3个H—H同时断裂1个C=O
C.恒温恒容条件下,气体的密度保持不变
D.恒温恒压条件下,气体的平均摩尔质量保持不变
E.绝热体系中,体系的温度保持不变
(4)200 ℃时,向恒容密闭容器中充入一定量的CH3OH(g)发生反应:
2CH3OH(g)
 CH3OCH3(g)+H2O(g),测得CH3OH(g)的浓度随时间(t)的变化如下表:
CH3OCH3(g)+H2O(g),测得CH3OH(g)的浓度随时间(t)的变化如下表:| t/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| c(CH3OH)/(mol·L-1) | 1.00 | 0.65 | 0.50 | 0.36 | 0.27 | 0.20 | 0.20 |
②反应达平衡时,容器内的压强为P0.该反应在200 ℃时的平衡常数Kp=
③200℃时,向该容器中投入三种成分的浓度如下:
| 物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
| c/(mol·L-1) | 0.54 | 0.68 | 0.68 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】甲醇是重要的含碳燃料。
(1)以CO和H为原料合成甲醇是工业上的成熟方法,直接以CO2为原料生产甲醇是目前的研究热点。我国科学家用CO2人工合成淀粉时,第一步就需要将CO2转化为甲醇。已知:
①CO(g)+2H2(g)=CH3OH(g) ΔH1=-90.5kJ/mol
②CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2=-41.1kJ/mol
CO2与H2合成甲醇的热化学方程式为___________ 。
(2)工业上可采用CH3OH CO+2H2的方法来制取高纯度的CO和H2。我国研究人员采用量子力学方法,通过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在铝催化剂表面上的物种用*标注。下图为计算机模拟的各步反应的能量变化示意图:
CO+2H2的方法来制取高纯度的CO和H2。我国研究人员采用量子力学方法,通过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在铝催化剂表面上的物种用*标注。下图为计算机模拟的各步反应的能量变化示意图:

该历程中最大能垒(活化能)E正=___________ kJ/mol,该历程中,放热最多的步骤的化学方程式为___________ 。
(3)用甲醇(CH3OH)燃料电池(装置甲)作为电源,以Ni、Fe作电极,电解浓KOH溶液制备K2FeO4(装置乙),示意图如下:

①装置甲中,b是___________ (填“甲醇”或“氧气”),负极的电极反应式为___________ 。
②装置乙中,Ni电极作___________ 极(填“阴”或“阳”),Fe电极上电极反应式为___________ 。
(1)以CO和H为原料合成甲醇是工业上的成熟方法,直接以CO2为原料生产甲醇是目前的研究热点。我国科学家用CO2人工合成淀粉时,第一步就需要将CO2转化为甲醇。已知:
①CO(g)+2H2(g)=CH3OH(g) ΔH1=-90.5kJ/mol
②CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2=-41.1kJ/mol
CO2与H2合成甲醇的热化学方程式为
(2)工业上可采用CH3OH
 CO+2H2的方法来制取高纯度的CO和H2。我国研究人员采用量子力学方法,通过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在铝催化剂表面上的物种用*标注。下图为计算机模拟的各步反应的能量变化示意图:
CO+2H2的方法来制取高纯度的CO和H2。我国研究人员采用量子力学方法,通过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在铝催化剂表面上的物种用*标注。下图为计算机模拟的各步反应的能量变化示意图:
该历程中最大能垒(活化能)E正=
(3)用甲醇(CH3OH)燃料电池(装置甲)作为电源,以Ni、Fe作电极,电解浓KOH溶液制备K2FeO4(装置乙),示意图如下:

①装置甲中,b是
②装置乙中,Ni电极作
您最近一年使用:0次
【推荐3】“绿水青山就是金山银山”,研究并消除氮氧化物污染对建设美丽家乡,打造宜居环境有重要意义。
(1)已知:2NO(g)+O2(g)=2NO2(g) ΔH1=-114kJ∙mol-1
C(s)+O2(g)=CO2(g) ΔH2=-393.5kJ∙mol-1
N2(g)+O2(g)=2NO(g) ΔH3=+181kJ∙mol-1
若某反应的平衡常数表达式为K=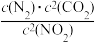 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式___ 。
(2)T℃时,存在如下平衡:2NO2(g) N2O4(g)。该反应正逆反应速率与NO2、N2O4的浓度关系为:v正=k正c2(NO2),v逆=k逆c(N2O4)(k正、k逆是速率常数),且lgv正~lgc(NO2)与lgv逆~lgc(N2O4)的关系如图所示。
N2O4(g)。该反应正逆反应速率与NO2、N2O4的浓度关系为:v正=k正c2(NO2),v逆=k逆c(N2O4)(k正、k逆是速率常数),且lgv正~lgc(NO2)与lgv逆~lgc(N2O4)的关系如图所示。
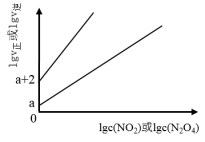
①T℃时,该反应的平衡常数K=___ 。
②T℃时,往刚性容器中充入一定量NO2,平衡后测得c(N2O4)为1.0mol/L,则平衡时NO2的物质的量分数为___ (以分数表示)。平衡后v正=__ (用含a的表达式表示)。
(3)用活性炭还原法处理氮氧化物的有关反应为:C(s)+2NO(g) N2(g)+CO2(g)。向一恒压密闭容器中加入一定量(足量)的活性炭和NO,在t2时刻改变某一条件,其反应过程如图所示。
N2(g)+CO2(g)。向一恒压密闭容器中加入一定量(足量)的活性炭和NO,在t2时刻改变某一条件,其反应过程如图所示。

①则t2时刻改变的条件为__ 。
②t1时刻的v逆__ t2时刻的v正(填“>”“<”或“=”)。
(4)在恒容密闭容器中发生反应2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) △H<0。下列说法正确的是
CO(NH2)2(s)+H2O(g) △H<0。下列说法正确的是___ 。
A.及时分离出生成的尿素,有利于NH3的转化率增大
B.反应达到平衡后,混合气体的密度不再发生改变
C.反应在任何温度下都能自发进行
D.当尿素的质量不变时,说明反应达到平衡
(1)已知:2NO(g)+O2(g)=2NO2(g) ΔH1=-114kJ∙mol-1
C(s)+O2(g)=CO2(g) ΔH2=-393.5kJ∙mol-1
N2(g)+O2(g)=2NO(g) ΔH3=+181kJ∙mol-1
若某反应的平衡常数表达式为K=
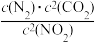 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式(2)T℃时,存在如下平衡:2NO2(g)
 N2O4(g)。该反应正逆反应速率与NO2、N2O4的浓度关系为:v正=k正c2(NO2),v逆=k逆c(N2O4)(k正、k逆是速率常数),且lgv正~lgc(NO2)与lgv逆~lgc(N2O4)的关系如图所示。
N2O4(g)。该反应正逆反应速率与NO2、N2O4的浓度关系为:v正=k正c2(NO2),v逆=k逆c(N2O4)(k正、k逆是速率常数),且lgv正~lgc(NO2)与lgv逆~lgc(N2O4)的关系如图所示。
①T℃时,该反应的平衡常数K=
②T℃时,往刚性容器中充入一定量NO2,平衡后测得c(N2O4)为1.0mol/L,则平衡时NO2的物质的量分数为
(3)用活性炭还原法处理氮氧化物的有关反应为:C(s)+2NO(g)
 N2(g)+CO2(g)。向一恒压密闭容器中加入一定量(足量)的活性炭和NO,在t2时刻改变某一条件,其反应过程如图所示。
N2(g)+CO2(g)。向一恒压密闭容器中加入一定量(足量)的活性炭和NO,在t2时刻改变某一条件,其反应过程如图所示。
①则t2时刻改变的条件为
②t1时刻的v逆
(4)在恒容密闭容器中发生反应2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g) △H<0。下列说法正确的是
CO(NH2)2(s)+H2O(g) △H<0。下列说法正确的是A.及时分离出生成的尿素,有利于NH3的转化率增大
B.反应达到平衡后,混合气体的密度不再发生改变
C.反应在任何温度下都能自发进行
D.当尿素的质量不变时,说明反应达到平衡
您最近一年使用:0次
【推荐1】氨气是基础有机合成工业和化肥工业的重要原料。
(1)诺贝尔奖获得者埃特尔提出了合成氨反应吸附解离的机理,通过实验测得合成氨势能如图所示:
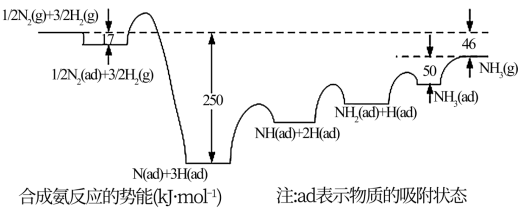
在合成氨吸附解离的过程中,下列状态最稳定的是___________ (填选项)。
A.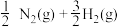 B.NH3(g) C.NH(ad)+2H(ad) D.N(ad)+3H(ad)
B.NH3(g) C.NH(ad)+2H(ad) D.N(ad)+3H(ad)
其中,NH3(ad) NH3(g) ∆H=
NH3(g) ∆H= ___________ kJ·mol-1,若要使该平衡正向移动,可采取的措施是___________ (填选项)。
A.升高温度 B.降低温度 C.增大压强 D.减小压强
(2)在上述实验条件下,向一密闭容器中通入 1molN2和 3molH2充分反应,达到平衡时放出 46kJ 热量,计算该条件下 H2的转化率___________ 。
(3)在 t ℃、压强为 3.6 MPa 条件下,向一恒压密闭容器中通入氢氮比[c(H2):c(N2)] 为 3 的混合气体,体系中气体的含量与时间变化关系如图所示:
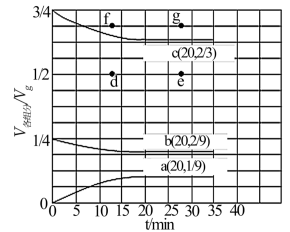
反应 20 min 达到平衡,试求 0~20 min 内氨气的平均反应速率 v(NH3)=___________ MPa·min-1。若起始条件一样,在恒容容器中发生反应,则达到平衡时 H2的含量符合上图中 ___________ 点(填“d”、“e”、“f”或“g”)。
(4)在合成氨工艺中,未反应的气体(含不参与反应的惰性气体)可多次循环使用。当氢氮比[c(H2):c(N2)]为 3 时,平衡时氨气的含量关系式为:ω (NH3)=0.325·KP·P·(1-i ) 2,(KP:平衡常数;P:平衡体系压强;i:惰性气体体积分数)。当温度为 500℃,不含惰性气体时,平衡体系压强为 2.4MPa,氨气的含量为 ω ,若此时增大压强,Kp___________ 将(填“变大”、“变小”或“不变”)。若温度不变,体系中有 20%的惰性气体,欲使平衡时氨气的含量仍为 ω ,应将压强调整至___________ MPa。
(1)诺贝尔奖获得者埃特尔提出了合成氨反应吸附解离的机理,通过实验测得合成氨势能如图所示:

在合成氨吸附解离的过程中,下列状态最稳定的是
A.
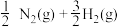 B.NH3(g) C.NH(ad)+2H(ad) D.N(ad)+3H(ad)
B.NH3(g) C.NH(ad)+2H(ad) D.N(ad)+3H(ad)其中,NH3(ad)
 NH3(g) ∆H=
NH3(g) ∆H= A.升高温度 B.降低温度 C.增大压强 D.减小压强
(2)在上述实验条件下,向一密闭容器中通入 1molN2和 3molH2充分反应,达到平衡时放出 46kJ 热量,计算该条件下 H2的转化率
(3)在 t ℃、压强为 3.6 MPa 条件下,向一恒压密闭容器中通入氢氮比[c(H2):c(N2)] 为 3 的混合气体,体系中气体的含量与时间变化关系如图所示:

反应 20 min 达到平衡,试求 0~20 min 内氨气的平均反应速率 v(NH3)=
(4)在合成氨工艺中,未反应的气体(含不参与反应的惰性气体)可多次循环使用。当氢氮比[c(H2):c(N2)]为 3 时,平衡时氨气的含量关系式为:ω (NH3)=0.325·KP·P·(1-i ) 2,(KP:平衡常数;P:平衡体系压强;i:惰性气体体积分数)。当温度为 500℃,不含惰性气体时,平衡体系压强为 2.4MPa,氨气的含量为 ω ,若此时增大压强,Kp
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率。请回答下列问题。
(1)工业合成氨反应:N2(g)+3H2(g) 2NH3(g)是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知1molN2(g)完全反应生成NH3(g)可放出92kJ热量。如果将10molN2(g)和足量H2(g)混合,使其充分反应,放出的热量
2NH3(g)是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知1molN2(g)完全反应生成NH3(g)可放出92kJ热量。如果将10molN2(g)和足量H2(g)混合,使其充分反应,放出的热量_____ (填“大于”“小于”或“等于”)920kJ。
(2)实验室模拟工业合成氨时,在容积为2L的密闭容器内,反应经过10min后,生成10molNH3,用N2表示的化学反应速率为_____ 。
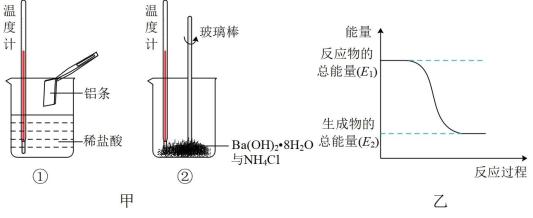
(3)某实验小组同学进行如图甲所示实验,以检验化学反应中的能量变化。请根据你掌握的反应原理判断,②中的温度______ (填“升高”或“降低”)。反应过程_____ (填“①”或“②”)的能量变化可用图乙表示。
(4)如图为原电池装置示意图。A为Cu,B为石墨,电解质为FeCl3溶液,工作时的总反应为2FeCl3+Cu=2FeCl2+CuCl2。
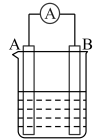
①写出A的电极名称______ 。
②B电极反应式:______ 。
③该电池在工作时,溶液中Fe3+向______ (填“A”、“B”)移动,A电极的质量将______ (填“增加”、“减小”或“不变”)。
(1)工业合成氨反应:N2(g)+3H2(g)
 2NH3(g)是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知1molN2(g)完全反应生成NH3(g)可放出92kJ热量。如果将10molN2(g)和足量H2(g)混合,使其充分反应,放出的热量
2NH3(g)是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知1molN2(g)完全反应生成NH3(g)可放出92kJ热量。如果将10molN2(g)和足量H2(g)混合,使其充分反应,放出的热量(2)实验室模拟工业合成氨时,在容积为2L的密闭容器内,反应经过10min后,生成10molNH3,用N2表示的化学反应速率为
(3)某实验小组同学进行如图甲所示实验,以检验化学反应中的能量变化。请根据你掌握的反应原理判断,②中的温度

(4)如图为原电池装置示意图。A为Cu,B为石墨,电解质为FeCl3溶液,工作时的总反应为2FeCl3+Cu=2FeCl2+CuCl2。

①写出A的电极名称
②B电极反应式:
③该电池在工作时,溶液中Fe3+向
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】I.(1)实验测得 8 g 液态甲醇(化学式为 CH4O)在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出 181.6 kJ 的热量。请写出表示液态甲醇燃烧热的热化学方程式:_______ 。
(2)发射卫星时常用肼(N2H4)作为燃料,用二氧化氮作为氧化剂,这两种物质反应生成氮气和水蒸气。 已知:①N2(g)+2O2(g)=2NO2(g) ΔH= a kJ/mol;②N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH= b kJ/mol。写出肼气体与二氧化氮气体反应的热化学方程式:_______ 。
II.某学习小组的同学在实验室利用下图装置进行中和热的测定,请回答下列问题:

(1)在其它操作正确的前提下,如果大烧杯不盖硬纸板,求得的中和热 ΔH 将_______ (填“偏大”、“偏小” 或“无影响”)。
(2)取 50 mL 0.50 mol/L NaOH 溶液和 30 mL 0.50 mol/L 硫酸溶液进行实验,实验数据如下表。
①表中的温度差的平均值为_____ ℃。
②近似认为 0.50 mol/L NaOH溶液和 0.50 mol/L硫酸溶液的密度都是 1 g·cm-3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热 ΔH=_____ kJ/mol (保留到小数点后一位)。
③实验中改用 60 mL 0.50 mol/L 盐酸跟 50 mL 0.55 mol/L 氢氧化钠进行反应,若其它实验操作均正确,则与上述实验相比,所放出的热量_____ (填“相等”或“不相等”,下同),所求得的中和热_____ 。
(2)发射卫星时常用肼(N2H4)作为燃料,用二氧化氮作为氧化剂,这两种物质反应生成氮气和水蒸气。 已知:①N2(g)+2O2(g)=2NO2(g) ΔH= a kJ/mol;②N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH= b kJ/mol。写出肼气体与二氧化氮气体反应的热化学方程式:
II.某学习小组的同学在实验室利用下图装置进行中和热的测定,请回答下列问题:

(1)在其它操作正确的前提下,如果大烧杯不盖硬纸板,求得的中和热 ΔH 将
(2)取 50 mL 0.50 mol/L NaOH 溶液和 30 mL 0.50 mol/L 硫酸溶液进行实验,实验数据如下表。
实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.5 | 26.7 | 26.6 | 30.1 | |
2 | 26.0 | 26.4 | 26.2 | 30.3 | |
3 | 25.9 | 25.9 | 25.9 | 30.2 | |
4 | 26.4 | 26.2 | 26.3 | 30.5 | |
②近似认为 0.50 mol/L NaOH溶液和 0.50 mol/L硫酸溶液的密度都是 1 g·cm-3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热 ΔH=
③实验中改用 60 mL 0.50 mol/L 盐酸跟 50 mL 0.55 mol/L 氢氧化钠进行反应,若其它实验操作均正确,则与上述实验相比,所放出的热量
您最近一年使用:0次



