工业上用黄铜矿(主要成分是 ,还含有少量
,还含有少量 )制备CuCl的工艺流程如图:
)制备CuCl的工艺流程如图:
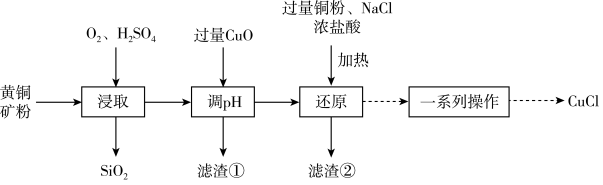
(1)已知在水溶液中存在平衡: (无色)。“还原”的离子方程式为
(无色)。“还原”的离子方程式为_____ 。
(2)关于该工艺流程,下列说法正确的是_____。
(3)CuCl是一种难溶于水和乙醇的白色固体,但其易溶于氨水的原因是_____ 。
(4)滤渣①的主要成分是_____ (填写化学式)。设计实验验证滤渣①中的阳离子_____ 。
 ,还含有少量
,还含有少量 )制备CuCl的工艺流程如图:
)制备CuCl的工艺流程如图:
(1)已知在水溶液中存在平衡:
 (无色)。“还原”的离子方程式为
(无色)。“还原”的离子方程式为(2)关于该工艺流程,下列说法正确的是_____。
A.“浸取”时离子方程式为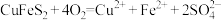 |
| B.“一系列操作”是加入大量的水、过滤、用无水乙醇洗涤、真空干燥 |
| C.“滤渣②”主要成分是CuCl |
| D.“还原”时当溶液变为无色时,表明“还原”进行完全 |
(3)CuCl是一种难溶于水和乙醇的白色固体,但其易溶于氨水的原因是
(4)滤渣①的主要成分是
23-24高三上·浙江金华·阶段练习 查看更多[2]
更新时间:2023-10-23 19:09:29
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】研究含氮元素物质的反应对生产、生活、科研等方面具有重要的意义.回答下列问题:
(1)已知: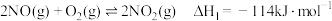 ;
;
 ;
;
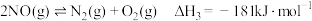 .
.
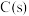 与
与 反应生成
反应生成 和
和 的热化学方程式为
的热化学方程式为___________ 。
(2) 的排放主要来自于汽车尾气,包含
的排放主要来自于汽车尾气,包含 和
和 ,有人提出用活性炭对
,有人提出用活性炭对 进行吸收.对于反应:
进行吸收.对于反应: 时,借助传感器测得反应在不同时间点上各物质的浓度如下:
时,借助传感器测得反应在不同时间点上各物质的浓度如下:
① 内,
内, 的平均反应速率
的平均反应速率
___________ ,当升高反应温度,该反应的平衡常数K___________ (选填“增大”“减小”或“不变”)。
② 后,只改变某一条件,反应重新达到平衡;根据上表中的数据判断改变的条件可能是
后,只改变某一条件,反应重新达到平衡;根据上表中的数据判断改变的条件可能是___________ (填字母)。
A.加入一定量的活性炭B.通入一定量的 C.适当缩小容器的体积D.加入合适的催化剂
C.适当缩小容器的体积D.加入合适的催化剂
(3)为避免汽车尾气中的氮氧化合物对大气的污染,需给汽车安装尾气净化装置.在净化装置中 和
和 发生反应
发生反应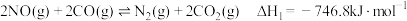 .实验测得:
.实验测得: ,其中
,其中 分别为正、逆反应速率常数,只与温度有关;p为气体分压(分压=物质的量分数×总压).
分别为正、逆反应速率常数,只与温度有关;p为气体分压(分压=物质的量分数×总压).
①达到平衡后,仅升高温度, 增大的倍数
增大的倍数___________ (选填“大于”、“小于”或“等于”) 增大的倍数。
增大的倍数。
②一定温度下在刚性密闭容器中充入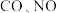 和
和 物质的量之比为
物质的量之比为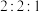 ,压强为
,压强为 .达平衡时压强为
.达平衡时压强为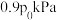 ,此时
,此时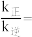
___________  。
。
(4)某研究小组在实验室以耐高温催化剂催化 转化为
转化为 ,测得
,测得 转化为
转化为 的转化率随温度变化情况如图所示.结合(1)中的反应,用平衡移动原理解释加入
的转化率随温度变化情况如图所示.结合(1)中的反应,用平衡移动原理解释加入 后,
后, 转化为
转化为 的转化率增大的原因:
的转化率增大的原因:____________________________ 。
(1)已知:
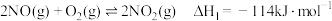 ;
; ;
;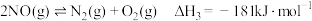 .
.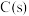 与
与 反应生成
反应生成 和
和 的热化学方程式为
的热化学方程式为(2)
 的排放主要来自于汽车尾气,包含
的排放主要来自于汽车尾气,包含 和
和 ,有人提出用活性炭对
,有人提出用活性炭对 进行吸收.对于反应:
进行吸收.对于反应: 时,借助传感器测得反应在不同时间点上各物质的浓度如下:
时,借助传感器测得反应在不同时间点上各物质的浓度如下:
| 0 | 10 | 20 | 30 | 40 | 50 |
| 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
 内,
内, 的平均反应速率
的平均反应速率
②
 后,只改变某一条件,反应重新达到平衡;根据上表中的数据判断改变的条件可能是
后,只改变某一条件,反应重新达到平衡;根据上表中的数据判断改变的条件可能是A.加入一定量的活性炭B.通入一定量的
 C.适当缩小容器的体积D.加入合适的催化剂
C.适当缩小容器的体积D.加入合适的催化剂(3)为避免汽车尾气中的氮氧化合物对大气的污染,需给汽车安装尾气净化装置.在净化装置中
 和
和 发生反应
发生反应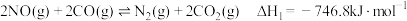 .实验测得:
.实验测得: ,其中
,其中 分别为正、逆反应速率常数,只与温度有关;p为气体分压(分压=物质的量分数×总压).
分别为正、逆反应速率常数,只与温度有关;p为气体分压(分压=物质的量分数×总压).①达到平衡后,仅升高温度,
 增大的倍数
增大的倍数 增大的倍数。
增大的倍数。②一定温度下在刚性密闭容器中充入
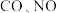 和
和 物质的量之比为
物质的量之比为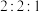 ,压强为
,压强为 .达平衡时压强为
.达平衡时压强为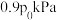 ,此时
,此时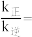
 。
。(4)某研究小组在实验室以耐高温催化剂催化
 转化为
转化为 ,测得
,测得 转化为
转化为 的转化率随温度变化情况如图所示.结合(1)中的反应,用平衡移动原理解释加入
的转化率随温度变化情况如图所示.结合(1)中的反应,用平衡移动原理解释加入 后,
后, 转化为
转化为 的转化率增大的原因:
的转化率增大的原因: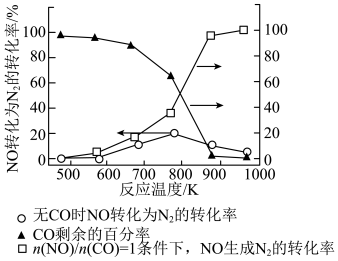
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】(Ⅰ)将一定量的A、B加入一恒容密闭容器中发生反应A(g)+B(g 2C (?),忽略固体体积,平衡时A的转化率(%)随温度和压强的变化如下表所示,回答下列问题:
2C (?),忽略固体体积,平衡时A的转化率(%)随温度和压强的变化如下表所示,回答下列问题:
(1)a<d,则C的状态为___________ 态(填g或s),该反应的反应热△H___________ 0(填“<”或“>”),该温度下反应___________ 自发进行(填“能”或“否”)。
(2)能判断该反应已经达到化学平衡的是___________
(3)若c=f,1000℃时,将1mol A、1mol B充入1L的恒容容器中,10分钟达平衡
①从开始到恰好平衡时,B的反应速率为___________ ,反应的平衡常数为___________ 。
②平衡后,固定容器的容积不变,将A、B各增加1mol,新平衡后,A的转化率___________ (填增大、减小或不变),若A、B分别再增加1mol、2mol,第三次新平衡后,A的转化率___________
(Ⅱ)用高铁(Ⅵ)酸盐设计的高铁(Ⅵ)电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应为3Zn+2K2FeO4+8H2O=3Zn(OH)2+2Fe(OH)3+4KOH。
(4)则充电时,阴极的电极反应式为___________ ;用高铁(Ⅵ)电池作电源,以Fe作阳极,以Cu作阴极,对足量NaCl溶液进行电解,当电池中有0.2mol K2FeO4反应时,则在电解池中生成H2___________ L(标准状况)。
 2C (?),忽略固体体积,平衡时A的转化率(%)随温度和压强的变化如下表所示,回答下列问题:
2C (?),忽略固体体积,平衡时A的转化率(%)随温度和压强的变化如下表所示,回答下列问题:温度/℃ 转化率/% 压强/MPa | 810 | 915 | 1 000 |
| 1.0 | 20 | 30 | 60 |
| 2.0 | a | b | c |
| 3.0 | d | e | f |
(1)a<d,则C的状态为
(2)能判断该反应已经达到化学平衡的是___________
| A.2v(A)=v(C) | B.密闭容器的压强不变 |
| C.密闭容器中混合气体的密度不变 | D.密闭容器中B的体积分数不变 |
①从开始到恰好平衡时,B的反应速率为
②平衡后,固定容器的容积不变,将A、B各增加1mol,新平衡后,A的转化率
(Ⅱ)用高铁(Ⅵ)酸盐设计的高铁(Ⅵ)电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应为3Zn+2K2FeO4+8H2O=3Zn(OH)2+2Fe(OH)3+4KOH。
(4)则充电时,阴极的电极反应式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】氯化亚铜是一种重要的化工产品,常用作有机合成催化剂,还可用于颜料,防腐等工业。查阅资料得知:CuCl是一种白色固体,微溶于水,不溶于酒精,能溶于浓盐酸,其熔融物导电性很差。
(1)CuCl为__________ (填“共价化合物”或“离子化合物”)。
(2)在CuCl2溶液中逐滴加入过量 KI溶液可能发生:
a.2Cu2++4I-=2CuI↓(白色)+I2
b.2Cu2++2Cl-+2I-=2CuCl↓(白色)+I2
若a反应为主要反应,则Ksp(CuI)________ Ksp(CuCl)(填“>”、“<”或“=”=)
(3)实验室可用氯化铜溶液、铜粉、浓盐酸反应制备氯化亚铜,其反应原理和流程为:
CuCl2+Cu+2HCl(浓) 2HCuCl2(无色)
2HCuCl2(无色) 2CuCl↓(白色)+2HCl
2CuCl↓(白色)+2HCl

①上述反应流程中,加入氯化钠的目的是________________________ 。
②常温下,CuOH的Ksp为1.0×10-14,则Cu++H2O CuOH+H+的平衡常数为:
CuOH+H+的平衡常数为:________
③为得到纯净的CuCl晶体,最好选用__________ (填编号)试剂进行洗涤。
a.蒸馏水 b.稀硫酸 c.氯化铜溶液 d.乙醇
④CuCl在潮湿的环境中易被氧化为Cu2(OH)3Cl,反应的化学方程式为__________ 。实验时,若用2mL0.5mol/L的CuCl2 溶液,最终可得到产品0.16g,则实验的产率为__________ 。
(1)CuCl为
(2)在CuCl2溶液中逐滴加入过量 KI溶液可能发生:
a.2Cu2++4I-=2CuI↓(白色)+I2
b.2Cu2++2Cl-+2I-=2CuCl↓(白色)+I2
若a反应为主要反应,则Ksp(CuI)
(3)实验室可用氯化铜溶液、铜粉、浓盐酸反应制备氯化亚铜,其反应原理和流程为:
CuCl2+Cu+2HCl(浓)
 2HCuCl2(无色)
2HCuCl2(无色) 2CuCl↓(白色)+2HCl
2CuCl↓(白色)+2HCl
①上述反应流程中,加入氯化钠的目的是
②常温下,CuOH的Ksp为1.0×10-14,则Cu++H2O
 CuOH+H+的平衡常数为:
CuOH+H+的平衡常数为:③为得到纯净的CuCl晶体,最好选用
a.蒸馏水 b.稀硫酸 c.氯化铜溶液 d.乙醇
④CuCl在潮湿的环境中易被氧化为Cu2(OH)3Cl,反应的化学方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】I.已知水在25℃和95℃时,其电离平衡曲线如图所示。
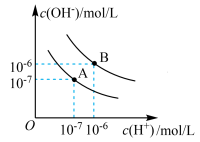
(1)曲线A所对应的温度下,pH=2的HCl溶液和pH=12的某BOH溶液中,若水的电离程度分别用α1、α2表示,则α1___________ α2(填“大于”、“小于”、“等于”或“无法确定”,下同),若将二者等体积混合,则混合溶液的pH___________ 7。
(2)在曲线B所对应的温度下,将0.02mol·L-1的Ba(OH)2溶液与等物质的量浓度的H2SO4溶液等体积混合,所得混合液的pH=___________ 。
II.某科研小组采用如下方案回收一种光盘金属层中的少量Ag(金属层中其他金属含量过低,对实验的影响可忽略)。
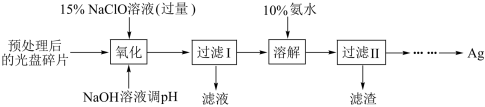
已知:① 溶液在受热或酸性条件下易分解,如:
溶液在受热或酸性条件下易分解,如: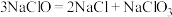
② 可溶于氨水生成
可溶于氨水生成
③常温时 (水合肼)在碱性条件下能还原
(水合肼)在碱性条件下能还原 :
: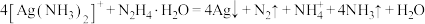 。
。
(3)“氧化”阶段需在80℃条件下进行,适宜的加热方式为___________ 。
(4) 溶液与Ag反应的产物为
溶液与Ag反应的产物为 、
、 和
和 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。 也能氧化Ag,从反应产物的角度分析,以
也能氧化Ag,从反应产物的角度分析,以 代替
代替 的缺点是
的缺点是___________ 。
(5)为提高Ag的回收率,需对“过滤II”的滤渣进行洗涤,并___________ 。
(6)“溶解”阶段发生反应的离子方程式为___________ 。

(1)曲线A所对应的温度下,pH=2的HCl溶液和pH=12的某BOH溶液中,若水的电离程度分别用α1、α2表示,则α1
(2)在曲线B所对应的温度下,将0.02mol·L-1的Ba(OH)2溶液与等物质的量浓度的H2SO4溶液等体积混合,所得混合液的pH=
II.某科研小组采用如下方案回收一种光盘金属层中的少量Ag(金属层中其他金属含量过低,对实验的影响可忽略)。

已知:①
 溶液在受热或酸性条件下易分解,如:
溶液在受热或酸性条件下易分解,如: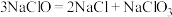
②
 可溶于氨水生成
可溶于氨水生成
③常温时
 (水合肼)在碱性条件下能还原
(水合肼)在碱性条件下能还原 :
: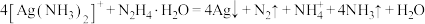 。
。(3)“氧化”阶段需在80℃条件下进行,适宜的加热方式为
(4)
 溶液与Ag反应的产物为
溶液与Ag反应的产物为 、
、 和
和 ,该反应的化学方程式为
,该反应的化学方程式为 也能氧化Ag,从反应产物的角度分析,以
也能氧化Ag,从反应产物的角度分析,以 代替
代替 的缺点是
的缺点是(5)为提高Ag的回收率,需对“过滤II”的滤渣进行洗涤,并
(6)“溶解”阶段发生反应的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】实验室用如图装置制备 (省略了夹持和加热装置)。实验步骤如下:在三口烧瓶中加入含
(省略了夹持和加热装置)。实验步骤如下:在三口烧瓶中加入含 3.0g的
3.0g的 溶液和一定量活性炭,边通氨气边缓慢滴加
溶液和一定量活性炭,边通氨气边缓慢滴加 溶液,控制温度55℃左右至反应完毕。反应结束后,冷却至室温,将三口烧瓶中混合物过滤得棕黑色不溶物,将棕黑色不溶物转移到一定量热水中,操作a得橙黄色溶液,冷却加浓氨水,过滤,用无水乙醇洗涤,干燥,称量得1.5g产品。回答下列问题。
溶液,控制温度55℃左右至反应完毕。反应结束后,冷却至室温,将三口烧瓶中混合物过滤得棕黑色不溶物,将棕黑色不溶物转移到一定量热水中,操作a得橙黄色溶液,冷却加浓氨水,过滤,用无水乙醇洗涤,干燥,称量得1.5g产品。回答下列问题。
(1)仪器A的名称为___________ ;控制温度的方法为__________ ;尾气吸收装置最合适的为__________ (从图中选择)。

(2)反应中活性炭的作用是___________ 。
a.脱色剂 b.氧化剂 c.还原剂 d.催化剂
(3)操作a的名称为___________ ;加浓氨水的目的为__________________ 。
(4)制备 总反应的化学方程式为
总反应的化学方程式为________________ ,计算本实验的产率_________ (保留3位有效数字)。
 (省略了夹持和加热装置)。实验步骤如下:在三口烧瓶中加入含
(省略了夹持和加热装置)。实验步骤如下:在三口烧瓶中加入含 3.0g的
3.0g的 溶液和一定量活性炭,边通氨气边缓慢滴加
溶液和一定量活性炭,边通氨气边缓慢滴加 溶液,控制温度55℃左右至反应完毕。反应结束后,冷却至室温,将三口烧瓶中混合物过滤得棕黑色不溶物,将棕黑色不溶物转移到一定量热水中,操作a得橙黄色溶液,冷却加浓氨水,过滤,用无水乙醇洗涤,干燥,称量得1.5g产品。回答下列问题。
溶液,控制温度55℃左右至反应完毕。反应结束后,冷却至室温,将三口烧瓶中混合物过滤得棕黑色不溶物,将棕黑色不溶物转移到一定量热水中,操作a得橙黄色溶液,冷却加浓氨水,过滤,用无水乙醇洗涤,干燥,称量得1.5g产品。回答下列问题。
物质 | 颜色 | 溶解性 | 相对分子质量 |
| 粉红 | 溶于水、盐酸、氨水等 | 238 |
| 橙黄 | 溶于热水、盐酸,难溶于乙醇、氨水 | 267.5 |

(2)反应中活性炭的作用是
a.脱色剂 b.氧化剂 c.还原剂 d.催化剂
(3)操作a的名称为
(4)制备
 总反应的化学方程式为
总反应的化学方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】氯化亚铜难溶于水,能溶于氨水生成络合物。在气体分析中用于一氧化碳和乙炔的测定。某化学兴趣小组设计实验制备并探究氯化亚铜与乙炔的反应(装置如下,部分夹持装置省略)。
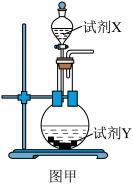
查阅资料:
① 与乙炔气体反应得到暗红色
与乙炔气体反应得到暗红色 沉淀。
沉淀。
② 也可与
也可与 发生反应。
发生反应。
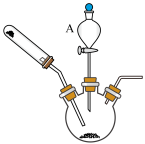
I.制备氯化亚铜:小组同学拟用二氧化硫和硫酸铜、氯化钠溶液反应制备氯化亚铜。
(1)图甲中盛放试剂X的仪器名称是___________ ,若试剂Y为亚硫酸钠,则试剂X为___________ 。
(2)检验二氧化硫气体的操作是___________ 。
Ⅱ.探究氯化亚铜与乙炔的反应:小组同学利用电石(主要成分 ,杂质为
,杂质为 )与
)与 反应制
反应制 ,并将提纯后的乙炔通入图乙装置,验证乙炔与氯化亚铜的反应。
,并将提纯后的乙炔通入图乙装置,验证乙炔与氯化亚铜的反应。
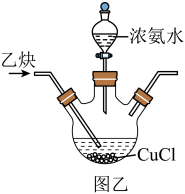
(3)小组同学将电石与水反应产生的气体通入溴水,溴水___________ (填现象),___________ (填“能”或“不能”)证明反应生成了乙炔,理由是___________ 。
(4)提纯乙炔的试剂通常选用___________ (填化学式)溶液。
(5)向三颈烧瓶中逐滴滴加氨水,白色固体逐渐溶解为 ,判断氨水过量的方法是
,判断氨水过量的方法是___________ 。停止滴加氨水,通入净化后的乙炔,烧瓶底部有暗红色沉淀析出,写出生成沉淀的离子方程式:___________ 。

查阅资料:
①
 与乙炔气体反应得到暗红色
与乙炔气体反应得到暗红色 沉淀。
沉淀。②
 也可与
也可与 发生反应。
发生反应。I.制备氯化亚铜:小组同学拟用二氧化硫和硫酸铜、氯化钠溶液反应制备氯化亚铜。
(1)图甲中盛放试剂X的仪器名称是
(2)检验二氧化硫气体的操作是
Ⅱ.探究氯化亚铜与乙炔的反应:小组同学利用电石(主要成分
 ,杂质为
,杂质为 )与
)与 反应制
反应制 ,并将提纯后的乙炔通入图乙装置,验证乙炔与氯化亚铜的反应。
,并将提纯后的乙炔通入图乙装置,验证乙炔与氯化亚铜的反应。
(3)小组同学将电石与水反应产生的气体通入溴水,溴水
(4)提纯乙炔的试剂通常选用
(5)向三颈烧瓶中逐滴滴加氨水,白色固体逐渐溶解为
 ,判断氨水过量的方法是
,判断氨水过量的方法是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】由铜精炼炉渣(含 、
、 和少量
和少量 等)获取
等)获取 ,并以
,并以 为原料制备超细铜粉。
为原料制备超细铜粉。

已知:① 是白色难溶于水的固体,溶于浓盐酸产生
是白色难溶于水的固体,溶于浓盐酸产生 ,溶于
,溶于 溶液:
溶液: 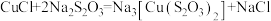
②
③常温下, 。
。
(1)预处理。
①“酸浸”时需通入空气的目的是___________ 。
②“调节 ”所得滤液
”所得滤液 的物质的量浓度为
的物质的量浓度为___________ 。
(2)制备 。将含
。将含 的溶液和一定质量的
的溶液和一定质量的 加入到三颈烧瓶中(装置见如图),通入
加入到三颈烧瓶中(装置见如图),通入 ,充分反应后,过滤,得
,充分反应后,过滤,得 和滤液。
和滤液。
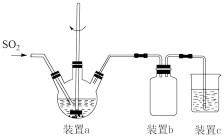
①装置b的作用是___________ 。
②装置a中发生反应的离子方程式为___________ 。
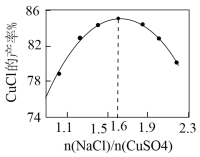
③ 产率随
产率随 的变化如图所示,当
的变化如图所示,当 大于1.6时,
大于1.6时, 的产率减小的原因是
的产率减小的原因是___________ 。
(3)制备超细铜粉。已知用水合肼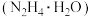 还原
还原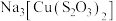 制备铜粉时,反应温度对铜粉产率的影响如图所示。请补充完整由
制备铜粉时,反应温度对铜粉产率的影响如图所示。请补充完整由 获取铜粉的实验方案:向
获取铜粉的实验方案:向 溶液中分批加入
溶液中分批加入 固体,边加边搅拌,
固体,边加边搅拌,___________ 。(实验中须使用的试剂: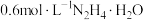 溶液,
溶液,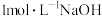 溶液,
溶液, 溶液)
溶液)

 、
、 和少量
和少量 等)获取
等)获取 ,并以
,并以 为原料制备超细铜粉。
为原料制备超细铜粉。
已知:①
 是白色难溶于水的固体,溶于浓盐酸产生
是白色难溶于水的固体,溶于浓盐酸产生 ,溶于
,溶于 溶液:
溶液: 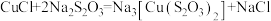
②

③常温下,
 。
。(1)预处理。
①“酸浸”时需通入空气的目的是
②“调节
 ”所得滤液
”所得滤液 的物质的量浓度为
的物质的量浓度为(2)制备
 。将含
。将含 的溶液和一定质量的
的溶液和一定质量的 加入到三颈烧瓶中(装置见如图),通入
加入到三颈烧瓶中(装置见如图),通入 ,充分反应后,过滤,得
,充分反应后,过滤,得 和滤液。
和滤液。
①装置b的作用是
②装置a中发生反应的离子方程式为
③
 产率随
产率随 的变化如图所示,当
的变化如图所示,当 大于1.6时,
大于1.6时, 的产率减小的原因是
的产率减小的原因是
(3)制备超细铜粉。已知用水合肼
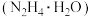 还原
还原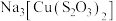 制备铜粉时,反应温度对铜粉产率的影响如图所示。请补充完整由
制备铜粉时,反应温度对铜粉产率的影响如图所示。请补充完整由 获取铜粉的实验方案:向
获取铜粉的实验方案:向 溶液中分批加入
溶液中分批加入 固体,边加边搅拌,
固体,边加边搅拌,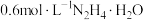 溶液,
溶液,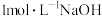 溶液,
溶液, 溶液)
溶液)
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】用湿法制磷酸副产品氟硅酸(H2SiF6 )生产无水氟化氢的工艺如下图所示:

已知:氟硅酸钾(K2SiF6)微酸性,有吸湿性,微溶于水,不溶于醇。在热水中水解成氟化钾、氟化氢及硅酸。
(1)写出反应器中的化学方程式:______________
(2)在实验室过滤操作中所用的玻璃仪器有:___________________________ ;
在洗涤氟硅酸钾(K2SiF6)时常用酒精洗涤,其目的是:____________________ ;
(3)该流程中哪些物质可以循环使用:_________________________ (用化学式表达)
(4)氟化氢可以腐蚀刻画玻璃,在刻蚀玻璃过程中也会生成H2SiF6 ,试写出该反应方程式:________ ;
(5)为了测定无水氟化氢的纯度,取标况下的气体产物2.24L,测得质量为3.1g,并将气体通入含足量的Ca(OH)2 溶液中,得到5.85gCaF2沉淀,则无水氢氟酸质量分数为:_______ 。(保留2位有效数字)通过计算结果,试解释,为什么标况下2.24L产物的质量远远大于2.0g,_______________ 。

已知:氟硅酸钾(K2SiF6)微酸性,有吸湿性,微溶于水,不溶于醇。在热水中水解成氟化钾、氟化氢及硅酸。
(1)写出反应器中的化学方程式:
(2)在实验室过滤操作中所用的玻璃仪器有:
在洗涤氟硅酸钾(K2SiF6)时常用酒精洗涤,其目的是:
(3)该流程中哪些物质可以循环使用:
(4)氟化氢可以腐蚀刻画玻璃,在刻蚀玻璃过程中也会生成H2SiF6 ,试写出该反应方程式:
(5)为了测定无水氟化氢的纯度,取标况下的气体产物2.24L,测得质量为3.1g,并将气体通入含足量的Ca(OH)2 溶液中,得到5.85gCaF2沉淀,则无水氢氟酸质量分数为:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】碲(Te)广泛用于彩色玻璃和陶瓷。工业上用精炼铜的阳极泥(主要含有TeO2、少量Ag、Au)为原料制备单质碲的一种工艺流程如下:
(1)“碱浸”时发生反应的离子方程式为___________ 。
(2)碱浸后的“滤渣”可以部分溶于稀硝酸,发生反应的化学方程式是___________ 。
(3)“沉碲”时控制溶液的pH为4.5〜5.0,生成TeO2沉淀。酸性不能过强,其原因是___________ ;防止局部酸度过大的操作方法是___________ 。
(4)“酸溶”后,将SO2通入TeCl4酸性溶液中进行“还原”得到碲,该反应的化学方程式是___________ 。
(5)25°C时,亚碲酸(H2TeO3)的Ka1=1×10-3,Ka2=2×10-8。
①0.1mol·L-1H2TeO3电离度α约为___________ 。(α= ×100%)
×100%)
②0.lmol•L-1的NaHTeO3溶液中,下列粒子的物质的量浓度关系正确的是___________ 。
A.c(Na+)>c(HTeO )>c(OH-)>c(H2TeO3)>c(H+)
)>c(OH-)>c(H2TeO3)>c(H+)
B.c(Na+)+c(H+)>=c(HTeO )+c(TeO
)+c(TeO )+c(OH-)
)+c(OH-)
C.c(Na+)=c(TeO )+c(HTeO
)+c(HTeO )+c(H2TeO3)
)+c(H2TeO3)
D.c(H+)+c(H2TeO3)=c(OH-)+e(TeO )
)

(1)“碱浸”时发生反应的离子方程式为
(2)碱浸后的“滤渣”可以部分溶于稀硝酸,发生反应的化学方程式是
(3)“沉碲”时控制溶液的pH为4.5〜5.0,生成TeO2沉淀。酸性不能过强,其原因是
(4)“酸溶”后,将SO2通入TeCl4酸性溶液中进行“还原”得到碲,该反应的化学方程式是
(5)25°C时,亚碲酸(H2TeO3)的Ka1=1×10-3,Ka2=2×10-8。
①0.1mol·L-1H2TeO3电离度α约为
 ×100%)
×100%)②0.lmol•L-1的NaHTeO3溶液中,下列粒子的物质的量浓度关系正确的是
A.c(Na+)>c(HTeO
 )>c(OH-)>c(H2TeO3)>c(H+)
)>c(OH-)>c(H2TeO3)>c(H+)B.c(Na+)+c(H+)>=c(HTeO
 )+c(TeO
)+c(TeO )+c(OH-)
)+c(OH-)C.c(Na+)=c(TeO
 )+c(HTeO
)+c(HTeO )+c(H2TeO3)
)+c(H2TeO3)D.c(H+)+c(H2TeO3)=c(OH-)+e(TeO
 )
)
您最近一年使用:0次




