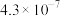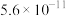常温下,叠氮酸( )是一元弱酸,高锰酸(
)是一元弱酸,高锰酸(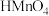 )是一元强酸,0.1
)是一元强酸,0.1 的高铼酸(
的高铼酸(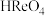 )、0.1
)、0.1 的高锰酸(
的高锰酸(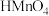 )溶液分别与0.1
)溶液分别与0.1 的NaOH溶液等体积混合,所得溶液均呈中性。请回答下列问题:
的NaOH溶液等体积混合,所得溶液均呈中性。请回答下列问题:
(1)高铼酸属于______ (填“强”或“弱”)酸,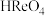 中Re的化合价为
中Re的化合价为______ 。
(2) 的电离方程式为
的电离方程式为______ ,常温下,已知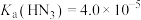 ,则0.1
,则0.1 的
的 溶液中
溶液中
______  。
。
(3)体积相同的高锰酸和醋酸溶液的pH均为2,若将两溶液稀释100倍,则pH变化较大的是_____________ ,向稀释后的溶液中分别加入0.1mol·L-1的NaOH溶液,则消耗NaOH体积较多的是_____________ 。
(4)已知25℃时,三种酸的电离常数如下:
写出下列在溶液中发生反应的离子方程式:
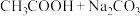 (少量):
(少量):______ ;
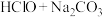 (少量):
(少量):______ 。
 )是一元弱酸,高锰酸(
)是一元弱酸,高锰酸(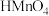 )是一元强酸,0.1
)是一元强酸,0.1 的高铼酸(
的高铼酸(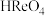 )、0.1
)、0.1 的高锰酸(
的高锰酸(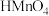 )溶液分别与0.1
)溶液分别与0.1 的NaOH溶液等体积混合,所得溶液均呈中性。请回答下列问题:
的NaOH溶液等体积混合,所得溶液均呈中性。请回答下列问题:(1)高铼酸属于
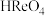 中Re的化合价为
中Re的化合价为(2)
 的电离方程式为
的电离方程式为 ,则0.1
,则0.1 的
的 溶液中
溶液中
 。
。(3)体积相同的高锰酸和醋酸溶液的pH均为2,若将两溶液稀释100倍,则pH变化较大的是
(4)已知25℃时,三种酸的电离常数如下:
化学式 |
|
| HClO |
|
|
|
|
| — |
| — |
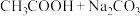 (少量):
(少量):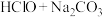 (少量):
(少量):
更新时间:2023-11-03 13:58:27
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式__ 。
(2)若溶液M由2mol•L-1NaHA溶液与2mol•L-1NaOH溶液等体积混合而得,则溶液M的pH__ 7(填“>”、“<”或“=”),溶液中离子浓度由大到小顺序为__ 。
(3)若溶液M由下列三种情况:①0.01mol•L-1的H2A溶液;②0.01mol•L-1的NaHA溶液;③0.02mol•L-1的HCl与0.04mol•L-1的NaHA溶液等体积混合液,则三种情况的溶液中H2A分子浓度最大的为__ ;pH由大到小的顺序为__ 。
(4)若溶液M由pH=3的H2A溶液V1mL与pH=11的NaOH溶液V2mL混合反应而得,混合溶液 =104,V1与V2的大小关系为
=104,V1与V2的大小关系为__ (填“大于”“等于”“小于”或“均有可能”)。
(1)写出酸H2A的电离方程式
(2)若溶液M由2mol•L-1NaHA溶液与2mol•L-1NaOH溶液等体积混合而得,则溶液M的pH
(3)若溶液M由下列三种情况:①0.01mol•L-1的H2A溶液;②0.01mol•L-1的NaHA溶液;③0.02mol•L-1的HCl与0.04mol•L-1的NaHA溶液等体积混合液,则三种情况的溶液中H2A分子浓度最大的为
(4)若溶液M由pH=3的H2A溶液V1mL与pH=11的NaOH溶液V2mL混合反应而得,混合溶液
 =104,V1与V2的大小关系为
=104,V1与V2的大小关系为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】实验室常用药品橱柜中摆列着如下几种试剂和药品:①浓盐酸②NaOH固体③1mol/LNaOH溶液④铜⑤(冰醋酸(纯醋酸)⑥1mol/LCH3COOH溶液⑦酒精⑧1mol/LNaHCO3溶液。回答下面问题:
(1)属于电解质的是____ (填序号)。
(2)用标有A、B、C的三个试管分别取20mL1mol/LCH3COOH溶液,在B试管中加入少量浓盐酸,在C试管中加入少量NaOH固体(不考虑溶液体积变化),三个试管中c(CH3COOH)最大的是____ (填字母,下同),c(CH3COO-)最大的是____ ,c(H+)最大的是____ 。
(3)已知CH3COOH的酸性大于H2CO3,向20mL1mol/L的CH3COOH溶液中加入10mL1mol/L的NaHCO3溶液,写出该反应的离子方程式____ 。利用平衡移动的原理解释该反应能够发生的原因____ 。
(4)已知肼(N2H4•2H2O)是一种二元弱碱,其电离方程式与氨水的电离相似,在肼的水溶液中c( •H2O)
•H2O)____ c(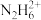 )(填“大于”“小于”或“等于”),写出肼的第一步电离方程式
)(填“大于”“小于”或“等于”),写出肼的第一步电离方程式____ 。
(5)资料显示:HClO的电离常数Ka=4.7×10-8;H2CO3的电离常数Ka1=4.3×10-7,Ka2=5.6×10-11。浓度相同的HClO溶液和H2CO3溶液比较,酸性较强的是____ (填化学式),向NaClO溶液中通入少量CO2气体,发生反应的离子方程式为_____ 。
(1)属于电解质的是
(2)用标有A、B、C的三个试管分别取20mL1mol/LCH3COOH溶液,在B试管中加入少量浓盐酸,在C试管中加入少量NaOH固体(不考虑溶液体积变化),三个试管中c(CH3COOH)最大的是
(3)已知CH3COOH的酸性大于H2CO3,向20mL1mol/L的CH3COOH溶液中加入10mL1mol/L的NaHCO3溶液,写出该反应的离子方程式
(4)已知肼(N2H4•2H2O)是一种二元弱碱,其电离方程式与氨水的电离相似,在肼的水溶液中c(
 •H2O)
•H2O)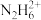 )(填“大于”“小于”或“等于”),写出肼的第一步电离方程式
)(填“大于”“小于”或“等于”),写出肼的第一步电离方程式(5)资料显示:HClO的电离常数Ka=4.7×10-8;H2CO3的电离常数Ka1=4.3×10-7,Ka2=5.6×10-11。浓度相同的HClO溶液和H2CO3溶液比较,酸性较强的是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】Ⅰ.在一定温度下,有a.盐酸b.硫酸c.醋酸三种酸,若三者 相同:
相同:
(1)物质的量浓度由大到小的顺序是_________________ ,(用字母表示,下同):
(2)若三者体积也相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的 (相同状况),则开始时反应速率的大小关系为
(相同状况),则开始时反应速率的大小关系为________________ ,反应所需时间的长短关系是________ 。
(3)若三者体积也相同时,分别与等浓度的 稀溶液反应至
稀溶液反应至 ,则消耗
,则消耗 溶液的体积大小关系为
溶液的体积大小关系为________ 。
Ⅱ.已知亚磷酸( )为二元弱酸,常温下,向某浓度的亚磷酸溶液中逐滴加入一定物质的量浓度的
)为二元弱酸,常温下,向某浓度的亚磷酸溶液中逐滴加入一定物质的量浓度的 溶液,混合溶液的pH与离子浓度的关系如图所示。
溶液,混合溶液的pH与离子浓度的关系如图所示。
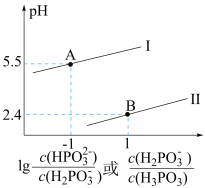
(4)写出亚磷酸电离的方程式:________________________ 、________________________ 。
(5)表示pH与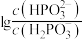 的变化关系的曲线是
的变化关系的曲线是________ (填“Ⅰ”或“Ⅱ”)。
(6)根据图像计算亚磷酸的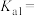
________ 。
 相同:
相同:(1)物质的量浓度由大到小的顺序是
(2)若三者体积也相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的
 (相同状况),则开始时反应速率的大小关系为
(相同状况),则开始时反应速率的大小关系为(3)若三者体积也相同时,分别与等浓度的
 稀溶液反应至
稀溶液反应至 ,则消耗
,则消耗 溶液的体积大小关系为
溶液的体积大小关系为Ⅱ.已知亚磷酸(
 )为二元弱酸,常温下,向某浓度的亚磷酸溶液中逐滴加入一定物质的量浓度的
)为二元弱酸,常温下,向某浓度的亚磷酸溶液中逐滴加入一定物质的量浓度的 溶液,混合溶液的pH与离子浓度的关系如图所示。
溶液,混合溶液的pH与离子浓度的关系如图所示。
(4)写出亚磷酸电离的方程式:
(5)表示pH与
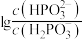 的变化关系的曲线是
的变化关系的曲线是(6)根据图像计算亚磷酸的
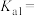
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】常温时,几种弱酸的电离平衡常数如表所示。
(1) 的电离平衡常数表达式K=
的电离平衡常数表达式K=_______ ,通过改变外界条件可以使K值发生变化,则使K值增大需改变的条件是_______ 。
(2)测得溶解了HClO的某稀硫酸的pH=5,则该溶液中HClO的电离度约为_______ (电离度是指已电离的电解质分子数占原来总分子数的百分比);pH相等的H2SO3、H2CO3、HClO的水溶液中,物质的量浓度由大到小的顺序为_______ 。
(3) 、
、 、
、 结合
结合 的能力由强到弱的顺序为
的能力由强到弱的顺序为_______ ;向Na2CO3溶液中滴加HClO溶液发生反应的离子方程式为_______ ;向 溶液中滴加HClO溶液发生反应的离子方程式为
溶液中滴加HClO溶液发生反应的离子方程式为_______ 。
| 酸 | 亚硫酸 | 碳酸 | 次氯酸 |
| 电离平衡常数 | 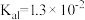 | 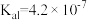 | 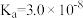 |
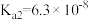 | 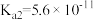 |
(1)
 的电离平衡常数表达式K=
的电离平衡常数表达式K=(2)测得溶解了HClO的某稀硫酸的pH=5,则该溶液中HClO的电离度约为
(3)
 、
、 、
、 结合
结合 的能力由强到弱的顺序为
的能力由强到弱的顺序为 溶液中滴加HClO溶液发生反应的离子方程式为
溶液中滴加HClO溶液发生反应的离子方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】按要求回答下列问题:
(1)已知NaHSO3溶液显酸性,溶液中存在以下平衡:
HSO +H2O
+H2O H2SO3+OH- ①
H2SO3+OH- ①
HSO
 H++SO
H++SO ②
②
向0.1 mol·L-1的NaHSO3溶液中加入少量NaOH固体,则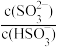
_______ (填“增大”“减小”或“不变”)。
(2)氯常用作饮用水的杀菌剂,且HClO的杀菌能力比ClO-强。
25 ℃时氯气—氯水体系中存在以下平衡关系:
Cl2(g) Cl2(aq) ①
Cl2(aq) ①
Cl2(aq) + H2O HClO + H+ + Cl- ②
HClO + H+ + Cl- ②
HClO H+ + ClO- ③
H+ + ClO- ③
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。_______ ,
由图可知该常数值为_______ 。
②用氯处理饮用水时,夏季的杀菌效果比冬季_______ (填“好”或“差”)。
(1)已知NaHSO3溶液显酸性,溶液中存在以下平衡:
HSO
 +H2O
+H2O H2SO3+OH- ①
H2SO3+OH- ①HSO

 H++SO
H++SO ②
②向0.1 mol·L-1的NaHSO3溶液中加入少量NaOH固体,则
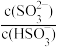
(2)氯常用作饮用水的杀菌剂,且HClO的杀菌能力比ClO-强。
25 ℃时氯气—氯水体系中存在以下平衡关系:
Cl2(g)
 Cl2(aq) ①
Cl2(aq) ①Cl2(aq) + H2O
 HClO + H+ + Cl- ②
HClO + H+ + Cl- ②HClO
 H+ + ClO- ③
H+ + ClO- ③其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。
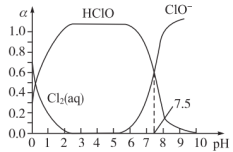
由图可知该常数值为
②用氯处理饮用水时,夏季的杀菌效果比冬季
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】磷能形成多种含氧酸。
(1)一元中强酸次磷酸(H3PO2)是一种精细化工产品,向10 mL H3PO2溶液中加入10 mL等物质的量浓度的NaOH溶液后,所得的溶液中只有H2PO2-、OH-两种阴离子。
① 写出H3PO2溶液与足量NaOH 溶液反应后形成的正盐的化学式:_______ ,该正盐溶液中各离子浓度由大到小的顺序为____________ 。
② 若25℃时,K (H3PO2) = 1×10-2,则0.01 mol · L-1的H3PO2溶液的pH =________ 。
(2)亚磷酸(H3PO3)是二元中强酸,25℃时亚磷酸的电离常数为K1= 3.7×10-2、K2=2.6×10-7。
试从电离平衡移动的角度解释K1、K2数据的差异______________ 。
(3) 25 ℃时,HF的电离常数为K = 3.6×10-4; H3PO4的电离常数为K1=7.5×10-3,K2=6.2×10-8,K3=4.4×10-13。足量NaF溶液和H3PO4溶液反应的离子方程式为______ 。
(4)相同温度下,等物质的量浓度的上述三种磷的含氧酸中。c(H+)由大到小的顺序为______________________________________________________ (用酸的分子式表示)。
(1)一元中强酸次磷酸(H3PO2)是一种精细化工产品,向10 mL H3PO2溶液中加入10 mL等物质的量浓度的NaOH溶液后,所得的溶液中只有H2PO2-、OH-两种阴离子。
① 写出H3PO2溶液与足量NaOH 溶液反应后形成的正盐的化学式:
② 若25℃时,K (H3PO2) = 1×10-2,则0.01 mol · L-1的H3PO2溶液的pH =
(2)亚磷酸(H3PO3)是二元中强酸,25℃时亚磷酸的电离常数为K1= 3.7×10-2、K2=2.6×10-7。
试从电离平衡移动的角度解释K1、K2数据的差异
(3) 25 ℃时,HF的电离常数为K = 3.6×10-4; H3PO4的电离常数为K1=7.5×10-3,K2=6.2×10-8,K3=4.4×10-13。足量NaF溶液和H3PO4溶液反应的离子方程式为
(4)相同温度下,等物质的量浓度的上述三种磷的含氧酸中。c(H+)由大到小的顺序为
您最近一年使用:0次