I.血液中的化学,正常体温下,人体动脉血液的pH大约在7.35~7.45.之所以能够控制在该范围内,主要是因为H2CO3分子与HCO3−共存形成“缓冲溶液”[体温下Ka1(H2CO3) = 7.9 × 10−7,Ka2(H2CO3) = 1.6 × 10−11)。若血液pH超出正常范围,则可能导致酸中毒或碱中毒。
(1)若正常体温下人体动脉血pH为7.2,则属于___________ 中毒(填“酸”或“碱”)。该血液中c(OH−)___________ 10−6.8 mol/L(填“>”、“<”或“=”)。
(2)理论上,也可通过血液中c(H2CO3):c( )的比值判定血液是否发生酸中毒或碱中毒,下列比值中属于正常情况的是__________。
)的比值判定血液是否发生酸中毒或碱中毒,下列比值中属于正常情况的是__________。
II.从心脏出发的动脉血会被输送至器官,为有机物的代谢(如葡萄糖的充分氧化)提供所需氧气。血液中氧气被消耗,并产生代谢产物,作为静脉血流回心脏。部分代谢产物可以在呼吸中排出。
(3)葡萄糖充分氧化的产物为________ (填物质化学式),该反应的ΔH ___ 0(填“>”、“<”或“=”)。
(4)一般来说,静脉血的pH值___________ (填“>”、“<”或“=”)动脉血的pH值。
(5)可能导致血液c(H2CO3):c( )比值变小的情况是___________。
)比值变小的情况是___________。
(1)若正常体温下人体动脉血pH为7.2,则属于
(2)理论上,也可通过血液中c(H2CO3):c(
 )的比值判定血液是否发生酸中毒或碱中毒,下列比值中属于正常情况的是__________。
)的比值判定血液是否发生酸中毒或碱中毒,下列比值中属于正常情况的是__________。| A.20:1 | B.10:1 | C.1 :10 | D.1 :20 |
II.从心脏出发的动脉血会被输送至器官,为有机物的代谢(如葡萄糖的充分氧化)提供所需氧气。血液中氧气被消耗,并产生代谢产物,作为静脉血流回心脏。部分代谢产物可以在呼吸中排出。
(3)葡萄糖充分氧化的产物为
(4)一般来说,静脉血的pH值
(5)可能导致血液c(H2CO3):c(
 )比值变小的情况是___________。
)比值变小的情况是___________。| A.糖类物质代谢速率变快 | B.糖类物质代谢速率变慢 |
| C.呼吸频率加快 | D.呼吸频率减慢 |
更新时间:2023-11-15 16:44:17
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】大气中二氧化碳浓度不断攀升,带来一系列全球性环境问题,如何实现二氧化碳的高效利用、最终实现碳中和,对人类未来的可持续发展至关重要。
(1)CO2可作为单体转化为烃进行二次利用。
已知:①CO2(g)+4H2(g) CH4(g)+2H2O(g) △H=-166.84kJ·mol-1
CH4(g)+2H2O(g) △H=-166.84kJ·mol-1
②2CO2(g)+6H2(g) C2H4(g)+4H2O(g) △H=-268.65kJ·mol-1
C2H4(g)+4H2O(g) △H=-268.65kJ·mol-1
③3CO2(g)+10H2(g) C3H8(g)+6H2O(g) △H=-131.505kJ·mol-1
C3H8(g)+6H2O(g) △H=-131.505kJ·mol-1
则丙烷裂解生成甲烷和乙烯的热化学方程式为___ 。
(2)催化CO2加氢合成乙酸在减少碳排放的同时还可以生产重要的化工原料。某实验小组采用电导法测定乙酸的电离平衡常数Kc,已知电离度α=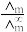 ,
, 为一定浓度下电解质的摩尔电导率,
为一定浓度下电解质的摩尔电导率,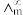 为无限稀释时溶液的摩尔电导率,
为无限稀释时溶液的摩尔电导率,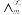 =0.045S·m2·mol-1(T=308.2K),实验测定T=308.2K时,0.01mol·L-1乙酸的
=0.045S·m2·mol-1(T=308.2K),实验测定T=308.2K时,0.01mol·L-1乙酸的 为0.002S·m2·mol-1,则该条件下测定的乙酸的电离平衡常数Kc为
为0.002S·m2·mol-1,则该条件下测定的乙酸的电离平衡常数Kc为___ (列出计算式)。
(3)碳酸二乙酯(DEC)为一种非常重要的有机化工原料,以乙醇和CO2为原料直接合成DEC有很大的经济和环保意义。2C2H5OH(g)+CO2(g) C2H5O(CO)OC2H5(DEC)(g)+H2O(g),恒压条件下向该容器中充入一定量的Ar气体,反应物平衡转化率
C2H5O(CO)OC2H5(DEC)(g)+H2O(g),恒压条件下向该容器中充入一定量的Ar气体,反应物平衡转化率___ (填“增大”“减小”或“不变”),某温度下向恒容密闭容器中按照系数比投料时,平衡前后压强比为6∶5,平衡时压强为p0kPa,则平衡常数Kp=___ 。
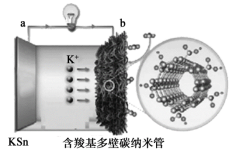
(4)某科研团队将K—CO2电池中活泼的钾金属电极材料替换成KSn合金开发了稳定高效的可遵循环电池,实现了CO2再利用。研究发现正极电极产物有碳酸盐和碳,则该CO2应在电池哪一侧充入___ (填“a”或“b”),正极电极反应式为___ 。
(5)在Zn或Zn—Cu催化作用下均可发生反应CO2(g)+H2(g) CO(g)+H2O(g);已知Zn作催化剂时,该反应的活化能大于Zn—Cu作催化剂时反应的活化能,则
CO(g)+H2O(g);已知Zn作催化剂时,该反应的活化能大于Zn—Cu作催化剂时反应的活化能,则___ (填“Zn”或“Zn—Cu”)作催化剂时,该反应的反应速率更快。
(1)CO2可作为单体转化为烃进行二次利用。
已知:①CO2(g)+4H2(g)
 CH4(g)+2H2O(g) △H=-166.84kJ·mol-1
CH4(g)+2H2O(g) △H=-166.84kJ·mol-1②2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g) △H=-268.65kJ·mol-1
C2H4(g)+4H2O(g) △H=-268.65kJ·mol-1③3CO2(g)+10H2(g)
 C3H8(g)+6H2O(g) △H=-131.505kJ·mol-1
C3H8(g)+6H2O(g) △H=-131.505kJ·mol-1则丙烷裂解生成甲烷和乙烯的热化学方程式为
(2)催化CO2加氢合成乙酸在减少碳排放的同时还可以生产重要的化工原料。某实验小组采用电导法测定乙酸的电离平衡常数Kc,已知电离度α=
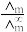 ,
, 为一定浓度下电解质的摩尔电导率,
为一定浓度下电解质的摩尔电导率,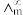 为无限稀释时溶液的摩尔电导率,
为无限稀释时溶液的摩尔电导率,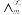 =0.045S·m2·mol-1(T=308.2K),实验测定T=308.2K时,0.01mol·L-1乙酸的
=0.045S·m2·mol-1(T=308.2K),实验测定T=308.2K时,0.01mol·L-1乙酸的 为0.002S·m2·mol-1,则该条件下测定的乙酸的电离平衡常数Kc为
为0.002S·m2·mol-1,则该条件下测定的乙酸的电离平衡常数Kc为(3)碳酸二乙酯(DEC)为一种非常重要的有机化工原料,以乙醇和CO2为原料直接合成DEC有很大的经济和环保意义。2C2H5OH(g)+CO2(g)
 C2H5O(CO)OC2H5(DEC)(g)+H2O(g),恒压条件下向该容器中充入一定量的Ar气体,反应物平衡转化率
C2H5O(CO)OC2H5(DEC)(g)+H2O(g),恒压条件下向该容器中充入一定量的Ar气体,反应物平衡转化率(4)某科研团队将K—CO2电池中活泼的钾金属电极材料替换成KSn合金开发了稳定高效的可遵循环电池,实现了CO2再利用。研究发现正极电极产物有碳酸盐和碳,则该CO2应在电池哪一侧充入

(5)在Zn或Zn—Cu催化作用下均可发生反应CO2(g)+H2(g)
 CO(g)+H2O(g);已知Zn作催化剂时,该反应的活化能大于Zn—Cu作催化剂时反应的活化能,则
CO(g)+H2O(g);已知Zn作催化剂时,该反应的活化能大于Zn—Cu作催化剂时反应的活化能,则
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】25℃时,有关物质的电离常数如下表:
(1)碳酸的二级电离平衡常数表达式为K=___________ 。
(2)25℃时,下列五种离子结合质子的能力由大到小的顺序是___________ (用字母表示)。
A. B.
B.  C.
C.  D.
D.  E.
E. 
(3)下列反应不能发生的是___________(填正确答案标号)。
(4)25℃时,向100mL0.1 的HNO2溶液中加入蒸馏水,将其稀释到1L后,下列说法错误的是___________(填正确答案标号)。
的HNO2溶液中加入蒸馏水,将其稀释到1L后,下列说法错误的是___________(填正确答案标号)。
(5)常温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序是___________ 。
| 物质 | CH3COOH | H2CO3 | HClO | HNO2 |
| 电离常数 |  | 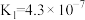 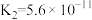 |  |  |
(1)碳酸的二级电离平衡常数表达式为K=
(2)25℃时,下列五种离子结合质子的能力由大到小的顺序是
A.
 B.
B.  C.
C.  D.
D.  E.
E. 
(3)下列反应不能发生的是___________(填正确答案标号)。
A. |
B. |
C.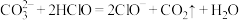 |
D.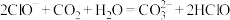 |
 的HNO2溶液中加入蒸馏水,将其稀释到1L后,下列说法错误的是___________(填正确答案标号)。
的HNO2溶液中加入蒸馏水,将其稀释到1L后,下列说法错误的是___________(填正确答案标号)。| A.HNO2的电离程度增大 | B.Ka(HNO2)增大 |
C.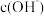 增大 增大 | D.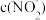 减小 减小 |
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】 溶液和盐酸中的
溶液和盐酸中的 均为
均为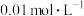 ,请根据下列操作回答问题:
,请根据下列操作回答问题:
(1)取 溶液,加入等体积的水,
溶液,加入等体积的水, 的电离平衡(
的电离平衡(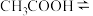
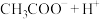 )
)______________ (填“向左”“向右”或“不”)移动;另取 溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中
溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中 的值将
的值将_______________ (填“增大”“减小”或“无法确定”)。
(2)相同条件下,取等体积的 溶液和盐酸,各稀释100倍。稀释后的溶液,其氢离子浓度大小关系为
溶液和盐酸,各稀释100倍。稀释后的溶液,其氢离子浓度大小关系为 溶液
溶液_________________ (填“>”“<”或“=”)盐酸。
(3)取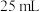 的
的 溶液,加入等体积
溶液,加入等体积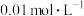 的NaOH溶液,反应后溶液中
的NaOH溶液,反应后溶液中 、
、 的大小关系为
的大小关系为
_________________ (填“>”“<”或“=”) 。
。
 溶液和盐酸中的
溶液和盐酸中的 均为
均为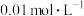 ,请根据下列操作回答问题:
,请根据下列操作回答问题:(1)取
 溶液,加入等体积的水,
溶液,加入等体积的水, 的电离平衡(
的电离平衡(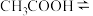
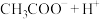 )
) 溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中
溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中 的值将
的值将(2)相同条件下,取等体积的
 溶液和盐酸,各稀释100倍。稀释后的溶液,其氢离子浓度大小关系为
溶液和盐酸,各稀释100倍。稀释后的溶液,其氢离子浓度大小关系为 溶液
溶液(3)取
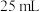 的
的 溶液,加入等体积
溶液,加入等体积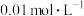 的NaOH溶液,反应后溶液中
的NaOH溶液,反应后溶液中 、
、 的大小关系为
的大小关系为
 。
。
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】物质在水溶液中有不同的性质。按要求回答下列问题:
(1)Na2SO3溶液显碱性,其原因是______________________________ (用离子方程式表示),该溶液中各离子浓度由大到小的顺序为______________________ 。
(2)室温下向10mL氨水溶液中加水稀释后,下列量增大的有__________ (填编号,下同),减小的有_____________ 。
a.溶液中氢氧离子浓度 b.氨水的电离程度c.水的离子积常数 d.c(H+)/ c(NH3·H2O)
(3)亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。NaClO2变质可分解为NaClO3和NaCl。取等质量已变质和未变质的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量________________ (填“相同”或“不相同”),其原因是____________________________________ 。
(1)Na2SO3溶液显碱性,其原因是
(2)室温下向10mL氨水溶液中加水稀释后,下列量增大的有
a.溶液中氢氧离子浓度 b.氨水的电离程度c.水的离子积常数 d.c(H+)/ c(NH3·H2O)
(3)亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。NaClO2变质可分解为NaClO3和NaCl。取等质量已变质和未变质的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
①0.1mol/LNaCN溶液和0.1mol/LNaHCO3溶液中,c(CN-)__ c(HCO3-)(填“>”、“<”或“=”)。
②常温下,物质的量浓度相同的三种溶液:A.CH3COONa;B.NaCN;C.Na2CO3,其pH由大到小的顺序是___ (填编号)。
③将少量CO2通入NaCN溶液,反应的离子方程式是__ 。
④室温下,-定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是__ ,溶液中 =
=__ 。(写出准确数值)
(2)某温度下,pH=3的盐酸中c(OH-)=10-9mol/L。该温度下,pH=2的H2SO4与pH=11的NaOH混合后pH变为9,则硫酸与氢氧化钠的体积比为__ 。
(3)室温下,用0.100mol/L盐酸溶液滴定20.00mL0.l00mol/L的某氨水溶液,滴定曲线如图所示(横坐标为盐酸的体积)。
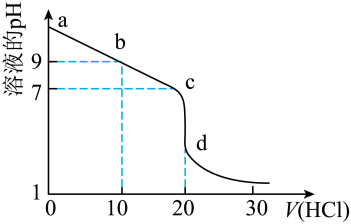
①d点所示的溶液中离子浓度由大到小的顺序依次为__ 。
②b点所示的溶液中c(NH4+)-c(NH3·H2O)=___ 。
(4)已知Ksp(BaSO4)=1.1×10-10,其溶解度为___ g。(保留2位有效数字)
(5)室温下,已知Ksp(Fe(OH)3)=1×10-38,当Fe3+完全沉淀时,其溶液的pH=___ 。
(1)已知部分弱酸的电离常数如下表:
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离常数(25℃) | Ka=1.8×10-5 | Ka=4.3×l0-10 | Ka1=5.0×l0-7 Ka2=5.6×l0-11 |
②常温下,物质的量浓度相同的三种溶液:A.CH3COONa;B.NaCN;C.Na2CO3,其pH由大到小的顺序是
③将少量CO2通入NaCN溶液,反应的离子方程式是
④室温下,-定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是
 =
=(2)某温度下,pH=3的盐酸中c(OH-)=10-9mol/L。该温度下,pH=2的H2SO4与pH=11的NaOH混合后pH变为9,则硫酸与氢氧化钠的体积比为
(3)室温下,用0.100mol/L盐酸溶液滴定20.00mL0.l00mol/L的某氨水溶液,滴定曲线如图所示(横坐标为盐酸的体积)。

①d点所示的溶液中离子浓度由大到小的顺序依次为
②b点所示的溶液中c(NH4+)-c(NH3·H2O)=
(4)已知Ksp(BaSO4)=1.1×10-10,其溶解度为
(5)室温下,已知Ksp(Fe(OH)3)=1×10-38,当Fe3+完全沉淀时,其溶液的pH=
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】常温下,将某一元酸 HA 和 NaOH 溶液等体积混合,两种溶液的浓度和混合后所得溶液的 pH 如表:
请回答:
(1)用离子方程式表示①组混合溶液显碱性的原因是_____ 。
(2)②组中c_____ 0.2(填“>”、“<”或“=”,下同);③组中 a_____ 9。
(3)常温下,HA 的电离平衡常数的值为_____ 。
(4)从以上实验分析,将 pH=11 的 NaOH 溶液与 pH=3 的 HA 溶液等体积混合,所得混合溶液中所有离子浓度由大到小的顺序为_____ 。
| 实验编号 | HA物质的量浓度/(mol•L-1) | NaOH物质的量浓度/( mol•L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.2 | pH=a |
(1)用离子方程式表示①组混合溶液显碱性的原因是
(2)②组中c
(3)常温下,HA 的电离平衡常数的值为
(4)从以上实验分析,将 pH=11 的 NaOH 溶液与 pH=3 的 HA 溶液等体积混合,所得混合溶液中所有离子浓度由大到小的顺序为
您最近一年使用:0次



